Введение
Современная биотехнология опирается на достижения естествознания, техники, технологии, биохимии, микробиологии, молекулярной биологии, генетики. Биологические методы используются в борьбе с загрязнением окружающей среды и вредителями растительных и животных организмов. К достижениям биотехнологии можно также отнести применение иммобилизованных ферментов, получение синтетических вакцин, использование клеточной технологии в племенном деле.
Бактерии, грибы, водоросли, лишайники, вирусы, простейшие в жизни людей играют значительную роль. С давних времен люди использовали их в процессах хлебопечения, приготовления вина и пива, в различных производствах.
Микроорганизмы помогают людям в производстве эффективных питательных белковых веществ и биологического газа. Их используют при применении биотехнических методов очистки воздуха и сточных вод, при использовании биологических методов уничтожения сельскохозяйственных вредителей, при получении лечебных препаратов, при уничтожении утильсырья.
Основная цель данной работы – изучить методы и условия культивирования микроорганизмов
Задачи:
· Ознакомиться с областями применения микроорганизмов
· Изучить морфологию и физиологию микроорганизмов
· Изучить основные виды и состав питательных сред
· Дать понятие и ознакомиться с биореактором
· Раскрыть основные методы культивирования микроорганизмов
Области использования микроорганизмов
Микроорганизмы, и прежде всего бактерии, - классический объект для решения общих вопросов генетики, биохимии, биофизики, космической биологии. Бактерии широко используются при решении многих проблем биотехнологии.
Создана биотехнологическая промышленность для получения антибиотиков, ферментов, интерферона, органических кислот и других метаболитов, продуцентами которых являются многие микроорганизмы.
Некоторые грибы родов Aspergillus и Fusarium (A.flavus, A.ustus, A.oryzae, F.sporotrichiella) способны гидролизовать сердечные глюкозиды, ксилозиды и рамнозиды, а также гликозиды, содержащие в качестве конечного сахара глюкозу, галактозу или арабинозу. С помощью A.terreus получают никотиновую кислоту.
Продуцентами биологически активных веществ являются многие простейшие. В частности, простейшие обитающие в рубце жвачных животных, вырабатывают фермент целлюлазу, способствующий разложению клетчатки (целлюлозы). Простейшие являются продуцентами не только ферментов, но и гистонов, серотонина, липополисахаридов, липополипептидоглюканов, аминокислот, метаболитов, применяемых в медицине и ветеринарии, пищевой и текстильной промышленностях. Они являются одним из объектов, применяемых в биотехнологии.
Поскольку биомасса простейших содержит до 50% белка, свободноживущие простейшие используются в качестве источника кормового белка для животных.
Микроорганизмы широко используются в пищевой и бродильной промышленности.
Ферментные препараты Aspergillus oryzae используются в пивоваренной промышленности, а ферменты A.niger используются при производстве и осветлении плодовоягодных соков и лимонной кислоты. Выпечка хлебобулочных изделий улучшается при использовании ферментов A.oryzae и A.awamori. При производстве лимонной кислоты, уксуса, кормовых и хлебопекарных изделий производственные показатели улучшаются при применении в технологическом процессе Aspergillus niger и актиномицетов. Применение очищенных препаратов пектиназы из мицелия A.niger при получении соков способствует увеличению их выхода, снижению вязкости и увеличению осветления.
Бактериальные ферменты (Bac.subtilis) используются для сохранения свежести кондитерских изделий и там, где нежелателен глубокий распад белковых веществ.
Использование ферментных препаратов из Bac.subtilis в кондитерском и хлебобулочном производстве способствует улучшению качества и замедлению процесса червстления изделий.
В молочной промышленности очень широко используются молочные дрожжи. С их помощью приготавливают кумыс, кефир. Ферментами этих микроорганизмов молочный сахар разлагается до спирта и углекислоты, в результате этого улучшается вкус продукта и повышается его усвояемость организмом. При получении молочнокислых продуктов в молочной промышленности широко используются дрожжи, не сбраживающие молочный сахар и не разлагающие белки и жир. Они способствуют сохранению масла и увеличению жизнеспособности молочнокислых бактерий. Пленчатые дрожжи (микодерма) способствуют созреванию молочнокислых сыров.
При приготовлении масла используют ароматизирующие бактерии и молочнокислые стрептококки Str.lactis, Str.cremoris, Str.diacetilactis, Str.citrovorus, Str.paracitrovorus.
Ложные молочнокислые бактерии (E.coli commune, Bact. Lactis aerogenes и др.) участвуют в процессах силосования зеленых кормов.
Использование активных штаммов видов микроскопических грибов способствует обогащению белками и аминокислотами таких кормов как комбикорм, жом, отруби. Для этой цели используют селекционированные нетоксичные быстро растущие виды термо- и мезофильных микромицетов Fusarium sp., Thirlavia sp., а также некоторые виды высших грибов.
Селекционированные штаммы природного гиперсинтетика каротина гриба Blakeslee trispora используют при промышленном получении каротина, имеющего важное значение в процессах роста и развития животных, повышения их устойчивости к заболеваниям.
В сельском хозяйстве применяется биологическая защита растений от вредителей. С этой целью используются различные организмы – бактерии, грибы, вирусы, простейшие, птицы, млекопитающие и другие организмы.
Селекционированные штаммы Trichoderma viride используют при промышленном получении на их основе препарата триходермина для борьбы с фитопатогенными грибами, особенно при выращивании растений в условиях закрытого грунта (фузариоза огурцов, болезней цветочных растений).
В наши дни изготавливают микробиологические препараты, уничтожающие многих вредных насекомых. С помощью энтеробактерина можно бороться почти со всеми гусеницами бабочек.
Среди вредителей плодово – ягодных растений – яблоневая моль, боярышница, златоглазка, кольчатый шелкопряд, листовертки и др. Против колорадского жука применяют боверин, а паразитический гриб ашерсонию – против белокрылки.
Вирусный препарат вирин очень эффективен против гусениц, повреждающих лесные древесные породы.
В сельском хозяйстве с целью повышения урожайности используются бактериальные удобрения такие как азотобактерин (готовится из азотобактера), нитрагин (из клубеньковых бактерий), фосфобактерин (из Bac. Megatherium).
Почвенные микроорганизмы являются одной из наиболее крупных экологических групп. Они играют важную роль в минерализации органических веществ и образовании гумуса. В сельском хозяйстве почвенные микроорганизмы используются для производства удобрений.
Фосфобактерин, полученный из Baccilus megathrtium, является эффективным средством повышения урожайности кормовой свеклы, капусты, картофеля, кукурузы. Под влиянием этого препарата повышается содержание растворимого фосфора в ризосферной почве, а также фосфора и азота в зеленой массе.
Важнейшим условием высокой продуктивности бобовых растений является улучшение синтеза азотных веществ бобовыми растениями за счет азота воздуха. Большую роль в усвоении атмосферного азота растениями играют клубеньковые микробы из родов Rhizobium, Eubacteriales, Actinomycetales, Mycobacteriales, виды Azotobacter chroococcum, Clostridium pasterianum.
Из клеток Clostridium pasterianum, Rhodospirillum rubrum, Bac.polymixa, бактерий родов Chromatium и Klebsiella получены азотфиксирующие препараты, способствующие усвоению азота воздуха растениями.
1. Морфология и физиология микроорганизмов
1.1. Морфология
Классификация микроорганизмов
Бактерии
Бактерии - это одноклеточные прокариотные микроорганизмы. Величина их измеряется в микрометрах (мкм). Различают три основные формы: шаровидные бактерии - кокки, палочковидные и извитые.
Кокки (греч. kokkos - зерно) имеют шаровидную или слегка вытянутую форму. Различаются между собой в зависимости от того, как они располагаются после деления. Одиночно расположенные кокки - микрококки, расположенные попарно - диплококки. Стрептококки делятся в одной плоскости и после деления не расходятся, образуя цепочки (греч. streptos - цепочка). Тетракокки образуют сочетания из четырех кокков в результате деления в двух взаимно перпендикулярных плоскостях, сарцины (лат. sarcio - связывать) образуются при делении в трех взаимно перпендикулярных плоскостях и имеют вид скоплений по 8-16 кокков. Стафилококки в результате беспорядочного деления образуют скопления, напоминающие гроздь винограда (греч. staphyle - виноградная гроздь).
Палочковидные бактерии (греч. bacteria - палочка), способные образовывать споры, называют бациллами в том случае, если спора не шире самой палочки, и клостридиями, если диаметр споры превышает диаметр палочки. Палочковидные бактерии, в отличие от кокков, разнообразны по величине, форме и расположению клеток: короткие (1 -5 мкм) толстые, с закругленными концами бактерии кишечной группы; тонкие, слегка изогнутые палочки туберкулеза; располагающиеся под углом тонкие палочки дифтерии; крупные (3-8 мкм) палочки сибирской язвы с "обрубленными" концами, образующие длинные цепочки - стрептобациллы.
К извитым формам бактерий относятся вибрионы, имеющие слегка изогнутую форму в виде запятой (холерный вибрион) и спириллы, состоящие из нескольких завитков. К извитым формам также относятся кампилобактеры, похожие под микроскопом на крылья летящей чайки.
Структура бактериальной клетки.
Структурные элементы бактериальной клетки можно условно разделить на:
а) постоянные структурные элементы - имеются у каждого вида бактерий, в течение всей жизни бактерии; это клеточная стенка, цитоплазматическая мембрана, цитоплазма, нуклеоид;
 б) непостоянные структурные элементы,
которые способны образовывать не все виды бактерий, а те бактерии, которые
образуют их, могут терять их и вновь приобретать в зависимости от условий
существования. Это капсула, включения, пили, споры, жгутики.
б) непостоянные структурные элементы,
которые способны образовывать не все виды бактерий, а те бактерии, которые
образуют их, могут терять их и вновь приобретать в зависимости от условий
существования. Это капсула, включения, пили, споры, жгутики.
Рис. 1.1. Структура бактериальной клетки
Клеточная стенка покрывает всю поверхность клетки. У грамположительных бактерий клеточная стенка более толстая: до 90% - это полимерное соединение пептидогликан, связанный с тейхоевыми кислотами, и слой белка. У грамотрицательных бактерий клеточная стенка тоньше, но сложнее по составу: состоит из тонкого слоя пептидогликана, липополисахаридов, белков; она покрыта наружной мембраной.
Функции клеточной стенкисостоят в том, что она:
• является осмотическим барьером,
• определяет форму бактериальной клетки,
• защищает клетку от воздействий окружающей среды,
• несет разнообразные рецепторы, способствующие прикреплению фагов, колицинов, а также различных химических соединений,
• через клеточную стенку в клетку поступают питательные вещества и выделяются продукты обмена,
• в клеточной стенке локализован О-антиген и с ней связан эндотоксин (липид А) бактерий.
Цитоплазматическая мембрана
К клеточной стенке бактерий примыкает цитоплазматическая мембрана, строение которой аналогично мембранам эукариотов (состоит из двойного слоя липидов, главным образом фосфолипидов со встроенными поверхностными и интегральными белками). Она обеспечивает:
• селективную проницаемость и транспорт растворимых веществ в клетку,
• транспорт электронов и окислительное фосфорилирование,
• выделение гидролитических экзоферментов, биосинтез различных полимеров.
Цитоплазматическая мембрана ограничивает цитоплазму бактерий, которая представляет собой гранулярную структуру. В цитоплазме локализованы рибосомыи бактериальный нуклеоид, в ней также могут находиться включения и плазмиды (внехромосомная ДНК). Кроме обязательных структур бактериальные клетки могут иметь споры.
Цитоплазма - внутреннее гелеобразное содержимое бактериальной клетки, пронизано мембранными структурами, создающими жесткую систему. В цитоплазме содержатся рибосомы (в которых осуществляется биосинтез белков), ферменты, аминокислоты, белки, рибонуклеиновые кислоты.
Нуклеоид - это хромосома бактерий, двойная нить ДНК, кольцевидно замкнутая, связанная с мезосомой. В отличие от ядра эукариотов, нить ДНК свободно располагается в цитоплазме, не имеет ядерной оболочки, ядрышка, белков-гистонов. Нить ДНК во много раз длиннее самой бактерии (например, у кишечной палочки длина хромосомы более 1 мм).
Помимо нуклеоида, в цитоплазме могут находиться внехромосомные факторы наследственности, называемые плазмидами. Это короткие кольцевидные нити ДНК, прикрепленные к мезосомам.
Включения содержатся в цитоплазме некоторых бактерий в виде зерен, которые можно обнаружить при микроскопии. Большей частью это запас питательных веществ.
Пили (лат. pili - волоски) иначе реснички, фимбрии, бахромки, ворсинки - короткие нитевидные отростки на поверхности бактерий.
Жгутики. Многие виды бактерий способны передвигаться благодаря наличию жгутиков. Из патогенных бактерий только среди палочек и извитых форм имеются подвижные виды. Жгутики представляют собой тонкие эластичные нити, длина которых у некоторых видов в несколько раз больше длины тела самой бактерии.
Число и расположение жгутиков является характерным видовым признаком бактерий. Различают бактерии: монотрихи - с одним жгутиком на конце тела, лофотрихи - с пучком жгутиков на конце, амфитрихи, имеющие жгутики на обоих концах, и перитрихи, у которых жгутики расположены по всей поверхности тела. К монотрихам относится холерный вибрион, к перитрихам - сальмонеллы брюшного тифа.
Капсула - наружный слизистый слой, который имеется у многих бактерий. У одних видов он настолько тонок, что обнаруживается только в электронном микроскопе - это микрокапсула. У других видов бактерий капсула хорошо выражена и видна в обычном оптическом микроскопе - это макрокапсула.
Микоплазмы
Микоплазмы относятся к прокариотам, размеры их 125-200 нм. Это наиболее мелкие из клеточных микробов, величина их близка к пределу разрешающей способности оптического микроскопа. У них отсутствует клеточная стенка. С отсутствием клеточной стенки связаны характерные особенности микоплазм. Они не имеют постоянной формы, поэтому встречаются сферические, овальные, нитевидные формы.
Риккетсии
Риккетсии - прокариотные микробы. Риккетсии сходны с бактериями по клеточному строению и структуре, а с вирусами их сближает строгий внутриклеточный паразитизм. Они не могут размножаться вне живых клеток хозяина, так как не синтезируют дыхательные ферменты и поэтому неспособны к самостоятельному биологическому окислению. В отличие от вирусов, они содержат оба вида нуклеиновых кислот - ДНК и РНК - и осуществляют процесс биосинтеза белков.
Хламидии
Хламидии - мелкие прокариотные микробы, сходные по химическому составу с грамотрицательными бактериями. Это строгие внутриклеточные паразиты, так как не образуют АТФ и потому не способны к самостоятельному процессу биологического окисления, т.е. это "энергетические паразиты".
Актиномицеты
Актиномицеты - одноклеточные микроорганизмы, относятся к прокариотам. Их клетки имеют такую же структуру, как бактерии: клеточную стенку, содержащую пептидогликан, цитоплазматическую мембрану; в цитоплазме расположены нуклеоид, рибосомы, мезосомы, внутриклеточные включения. Поэтому патогенные актиномицеты чувствительны к антибактериальным препаратам. В то же время они имеют сходную с грибами форму ветвящихся переплетающихся нитей, а некоторые актиномицеты, относящиеся к семейству стрентомицет, размножаются спорами. Другие семейства актиномицет размножаются путем фрагментации, то есть распада нитей на отдельные фрагменты.
Актиномицеты широко распространены в окружающей среде, особенно в почве, участвуют в круговороте веществ в природе. Среди актиномицетов есть продуценты антибиотиков, витаминов, гормонов. Большинство антибиотиков, применяемых в настоящее время, продуцируется актиномицетами. Это стрептомицин, тетрациклин и другие.
Спирохеты.
Спирохеты относятся к прокариотам. Имеют признаки, общие как с бактериями, так и с простейшими микроорганизмами. Это одноклеточные микробы, имеющие форму длинных тонких спирально изогнутых клеток, способны к активному движению. В неблагоприятных условиях некоторые из них могут переходить в форму цисты.
Исследования в электронном микроскопе позволили установить структуру клеток спирохет. Это цитоплазматические цилиндры, окруженные цитоплазматической мембраной и клеточной стенкой, содержащей пептидогликан. В цитоплазме находятся нуклеоид, рибосомы, мезосомы, включения.
Под цитоплазматической мембраной расположены фибриллы, обеспечивающие разнообразное движение спирохет - поступательное, вращательное, сгибательное.
Патогенные представители спирохет: Treponema pallidum - вызывает сифилис, Borrelia recurrentis - возвратный тиф, Borrelia burgdorferi - болезнь Лайма, Leptospira interrogans - лептоспироз.
Грибы
Грибы (Fungi, Mycetes) - эукариоты, низшие растения, лишенные хлорофилла, в связи с чем они не синтезируют органические соединения углерода, то есть это гетеротрофы, имеют дифференцированное ядро, покрыты оболочкой, содержащей хитин. В отличие от бактерий, грибы не имеют в составе оболочки пептидогликана, поэтому нечувствительны к пенициллинам. Для цитоплазмы грибов характерно присутствие большого количества разнообразных включений и вакуолей.
Среди микроскопических грибов (микромицетов) имеются одноклеточные и многоклеточные микроорганизмы, различающиеся между собой по морфологии и способам размножения. Для грибов характерно разнообразие способов размножения: деление, фрагментация, почкование, образование спор - бесполых и половых.
При микробиологических исследованиях наиболее часто приходиться сталкиваться с плесенями, дрожжами и представителями сборной группы так называемых несовершенных грибов.
Плесени образуют типичный мицелий, стелющийся по питательному субстрату. От мицелия вверх подымаются воздушные ветви, которые оканчиваются плодоносящими телами различной формы, несущими споры.
Мукоровые или головчатые плесени (Mucor) - одноклеточные грибы с шаровидным плодоносящим телом, наполненным эндоспорами.
Плесени рода Aspergillus - многоклеточные грибы с плодоносящим телом, при микроскопии напоминающим наконечник лейки, разбрызгивающей струйки воды; отсюда название "леечная плесень". Некоторые виды аспергилл используются в промышленности для производства лимонной кислоты и других веществ. Есть виды, вызывающие заболевания кожи и легких у человека - аспергиллезы.
Плесени рода Penicillum, или кистевики - многоклеточные грибы с плодоносящим телом в виде кисточки. Из некоторых видов зеленой плесени был получен первый антибиотик - пенициллин. Среди пенициллов есть патогенные для человека виды, вызывающие пенициллиоз.
Различные виды плесеней могут быть причиной порчи пищевых продуктов, медикаментов, биологических препаратов.
Дрожжи - дрожжевые грибы (Saccharomycetes, Blastomycetes) имеют форму круглых или овальных клеток, во много раз крупнее бактерий. Средний размер дрожжевых клеток приблизительно равен поперечнику эритроцита (7-10 мкм).
Строение клетки дрожжей. Дрожжевые организмы имеют все стандартные компоненты, присущие эукариотическим клеткам.
Клетки содержат мембраны, цитоплазму, а также такие органоиды, как:
· ядро;
· Гольджи аппарат;
· Митохондрии клеток;
· рибосомный аппарат;
· жировые включения, зерна гликогена, а также валютин.
Отдельные виды имеют в составе пигменты. У молодых дрожжей цитоплазма является гомогенной. В процессе роста внутри них появляются вакуоли (содержащие органические и минеральные компоненты). В процессе роста наблюдается образование зернистости, происходит увеличение вакуолей.
Как правило, оболочки включают нескольких слоев с включенными полисахаридами, жирами и азотосодержащими компонентами. Некоторые из видов имеют ослизнелую оболочку, поэтому часто клетки склеены между собой и в жидкостях образовывают хлопья.
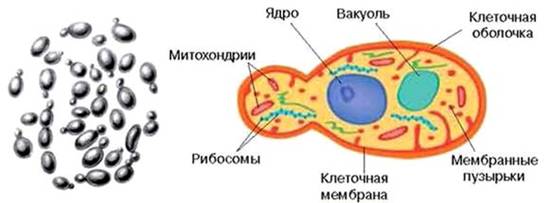
Рис. 1.2 Строение клетки дрожжевых организмов.
Рис. 1.3. Дрожжи под микроскопом.
Отличительной морфологической особенностью дрожжей является отсутствие нитевидного мицелия и обычное размножение почкованием. На поверхности материнских клеток возникают отростки, которые, отделившись затем от материнской клетки, превращаются в самостоятельные новые особи. Кроме почкования, истинные дрожжи могут размножаться половым способом, образуя аски - половые споры.
Большинство видов дрожжей непатогенны. Их способность вызывать брожение широко используется в промышленности - в хлебопечении, виноделии, в получении спиртов и витаминов.
Существуют патогенные дрожжевые грибы, вызывающие заболевания, например, Blastomyces dermatitidis - возбудитель бластомикоза, Pneumocystis carinii - возбудитель пневмоцистоза легких.
Вирусы
Вирусы - (лат. virus яд) — мельчайшие микроорганизмы, не имеющие клеточного строения, белоксинтезирующей системы и способные к воспроизведению лишь в клетках высокоорганизованных форм жизни. Они широко распространены в природе, поражают животных, растения и другие микроорганизмы.
Зрелая вирусная частица, известная как вирион, состоит из нуклеиновой кислоты - генетический материал (ДНК либо РНК), который несет информацию о нескольких типах белков, необходимых для образования нового вируса - покрытой защитной белковой оболочкой — капсидом. Капсид складывается из одинаковых белковых субъединиц, называемыхкапсомерами. Вирусы могут также иметь липидную оболочку поверх капсида (суперкапсид), образованную из мембраны клетки-хозяина. Капсид состоит из белков, кодируемых вирусным геномом, а его форма лежит в основе классификации вирусов по морфологическому признаку[71][72]. Сложноорганизованные вирусы, кроме того, кодируют специальные белки, помогающие в сборке капсида. Комплексы белков и нуклеиновых кислот известны как нуклеопротеины, а комплекс белков вирусного капсида с вирусной нуклеиновой кислотой называется нуклеокапсидом.

Рис. 1.4. Схематичное строение вируса: 1 - сердцевина (однонитчатая РНК); 2 - белковая оболочка (Капсид); 3 - дополнительная липопротеидная оболочка; 4 - Капсомеры (структурные части Капсида).
1.2.Физиология микроорганизмов
Физиология микроорганизмов изучает жизнедеятельность микробных клеток, процессы их питания, дыхания, роста, размножения, закономерности взаимодействия с окружающей средой.
Метаболизм
Метаболизм – совокупность биохимических процессов, направленных на получение энергии и воспроизведение клеточного материала.
Особенности метаболизма у бактерий:
1) многообразие используемых субстратов;
2) интенсивность процессов метаболизма;
3) направленность всех процессов метаболизма на обеспечение процессов размножения;
4) преобладание процессов распада над процессами синтеза;
5) наличие экзо– и эндоферментов метаболизма.
Метаболизм складывается из двух взаимосвязанных процессов: катаболизма и анаболизма.
Катаболизм (энергетический метаболизм) – это процесс расщепления крупных молекул до более простых, в результате которого выделяется энергия, накапливающаяся в форме АТФ:
а) дыхание;
б) брожение.
Анаболизм (конструктивный метаболизм) – обеспечивает синтез макромолекул, из которых строится клетка:
а) анаболизм (с затратами энергии);
б) катаболизм (с выделением энергии);
При этом используется энергия, полученная в процессе катаболизма. Для метаболизма бактерий характерны высокая скорость процесса и быстрая адаптация к меняющимся условиям окружающей среды.
В микробной клетке ферменты являются биологическими катализаторами. По строению выделяют:
1) простые ферменты (белки);
2) сложные; состоят из белковой (активного центра) и небелковой частей; необходимы для активизации ферментов.
По месту действия выделяют:
1) экзоферменты (действуют вне клетки; принимают участие в процессе распада крупных молекул, которые не могут проникнуть внутрь бактериальной клетки; характерны для грамположительных бактерий);
2) эндоферменты (действуют в самой клетке, обеспечивают синтез и распад различных веществ).
В зависимости от катализируемых химических реакций все ферменты делят на шесть классов:
1) оксидоредуктазы (катализируют окислительно-восстановительные реакции между двумя субстратами);
2) трансферазы (осуществляют межмолекулярный перенос химических групп);
3) гидролазы (осуществляют гидролитическое расщепление внутримолекулярных связей);
4) лиазы (присоединяют химические группы по двум связям, а также осуществляют обратные реакции);
5) изомеразы (осуществляют процессы изомеризации, обеспечивают внутреннюю конверсию с образованием различных изомеров);
6) лигазы, или синтетазы (соединяют две молекулы, вследствие чего происходит расщепление пирофосфатных связей в молекуле АТФ).
Питание
Под питанием понимают процессы поступления и выведения питательных веществ в клетку и из клетки. Питание в первую очередь обеспечивает размножение и метаболизм клетки.
Различные органические и неорганические вещества поступают в бактериальную клетку в процессе питания. Специальных органов питания у бактерий нет. Вещества проникают через всю поверхность клетки, в виде мелких молекул. Такой способ питания называется голофитным. Необходимым условием для прохождения питательных веществ в клетку является их растворимость в воде и малая величина (т.е. белки должны быть гидролизованы до аминокислот, углеводы – до ди- или моносахаридов и т. д.).
Основным регулятором поступления веществ в бактериальную клетку является цитоплазматическая мембрана. Существует четыре основных механизма поступления веществ:
-пассивная диффузия— по градиенту концентрации, энергонезатратная, не имеющая субстратной специфичности;
— облегченная диффузия— по градиенту концентрации, субстратспецифичная, энергонезатратная, осуществляется при участии специализированных белков пермеаз;
— активный транспорт- против градиента концентрации, субстратспецифичен (специальные связывающие белки в комплексе с пермеазами), энергозатратный (за счет АТФ), вещества поступают в клетку в химически неизмененном виде;
— транслокация (перенос групп) — против градиента концентрации, с помощью фосфотрансферазной системы, энергозатратна, вещества (преимущественно сахара) поступают в клетку в форфорилированном виде.
Основные химические элементы- органогены, необходимые для синтеза органичеких соединений- углерод, азот, водород, кислород.
Типы питания. Широкому распространению бактерий способствует разнообразные типы питания. Микробы нуждаются в углероде, кислороде, азоте, водороде, сере, фосфоре и других элементах (органогенах).
В зависимости от источника получения углерода бактерии делят на:
1) аутотрофы (используют неорганические вещества – СО2);
2) гетеротрофы;
3) метатрофы (используют органические вещества неживой природы);
4) паратрофы (используют органические вещества живой природы).
Процессы питания должны обеспечивать энергетические потребности бактериальной клетки.
По источникам энергии микроорганизмы делят на:
1) фототрофы (способны использовать солнечную энергию);
2) хемотрофы (получают энергию за счет окислительно-восстановительных реакций);
3) хемолитотрофы (используют неорганические соединения);
4) хемоорганотрофы (используют органические вещества).
Среди бактерий выделяют:
1) прототрофы (способны сами синтезировать необходимые вещества из низкоорганизованных);
2) ауксотрофы (являются мутантами прототрофов, потерявшими гены; ответственны за синтез некоторых веществ – витаминов, аминокислот, поэтому нуждаются в этих веществах в готовом виде).
Микроорганизмы ассимилируют питательные вещества в виде небольших молекул, поэтому белки, полисахариды и другие биополимеры могут служить источниками питания только после расщепления их экзоферментами до более простых соединений.
Дыхание микроорганизмов.
Путем дыхания микроорганизмы добывают энергию. Дыхание- биологический процесс переноса электронов через дыхательную цепь от доноров к акцепторам с образованием АТФ. В зависимости от того, что является конечным акцептором электронов, выделяют аэробное и анаэробное дыхание. При аэробном дыхании конечным акцептором электронов является молекулярный кислород (О2), при анаэробном- связанный кислород ( -NO3 , =SO4, =SO3).
Примеры.
 О2
О2
 Аэробное
дыхание донор водорода H2O
Аэробное
дыхание донор водорода H2O
Анаэробное дыхание
 нитратное
окисление NO3
нитратное
окисление NO3
 (факультативные
анаэробы) донор водорода N2
(факультативные
анаэробы) донор водорода N2
 сульфатное
окисление SO4
сульфатное
окисление SO4
 (облигатные
анаэробы) донор водорода H2S
(облигатные
анаэробы) донор водорода H2S
По типу дыхания выделяют четыре группы микроорганизмов.
1.Облигатные (строгие) аэробы. Им необходим молекулярный (атмосферный) кислород для дыхания.
2.Микроаэрофилы нуждаются в уменьшенной концентрации (низком парциальном давлении) свободного кислорода. Для создания этих условий в газовую смесь для культивирования обычно добавляют CO2, например до 10- процентной концентрации.
3.Факультативные анаэробы могут потреблять глюкозу и размножаться в аэробных и анаэробных условиях. Среди них имеются микроорганизмы, толерантные к относительно высоким (близких к атмосферным) концентрациям молекулярного кислорода — т.е. аэротолерантные,
а также микроорганизмы которые способны в определенных условиях переключаться с анаэробного на аэробное дыхание.
4.Строгие анаэробы размножаются только в анаэробных условиях т.е. при очень низких концентрациях молекулярного кислорода, который в больших концентрациях для них губителен. Биохимически анаэробное дыхание протекает по типу бродильных процессов, молекулярный кислород при этом не используется.
Аэробное дыхание энергетически более эффективно (синтезируется большее количество АТФ).
В процессе аэробного дыхания образуются токсические продукты окисления (H2O2— перекись водорода, -О2 — свободные кислородные радикалы), от которых защищают специфические ферменты, прежде всего каталаза, пероксидаза, пероксиддисмутаза. У анаэробов эти ферменты отсутствуют, также как и система регуляции окислительно- восстановительного потенциала (rH2).
Рост и размножение бактерий
Рост бактерий – увеличение бактериальной клетки в размерах без увеличения числа особей в популяции.
Размножение бактерий – процесс, обеспечивающий увеличение числа особей в популяции. Бактерии характеризуются высокой скоростью размножения.
Рост всегда предшествует размножению. Бактерии размножаются поперечным бинарным делением, при котором из одной материнской клетки образуются две одинаковые дочерние.
Процесс деления бактериальной клетки начинается с репликации хромосомной ДНК. В точке прикрепления хромосомы к цитоплазматической мембране (точке-репликаторе) действует белок-инициатор, который вызывает разрыв кольца хромосомы, и далее идет деспирализация ее нитей. Нити раскручиваются, и вторая нить прикрепляется к цитоплазматической мембране в точке-прорепликаторе, которая диаметрально противоположна точке-репликатору. За счет ДНК-полимераз по матрице каждой нити достраивается точная ее копия. Удвоение генетического материала – сигнал для удвоения числа органелл. В септальных мезосомах идет построение перегородки, делящей клетку пополам. Двухнитевая ДНК спирализуется, скручивается в кольцо в точке прикрепления к цитоплазматической мембране. Это является сигналом для расхождения клеток по септе. Образуются две дочерние особи.
Размножение бактерий определяется временем генерации. Это период, в течение которого осуществляется деление клетки. Продолжительность генерации зависит от вида бактерий, возраста, состава питательной среды, температуры и др.
Взаимодействие с окружающей средой
Находясь в процессе развития в
тесном взаимодействии со средой, микроорганизмы не только могут изменяться под
её воздействием, но могут изменять среду в соответствии с особенностями. Так
микробы в процессе дыхания выделяют продукты обмена, которые в свою очередь
изменяют химический состав среды, поэтому меняется реакция среды и содержание
различных химических веществ.
Все факторы, влияющие на развитие
микробов, делят на:
• Физические
• Химические
• Биологические
Физические факторы
Температура
По отношению к температурным условиям микроорганизмы разделяют на термофильные,
психрофильные и мезофильные.
• Термофильные виды. Зона оптимального роста равна 50-60 оС, верхняя зона
задержки роста – 75 оС.
• Психрофильные виды (холодолюбивые) растут в диапазоне температур 0-10 оС, максимальная зона задержки роста 20-30 оС.
• Мезофильные виды лучше растут в пределах 20-40 оС; максимальная 43-45 оС, минимальная 15-20 оС.
Высокая температура вызывает
коагуляцию структурных белков и ферментов микроорганизмов. Большинство
вегетативных форм гибнет при температуре 60 оС в течение 30 мин, а при 80-100
оС – через 1 мин. Споры бактерий устойчивы к температуре 100 оС, гибнут при 130
оС и более длительной экспозиции (до 2 ч.).
Для сохранения жизнеспособности относительно благоприятны низкие температуры
(например, ниже 0 оС), безвредные для большинства микробов. Бактерии выживают
при температуре ниже –100 оС; споры бактерий и вирусы годами сохраняются в
жидком азоте (до –250 оС).
Влажность
При относительной влажности окружающей среды ниже 30 процентов
жизнедеятельность большинства бактерий прекращается. Время их отмирания при
высушивании различно (например, холерный вибрион – за 2 суток, а микобактерии –
за 90 суток). Поэтому высушивание не используют как метод элиминации микробов с
субстратов. Особой устойчивостью обладают споры бактерий.
Влияние концентрации растворов
на рост микроорганизмов опосредовано изменением активности воды как меры
доступной для организма воды. И если содержание солей вне клетки окажется выше
их концентрации в клетке, то вода будет выходить из клетки. Угнетение
патогенных бактерий хлористым натрием обычно начинается при его концентрации
около 3 процентов.
Излучения
Солнечный свет губительно действует на микроорганизмы, исключением являются
фототрофные виды. Наибольший микробицидный эффект оказывает коротковолновые
УФ-лучи. Энергию излучения используют для дезинфекции, а также для стерилизации
термолабильных материалов.
Ультразвук
Определенные частоты ультразвука при искусственном воздействии способны
вызывать деполимеризацию органелл микробных клеток, под действием ультразвука
газы, находящиеся в жидкой среде цитоплазмы, активируются и внутри клетки
возникает высокое давление ( до 10 000 атм). Это приводит к разрыву клеточной
оболочки и гибели клетки. Ультразвук используют для стерилизации пищевых
продуктов (молока, фруктовых соков), питьевой воды.
Давление
Бактерии относительно мало чувствительны к изменению гидростатического
давления. Повышение давления до некоторого предела не сказывается на скорости
роста обычных наземных бактерий, но в конце концов начинает препятствовать
нормальному росту и делению. Некоторые виды бактерий выдерживают давление до 3
000 – 5 000 атм, а бактериальные споры - даже 20 000 атм. В условиях
глубокого вакуума субстрат высыхает и жизнь невозможна.
Фильтрование
Для удаления микроорганизмов применяют различные материалы (мелкопористое
стекло, целлюлоза, коалин); они обеспечивают эффективную элиминацию
микроорганизмов из жидкостей и газов. Фильтрацию применяют для стерилизации
жидкостей, чувствительных к температурным воздействиям, разделения микробов и
их метаболитов (экзотоксинов, ферментов), а также для выделения вирусов.
Химические факторы
Способность ряда химических веществ подавлять жизнедеятельность микроорганизмов зависит от концентрации химических веществ и времени контакта с микробом. Дезинфектанты и антисептики дают неспецифический микробицидный эффект.
Бактерицидным действием
обладают химические вещества различных групп: кислоты, щелочи, спирты,
поверхностно-активные вещества, фенолы и их производные, соли
тяжелых металлов, окислители, группа формальдегида, газообразные вещества
и др. Большое разнообразие природы и химической
структуры указанных
веществ обусловливает и различные механизмы их
бактерицидного действия на микробную клетку.
Бактерицидное действие кислот зависит от их электролитической диссоциации, то
есть концентрации Н-ионов в растворах и их окисляющего действия.
Чувствительность к кислотам различна у разных микроорганизмов. Так, показано,
что если оптимальная концентрация Н-ионов для CI. botulinum соответствует 7,6
то при доведении рН до 4,6 наступает гибель этих бактерий. Самое низкое
значение рН, при которой еще наблюдался рост, — это 4,8 при рН 4,7 могут
прорастать только споры, а при рН 4,6 наступает прекращение роста вообще.
Бактерицидная активность едких щелочей зависит от степени диссоциации и
концентрации ОН-ионов. Наибольшей бактерицидной силой обладает КОН, затем
следуют NaOH и другие щелочи. Так же как и в отношении кислот, бактерии
обладают определенной щелочной устойчивостью.
Спирты. При разведении спирт приобретает бактерицидные свойства, причем
наибольшей бактерицидностью обладает 70 процентный спирт. Более высокие
концентрации свертывают белок, который выпадает на поверхности бактерий и
уменьшает проникновение спирта в глубь клетки. Бактерицидность спиртов
увеличивается с возрастанием молекулярной массы в ряду: метиловый — этиловый —
пропиловый — бутиловый — амиловый и т.д.
Поверхностно-активные вещества — это жирные кислоты, мыла, детергенты. Все они
изменяют энергетические соотношения на поверхности раздела, устремляются к
поверхности раздела клетки и повреждают клеточную оболочку, не затрагивая
внутренних структур клетки.
Красители. К красителям с бактерицидными свойствами относят бриллиантовый
зеленый, этакридин, флавакридин и др. В основе их действия лежит выраженное
сродство с фосфорнокислыми группами нук-леопротеидов.
Фенолы и их производные первоначально повреждают клеточную стенку, а затем и
белки бактериальной клетки.
Соли тяжелых металлов (свинец, медь, цинк, серебро, ртуть) и их соли оказывают
коагулирующее влияние на цитоплазму либо на ферментные системы, связывая их
сульфгидрильные группы.
Окислители — хлор, йод, марганцовокислый калий, перекись водорода и др.,
окисляют существенные компоненты цитоплазмы (сульфгидрильные группы активных
белков, фенольные, тиоэтильные, индольные, аминные).
Формальдегид также денатурирует белки, он убивает как вегетативные формы, так и
споры.
Химические вещества (хлор,
формальдегид, щелочи, кислоты, фенол и др.) используются в практике в качестве
дезинфицирующих веществ. Дезинфекция заключается в уничтожении патогенных
микробов. К ней обычно прибегают для обеззараживания помещений, скотных дворов,
территории.
Биологические факторы
К
биологическим средствам могут быть отнесены препараты,
содержащие живых особей - бактериофагов и бактерий, обладающих
выраженной конкурентной активностью по отношению к патогенным
и условно-патогенным для человека и животных видам
микробов. Они вводятся в организм в жизнеспособном состоянии.
Фаги и антагонисты оказывают прямое повреждающее действие на
патогенных и условно-патогенных микробов; изготовленные из
них лекарственные препараты предназначены для
местного применения, для них характерна специфичность действия
на микроорганизмы и безвредность для пациента; целью их
внесения в организм человека и животных является
лечение или профилактика инфекционных заболеваний. По механизму
действия они близки к химическим антисептикам.
Необходимо также помнить и о молочнокислых бактериях, которые вызывают процесс
молочнокислого брожения. Некоторые молочнокислые бактерии способны
синтезировать антибиотики и с их помощью подавлять развитие болезнетворных
микробов.
2. Культивирование микроорганизмов
Культивирование микроорганизмов – это один из основных приемов в микробиологии. Для роста и развития микроорганизмов в природе и в лабораторных условиях необходимо наличие питательных веществ для энергетических и конструктивных реакций. Требования разных групп микроорганизмов к источникам энергии и химическим элементам определяются их метаболическими возможностями. Выращивание и поддержание микробных культур в лаборатории основано на моделировании естественных условий обитания данного организма в лаборатории, а также на знании особенностей обмена веществ.
Культивирование является основной стадией технологического процесса и во многом определяет количественные и качественные характеристики производства биопрепаратов. На стадии культивирования осуществляется накопление как самой биомассы, так и продуктов метаболизма (жизнедеятельности) микроорганизмов.
Началом исследований по культивированию микроорганизмов является 1830 год, когда Каньяр де Латур, Кютцинг и Шван установили, что во многих бродильных процессах «повинны» рост и размножение дрожжей и других микроорганизмов. Либих и многие другие химики были противниками такого мнения, что затормозило эти исследования на 20 лет. В 1850 году Луи Пастер, исследуя физиологию дрожжей и бактерий, ввел асептические методы исследований и на минимальных питательных средах доказал, что спиртово-, молочно-, уксусно- и маслянокислое брожения вызываются различными микроорганизмами, обладающими различными потребностями в питательных веществах и кислороде.
Первая наиболее полноценная среда была приготовлена учеником Л. Пастера Ролэномв 1869 году для грибов рода Aspergillus. Хотя в распоряжении Л. Пастера не было метода чистых культур, но ему с учениками удалось, пользуясь элективными средами, доказать потребность микроорганизмов в главных и второстепенных компонентах среды и в источниках энергии.
В 1870 году Р. Кох ввел в практическую микробиологию метод чистых культур, гарантировавших получение на предложенных им плотных питательных средах чистых культур только определенных видов бактерий.
Потребность в сложных веществах, необходимых для микроорганизмов и именуемых в настоящее время «факторами роста», впервые установил Вильдье в 1901 году. Он доказал, что витамин В является одним из факторов, необходимых для роста дрожжей. На первых этапах микробиологических исследовании культивирование микроорганизмов осуществляли в пробирках или колбах путем выращивания их на поверхности плотных или жидких сред. Для более объемного промышленного культивирования микроорганизмов с целью получения из них различных биопрепаратов стали переходить на использование стеклянной посуды большой емкости (матрасы, бутыли). Причем, в такой посуде выращивали микроорганизмы главным образом на плотных агаровых средах. Новым этапом в культивировании микроорганизмов явился примененный в 1933 году Клюйвером и Пергиным способ встряхивания колб с жидкой средой на качалках с принудительной подачей стерильного воздуха. На этой основе был разработан так называемый глубинный метод выращивания микроорганизмов.
Промышленный биотехнологический процесс, в котором для производства коммерческих продуктов используют клеточные системы или микроорганизмы, обычно включает три ключевые стадии:
— подготовительную (обработка сырья, используемого в качестве источника питательных веществ, и приготовление , если это необходимо, питательных сред);
— биотехнологическую (рост микроорганизмов-мишеней в большом — обычно объемом более 100 л — биореакторе (ферментация) с последующим образованием нужного метаболита, например антибиотика, аминокислоты или белка (биотрансформация));
— получения готовой продукции (очистка целевого продукта от компонентов культуральной среды или от клеточной массы).
Ключевым направлением биотехнологии является интенсификация производственных процессов. Этого можно достичь как путем использования новых высокопродуктивных биообъектов, так и путем применения эффективных технологических режимов. Необходимо подобрать оптимальный субстрат, разработать конструкцию аппарата, оптимизировать условия культивирования биообъекта, обеспечить автоматический контроль за протеканием процесса, разработать способ выделения и очистки готового целевого продукта.
2.1. Питательные среды
Для культивирования бактерий используют питательные среды, к которым предъявляется ряд требований.
1. Питательность. Бактерии должны содержать все необходимые питательные вещества.
2. Изотоничность. Бактерии должны содержать набор солей для поддержания осмотического давления, определенную концентрацию хлорида натрия.
3. Оптимальный рН (кислотность) среды. Кислотность среды обеспечивает функционирование ферментов бактерий; для большинства бактерий составляет 7,2–7,6.
4. Оптимальный электронный потенциал, свидетельствующий о содержании в среде растворенного кислорода. Он должен быть высоким для аэробов и низким для анаэробов.
5. Прозрачность (наблюдался рост бактерий, особенно для жидких сред).
6. Стерильность (отсутствие других бактерий).
Классификация питательных сред
1. По происхождению:
1) естественные (молоко, желатин, картофель и др.);
2) искусственные – среды, приготовленные из специально подготовленных природных компонентов (пептона, аминопептида, дрожжевого экстракта и т. п.);
3) синтетические – среды известного состава, приготовленные из химически чистых неорганических и органических соединений (солей, аминокислот, углеводов и т. д.).
2. По составу:
1) простые – мясопептонный агар, мясопептонный бульон, агар Хоттингера и др.;
2) сложные – это простые с добавлением дополнительного питательного компонента (кровяного, шоколадного агара): сахарный бульон,
желчный бульон, сывороточный агар, желточно-солевой агар, среда Китта—Тароцци, среда Вильсона—Блера и др.
3. По консистенции:
1) твердые (содержат 3–5 % агар-агара);
2) полужидкие (0,15—0,7 % агар-агара);
3) жидкие (не содержат агар-агара).
Агар- полисахарид сложного состава из морских водорослей, основной отвердитель для плотных (твердых) сред.
4. В зависимости от назначения ПС различают:
• дифференциально-диагностические
• элективные
• селективные
• ингибиторные
• среды для поддержания культуры
• накопительные (насыщения, обогащения)
• консервирующие
• контрольные.
Дифференциально-диагностические - это сложные среды, на которых микроорганизмы разных видов растут по-разному, в зависимости от биохимических свойств культуры. Они предназначены для идентификации видовой принадлежности микроорганизмов, широко используются в клинической бактериологии и проведении генетических исследований.
Селективные, ингибиторные и элективные ПС предназначены для выращивания строго определенного вида микроорганизма. Эти среды служат для выделения бактерий из смешанных популяций и дифференцирования их от сходных видов. В их состав добавляют различные вещества, подавляющие рост одних видов и не влияющие на рост других.
Среду можно сделать селективной за счет величины рН. В последнее время в качестве веществ, придающих средам селективный характер, применяют антимикробные агенты, такие как антибиотики и другие химиотерапевтические вещества.
Элективные ПС нашли широкое применение при выделении возбудителей кишечных инфекций. При добавлении малахитовой или бриллиантовой зелени, солей желчных кислот (в частности, таурохолево-кислого натрия), значительного количества хлорида натрия или лимоннокислых солей подавляется рост кишечной палочки, но рост патогенных бактерий кишечной группы не ухудшается. Некоторые элективные среды готовят с добавлением антибиотиков.
Среды для поддержания культуры составляют так, чтобы в них не было селективных веществ, способных вызывать изменчивость культур.
Накопительные ПС (обогащения, насыщения) — это среды, на которых определенные виды культур или группы культур растут быстрее и интенсивнее сопутствующих. При культивировании на этих средах обычно не применяются ингибиторные вещества, а, наоборот, создают благоприятные условия для определенного присутствующего в смеси вида. Основой сред накопления являются желчь и ее соли, тетратионат натрия, различные красители, селенитовые соли, антибиотики и др.
Консервирующие среды служат для первичного посева и транспортировки исследуемого материала.
Выделяют также контрольные ПС, которые применяют для контроля стерильности и общей бактериальной обсемененности антибиотиков.
5. По набору питательных веществ выделяют:
• минимальные среды, которые содержат лишь источники питания, достаточные для роста;
• богатые среды, в состав которых входят многие дополнительные вещества.
6. По масштабам использования ПС подразделяются на:
> производственные (технологические);
> среды для научных исследований с ограниченным по объему применением.
Производственные ПС должны быть доступными, экономичными, удобными в приготовлении и использовании для крупномасштабного культивирования. Среды для научных исследований, как правило, бывают синтетическими и богатыми по набору питательных веществ.
Выбор сырьевых источников для конструирования питательных сред
Качество ПС во многом определяется полноценностью состава питательных субстратов и исходного сырья, используемого для их приготовления. Большое разнообразие видов сырьевых источников ставит сложную задачу выбора наиболее перспективных, пригодных для конструирования ПС требуемого качества. Определяющую роль в данном вопросе играют, прежде всего, биохимические показатели состава сырья, от которых зависит выбор способа и режимов его переработки с целью наиболее полного и эффективного использования содержащихся в нем питательных веществ.
Для получения ПС с особо ценными свойствами применяют прежде всего традиционные источники белка животного происхождения, а именно мясо крупного рогатого скота (КРС), казеин, рыбу и продукты ее переработки. Наиболее полно разработаны и широко применяются ПС на основе мяса КРС.
Учитывая дефицит кильки каспийской, широко применяемой в недалеком прошлом, для получения рыбных питательных основ стала использоваться более дешевая и доступная непищевая продукция рыбной промышленности - сухой криль, отходы переработки мяса криля, филетированный минтай и его перезрелую икру. Наибольшее же распространение получила рыбная кормовая мука (РКМ), удовлетворяющая требованиям биологической ценности, доступности и относительной стандартности.
Довольно широкое распространение получили ПС на основе казеина, который содержит все компоненты, имеющиеся в молоке: жир, лактозу, витамины, ферменты и соли. Однако необходимо отметить, что в связи с удорожанием продуктов переработки молока, а также повышением спроса на казеин на мировом рынке, применение его носит несколько ограниченный характер.
Из непищевых источников белка животного происхождения в качестве сырья для конструирования полноценных ПС необходимо выделить кровь убойных животных, которая богата биологически активными веществами и микроэлементами и содержит продукты клеточного и тканевого обмена.
Гидролизаты крови сельскохозяйственных животных используются в качестве заменителей пептона в дифференциально-диагностических питательных средах.
К другим видам белоксодержащего сырья животного происхождения, которые могут быть использованы для конструирования ПС, относятся: плацента и селезенка КРС, сухой белковый концентрат - продукт переработки мясных отходов, спилковая обрезь, получаемая при обработке кожи, эмбрионы домашних птиц - отход вакцинного производства, кровезаменители с истекшим сроком годности, творожная сыворотка, мягкие ткани моллюсков и ластоногих.
Перспективно использование тушек пушных зверей из зверохозяйств, крови КРС, получаемой на мясокомбинате, обезжиренного молока и молочной сыворотки (отходы маслозаводов).
В целом же ПС, приготовленные из сырья животного происхождения, имеют высокое содержание основных питательных компонентов, являются полноценными и сбалансированными по аминокислотному составу и достаточно хорошо изучены.
Из продуктов растительного происхождения в качестве белкового субстрата для ПС возможно использование кукурузы, сои, гороха, картофеля, люпина и др. Однако, растительное сельскохозяйственное сырье содержит белок, несбалансированный состав которого зависит от условий выращивания культур, а также липиды в больших количествах, чем продукты животного происхождения.
Обширную группу составляют ПС, изготавливаемые из белкового сырья микробного происхождения (дрожжи, бактерии и т.д.). Аминокислотный состав микроорганизмов, служащих субстратом для приготовления ПС, хорошо изучен, а биомасса используемых микроорганизмов является полноценной по составу питательных веществ и характеризуется повышенным содержанием лизина и треонина.
Разработан целый ряд ПС комбинированного состава из белковых субстратов различного происхождения. К ним относятся дрожжевая казеиновая питательная среда, дрожжевая мясная и т.д. Основой большинства известных ПС являются гидролизаты казеина, мяса КРС и рыбы (до 80%).
Удельный же вес непищевого сырья в технологии конструирования ПС составляет всего 15% и в дальнейшем требует увеличения.
Используемое для получения питательной основы (ПС) непищевое сырье должно удовлетворять определенным требованиям, а именно быть:
^ полноценным (количественный и качественный состав сырья должен, в основном, удовлетворять питательным потребностям микроорганизмов и клеток, для которых разрабатываются ПС);
^ доступным (иметь достаточно обширную сырьевую базу);
^ технологичным (затраты на внедрение в производство должны осуществляться с использованием имеющегося оборудования или существующей технологии);
^ экономичным (затраты на внедрение технологии при переходе на новое сырье и его переработку не должны превосходить нормы затрат для получения целевого продукта);
^ стандартным (иметь длительные сроки хранения без изменения физико-химических свойств и питательной ценности)
2.2. Устройства для культивирования микроорганизмов
Для осуществления процесса культивирования микроорганизмов используются биореакторы.
Биореактор – это система, имеющая ограничивающую поверхность, в которой протекают биохимические реакции.
Промышленный биореактор – это емкость, в которой осуществляются рост микроорганизмов и/или различные химические превращения.
Однако существуют принципы, общие по форме, но различающиеся по практической реализации:
1) принцип масштабирования – поэтапное увеличение объема аппаратов;
2) принцип однородности физико-химических условий – температуры, рН, концентрации растворенных веществ (кислород и др. газы) во всем объеме аппарата.
Для биотехнологических процессов характерны следующие этапы:
1) загрузка субстратов для реакций синтеза;
2) превращения субстратов;
3) отделение и очистка целевого продукта.
Биотехнологические процессы имеют свою специфику – в них участвуют живые клетки, субклеточные структуры или выделенные из клеток ферменты и их комплексы.
Это оказывает влияние на процессы массопередачи – обмена веществом между различными фазами (например, перенос кислорода из газовой фазы в жидкую) и теплообмена – перераспределения тепловой энергии между взаимодействующими фазами. Именно поэтому важной составной частью биореактора является система перемешивания, служащая для обеспечения однородности условий в аппарате.
Многие биотехнологические процессы являются аэробными. Для аэрации культуральной среды используют воздух или воздух, обогащенный кислородом, реже чистый кислород. В ходе метаболизма выделяются газообразные продукты (например, СО2), которые подлежат удалению. Анаэробные процессы зависят от газообразных субстратов или требуют отвода газообразных продуктов жизнедеятельности. Для этого существуют системы газоснабжения и газоотвода, примером которых служат аэраторы. Очень часто потребность в кислороде меняется по мере развития культуры. Аэратор должен вовремя реагировать на эти изменения, увеличивая или уменьшая подачу кислорода.
Теплообмен является важной составной частью процессов, протекающих в биореакторе, т.к. жизнедеятельность и метаболическая активность биообъекта в существенной мере зависят от температуры. Узкий диапазон температур, оптимальный для биотехнологического процесса, определяется:
- резким спадом активности ферментов по мере снижения температуры;
- необратимой денатурацией биологических макромолекул (белков и нуклеиновых кислот) при повышении температуры до определенного уровня.
Большинство процессов протекает при температурах 30-50°С (мезофильные условия). В этом случае для поддержания оптимума температуры специальный подогрев используют в редких случаях. Однако для удаления избыточной теплоты, выделяемой в процессе жизнедеятельности культивируемых клеток, в биореакторе должна быть система теплообмена. Эта система должна чутко реагировать на изменения теплопродукции, происходящие в ходе культивирования биообъекта, поддерживать температуру на постоянном уровне (режим термостатирования) или контролировать ее изменения по заданной программе.
Серьезной проблемой для аэрируемых биотехнологических процессов является вспенивание культуральной среды – образование на ее поверхности слоя из пузырей. Пенообразование связано с наличием в среде поверхностно-активных веществ (продукты распада жиров – мыла, белки). Пенный слой поверх среды культивирования в биореакторе имеет двоякое значение. Пена способствует росту многих аэробных микроорганизмов. В пенном слое – «кислородном коктейле» - наибольший прирост дают дрожжи. Внедряясь в границу раздела вода/воздух, пенообразующие ПАВ стимулируют массопередачу между этими фазами, снижая затраты на перемешивание и аэрацию.
Однако нежелательные последствия вызывает избыточное пенообразование. Оно ведет к сокращению полезного объема биореактора, создает угрозу заражения культуры посторонней микрофлорой. Поэтому система пеногашения – необходимая составная часть реактора.
Система стерилизации представляет собой специфический элемент биореактора. Устранение посторонней микрофлоры из реактора до введения в него штамма-продуцента, поддержание чистоты культуры на всем протяжении биотехнологического процесса, надежная стерилизация питательных сред, добавочных компонентов, титрантов, пеногасителей, подаваемого в биореактор воздуха – принцип асептики биотехнологического производства.
В последнее время в биотехнологии стали применять принцип дифференцированных режимов культивирования: разные этапы одного процесса осуществляют при различных условиях, варьируя такие параметры, как температура, рН среды и др.
Таким образом, в соответствии с основными принципами реализации биотехнологических процессов современный биореактор должен обладать следующими системами:
1) эффективного перемешивания и гомогенизации питательной среды;
2) обеспечения доступа и быстрой диффузии газообразных агентов (система аэрации среды);
3) теплообмена;
4) пеногашения;
5) стерилизации сред, аппаратуры и воздуха;
6) контроля и регулировки процесса.
Как сложные многопараметровые аппараты, биореакторы могут быть классифицированы по ряду критериев:
1) по размеру и целевому назначению:
- лабораторные;
- опытно-промышленные (пилотные);
- промышленные;
2) по режиму работы:
- периодические;
- периодический режим с доливом субстрата;
- полупериодические;
- непрервно-проточные.
3) по условиям культивирования:
- аэробные и анаэробные;
- мезофильные и термофильные;
- для поверхностного и глубинного культивирования;
- аппараты для жидких питательных сред, твердофазные и газофазные.
2.3.Методы культивирования микроорганизмов
2.3.1. Глубинный способ культивирования микроорганизмов
Глубинный метод выращивания в промышленных условиях патогенных микроорганизмов впервые был применен Н. Е. Лебедевым в 1950 году. Внедрение его в промышленное производство явилось большим достижением в микробиологии, давшим возможность получить большое количество бактериальной массы за короткое время. С применением интенсивной аэрации скорость размножения микроорганизмов бывает еще выше.
Так, на синтетических средах накопление микроорганизмов бактерий кишечной группы за 14 часов культивирования с применением принудительной аэрации составляет 25 млрд/мл, на мясных средах 50—60 млрд/мл, в то время как при культивировании этих же микробов и на тех же средах без аэрации, то есть в стационарных (состоянии покоя) условиях, количество микробов не превышает 1—2 млрд/мл. Такая большая разница в накоплении биомассы объясняется тем, что при аэрации практически отсутствует начальная стационарная фаза, фаза отрицательного ускорения размножения становится более продолжительной. В условиях аэрации бактерии сразу начинают интенсивно размножаться, переходя в фазу ускоренного размножения и логарифмическую фазу.
Для выращивания микроорганизмов в промышленных условиях в настоящее время применяют реакторы с барбатерами и металлическими мешалками для диспергирования воздуха. Размешиваний питательной среды и ее аэрацию следует рассматривать как единый процесс, так как равномерно аэрировать всю культуральную жидкость в больших емкостях, не прибегая к размешиванию, невозможно.
Значительный интерес представляет вопрос о связи между интенсивностью потребления кислорода микроорганизмами и его содержанием в среде. Известно, что кислород плохо растворяется в воде. Вода при 20° С содержит только 0,0009% кислорода, при 37° С в воде, соприкасающейся с воздухом, содержится 0,0007% кислорода. В связи с этим в питательную среду поступление кислорода должно быть очень интенсивным. Скорость поступления кислорода в любую часть культуральной жидкости должна быть не менее скорости его потребления. В противном случае произойдет местное или временное обеднение среды кислородом, что вызовет повреждение микробных клеток.
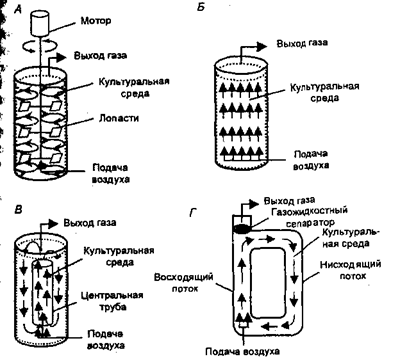 Глубинный
способ культивирования в биопромышленности является основным при производстве
большинства биопрепаратов. Он осуществляется, как правило, в реакторах
(ферментерах) большой емкости. Их подразделяют на две группы: по конструкции и
по принципу перемешивания культуральной жидкости
Глубинный
способ культивирования в биопромышленности является основным при производстве
большинства биопрепаратов. Он осуществляется, как правило, в реакторах
(ферментерах) большой емкости. Их подразделяют на две группы: по конструкции и
по принципу перемешивания культуральной жидкости
Рис. 2.3.1.Упрощенные схемы биореакторов различных типов:
А — реактор с механическим перемешиванием; Б — барботажная колонна; В — эрлифтный реактор с внутренней циркуляцией; Г — лифтный реактор с внешней циркуляцией. Стрелки указывают направление потока культуральной среды
В биореакторах, относящихся к первой группе, перемешивание клеток происходит путем аэрирования воздухом. Это барботажный тип биореактора, при котором процесс перемешивания суспензии осуществляется поднимающимися пузырьками воздуха. В случае барботажных биореакторов обычно получают хорошие ростовые характеристики для большого числа клеточных культур. Однако сложность поддержания суспензии в гомогенном состоянии при высоких концентрациях биомассы клеток сужает сферу их применения.
Несколько больших значений максимальной концентрации клеточной биомассы можно достичь при применении эрлифтных биореакторов, в которых создаются направленные циркуляционные потоки.
В эрлифтных биореакторах перемешивание суспензии осуществляется за счет применения специальной конструкции, создающей градиент плотности (как правило, это конструкция с внутренним цилиндром).
Вторая группа биореакторов представляет собой аппараты с применением механических перемешивающих устройств. Биореакторы этого типа позволяют изучать растительные клеточные популяции в очень широком диапазоне концентраций биомассы клеток. Вместе с тем стрессовое воздействие перемешивающего устройства на клеточную популяцию часто ограничивает их применение.
Технологический процесс глубинного выращивания микроорганизмов в реакторах складывается из следующих этапов:
1) подготовка реактора к посеву;
2) отбор штаммов микроорганизмов и работа с ними;
3) приготовление матровой культуры для засева питательной среды;
4) посев матровой культуры в реактор с питательной средой для получения производственной расплодки микроорганизмов;
5) выращивание микроорганизмов и контроль за ходом процесса культивирования.
При глубинном выращивании микроорганизмов их культуры могут находиться в периодических и хемостатных (непрерывных) системах.
2.3.1.1Периодическая система
Периодической системой культивирования называют систему, в которой после внесения бактерий (засева) в питательную среду не производится ни добавления, ни удаления каких-либо компонентов, кроме газовой фазы. Отсюда следует, что периодическая система может поддерживать размножение клеток в течение ограниченного времени, на протяжении которого состав питательной среды изменяется от благоприятного (оптимального) для их роста до неблагоприятного, вплоть до полного прекращения процесса размножения.
Рост в такой «закрытой системе» подчиняется определенным закономерностям. Общую закономерность роста и размножения бактериальной популяции принято показывать графически в виде кривой, отражающей зависимость логарифма числа живых клеток от времени культивирования.
Типичная кривая (рис. 2.3.2.) имеет S-обзразную форму и позволяет различать несколько фаз роста, сменяющих друг друга в определенной последовательности: начальную (или лаг-)фазу, экспоненциальную (или логарифметическую, лог-)фазу, стационарную и фазу отмирания.

Рис. 2.3.2. График фаз роста бактерий
Начальная фаза. Эта фаза охватывает промежуток времени между инокуляцией (момент посева) и достижением максимальной скорости деления микробов. Продолжительность этой фазы зависит главным образом от предшествующих условий культивирования и возраста инокулята,а так же от степени пригодности питательной среды для роста данного микроба. Если инокулят взят из старой культуры, то клеткам приходится сначала адаптироваться к новым условиям путем синтеза РНК, образования рибосом и синтеза ферментов. Если источники энергии и углерода в новой среде отличаются от таковых предшествующей культуры, приспособление к новым условиям может быть связано с синтезом новых ферментов, которые ранее не были нужны и поэтому не синтезировались. Образование новых ферментов индуцируется новым субстратом.
Экспоненциальная фаза, или фаза логарифмического роста характеризируется постоянной максимальной скоростью деления клеток.
Период генерализации (лат. Generatio – рождение, воспроизведение) – это время между двумя последовательными делениями бактерий – в этой стадии будет постоянным для данного вида, а количество бактерий будет увеличиваться в геометрической прогрессии.
Следовательно, после “n” генерации количество клеток в культуре будет равно “2n”. Длительность лог-фазы – обычно 5-6 часов.
Величина клеток и количество содержания в них белка у многих бактерий в лог-фазе то же остаются постоянными и в целом микробная популяция состоит из «стандартных клеток». Если увеличение биомассы бактерий, включая белки, РНК, липиды и другие макромолекулы, происходит пропорционально увеличение численности бактериальных клеток, то такое состояние определяют понятием «сбалансированный рост». Поэтому за ростом культуры в стадии «сбалансированного роста» лог-фазы можно следить, пользуясь каким-нибудь одним из этих показателей.
За стадией сбалансированного роста уже в лог-фазе наступает стадия отрицательного ускорения, при которой скорость размножения бактерий перестает быть максимальной. В результате число делящихся особей – уменьшается, а число погибших – увеличивается. Ее длительность около 2-х часов. Причина замедления размножения: истощение питательной среды, накопление продуктов метаболизма, увеличение плотности клеточной суспензии и мн.др.
В связи с тем, что в экспоненциальной фазе скорость деления клеток относительно постоянна, эта фаза наиболее удобна для определения скорости деления (и скорости роста).
Стационарная фаза максимума. В ней число новых живых бактерий почти равно числу отмерших (равновесие). Переход от лог-фазы к стационарной происходит постепенно. Причины замедления роста нами обозначены при описании стадии отрицательного ускорения (нехватка питательной среды, большая плотность бактериальной популяции, низкое порциальное давление О2, накопление токсических продуктов обмена). Все эти факторы вызывают переход к стационарной фазе.
Но и в стационарной фазе могут еще происходить такие процессы, как использование запасных веществ, распад части рибосом и синтез ферментов. Наблюдаемая картина зависит от того, какой именно фактор лимитирует рост.
Быстро гибнут лишь очень чувствительные клетки, другие – еще долго сохраняют жизнеспособность – до тех пор, пока еще есть возможность получать необходимую для этого энергию в процессе окисления каких-либо запасных веществ или клеточных белков. Количество биомассы, достигнутое в стационарной фазе, называют выходом или урожаем. Урожай зависит от природы и количества используемых питательных веществ, а так же от условий культивировании.
Фаза отмирания. В этой фазе можно выделить три стадии:
а) стадия ускорения, гибели, характеризующаяся превышением числа отмирающих клеток над количеством вновь образующихся (около 3 часов);
б) стадия логарифметической гибели – отмирание клеток происходит с постоянной скоростью ( 5 часов);
в) стадия уменьшения скорости отмирании, во время которой оставшиеся в живых клетки переходят в стадию покоя.
Одновременно с ростом биомассы одних клеток, происходит увеличение числа клеток в популяции за счет деления других и постоянная утилизация субстратов питательной среды. Такой рост возможен лишь в том случае, если питательная среда сбалансирована по всем компонентам, необходимым бактериальной клетке для роста и размножения.
Следовательно, нелимитированность питательной среды по какому-либо питательному компоненту – одно из основных обязательных условий максимального роста микробной популяции.
Если же питательная среда лимитирована по какому-либо питательному компоненту, то скорость роста замедляется вплоть до полной остановки роста после полной утилизации этого компонента. Иногда в комплексной питательной среде бактериальные клетки используют имеющиеся субстраты последовательно. Это происходит тогда, когда присутствие одного субстрата в среде приводит к подавлению синтеза фермента, участвующего в метаболизме других питательных веществ.
В этих условиях «подавляемые» ферменты начинают синтезироваться и осуществлять метаболизм лишь тогда, когда ингибирующий (подавляющий) их субстрат будет израсходован бактериальными клетками. Такая регуляция физиологии бактерий концентрацией питательных веществ в субстрате приводит к изменениям в скорости роста, а следовательно, и в кривой роста, на которой появляется одна или несколько переходных (т.е. временных) стационарных фаз.
Преимущества периодических систем:
— малая стоимость аппарата и системы управления;
— гибкость, т. е. возможность наработки в одном биореакторе разных продуктов;
— время культивирования можно произвольно менять;
— процесс менее подвержен инфицированию, мутациям ток вследствие отсутствия протока и притока из-за относительно малого времени ферментации;
— процесс удобен для получения малых количеств продукта;
— условия культивирования можно поддерживать в оптимуме как в фазе роста биомассы, так и в фазе биосинтеза продукта, причем оптимальные условия для биомассы и продукта могут быть различны;
— процесс удобен для реализации биосинтеза вторичных метаболитов.
Недостатки:
— необходимость приготовления посевного материала
— велико непродуктивное время ферментации;
— в связи с частой стерилизацией быстрее изнашиваются измерительные приборы, особенно датчики величины рН.
— производительность по биомассе и продукту часто ниже, чем при непрерывном процессе
2.3.1.2.Непрерывная система
Проточное (непрерывное) культивирование характеризуется постоянным добавлением в биореактор свежей питательной среды и постоянным отбором либо суспензии (открытое проточное культивирование), либо отработанной среды (закрытое проточное культивирование). В непрерывных процессах биообъект постоянно поддерживается в экспоненциальной фазе роста. Непрерывная культура представляет собой открытую систему, стремящуюся к установлению динамического равновесия.
Для микроорганизмов создаются неизменные условия среды. Проточное культивирование конструктивно более сложно и поддерживается автоматическим регулированием, так как связано с включением в схему биореактора дополнительных устройств перистальтических насосов, разделительных устройств и др.
Принцип непрерывного (проточного) культивирования микробов состоит в том, что в сосуд, где размножаются микроорганизмы, непрерывно подается свежая питательная среда и одновременно втекает такой же объем культуры. По такому принципу организуются две разновидности технического процесса непрерывного культивирования: процесс (технология) полного вытеснения и технология полного смещения.
Технология полного вытеснения
При технологии полного вытеснения сосуд для выращивания микроорганизмов (трубчатый ферментер) представляет собой трубку, расположенную горизонтально или вертикально, в которую втекают среда и посевной материал и вытекает культура. Перемешивание не производится.
 |
S0 – концентрация субстрата в поступающей питательной среде
S – концентрация субстрата в вытекающей питательной среде
Х0 – концентрация биомассы в поступающем посевном материале
Х – концентрация вытекающей биомассы
С одной стороны ферментера подаются среда и посевной материал, где микробная популяция находится в начале своего развития. По ходу трубки культура «стареет», субстрат исчерпывается, накапливаются продукты метаболизма и вытекающая культура приходит в состояние аналогичное стационарной фазе роста периодической культуры. В результате такого процесса в ферментере воспроизводится полная кривая роста, но не во времени, а в пространстве. В настоящее время появились ферментативные аппараты, обеспечивающие процессы с режимом, приближающимся к полному вытеснению и при аэробном культивировании.
Процесс полного вытеснения применяется в промышленности в тех случаях, когда желательно избежать потери времени на опорожнение, стерилизацию и заполнение емкости. Его применяют в пищевой промышленности, когда используются сложные среды и стоит задача наиболее экономично провести процесс аналогичный тому, который ведется в периодическом режиме.
Технология полного смешивания
В процессе полного смешивания рост культур происходит в емкости – ферментере при интенсивном перемешивании. Перемешивание достигается продуванием воздуха или работой мешалки (или тем и другим одновременно). Во всей массе культуры условия должны быть совершенно одинаковыми. В ферментере создаются условия соответствующие одной точки кривой роста культуры. При больших потоках среды эти условия близки к фазе логарифмического роста, при малых – приближаются к условиям стационарной фазы роста культур. При таком методе может быть воспроизведена любая точка роста периодической культуры.
В установившемся режиме скорость потока среды, отнесенная к объему культуры в ферментере, называют коэффициентом разбавления. Коэффициент разбавления равняется удельной скорости роста µ.
D
= =
µ
=
µ
где:
D – коэффициент добавления
F – скорость потока среды
V – объем культуры в ферментере
µ- удельная скорость роста
Это означает, что культура находится в устойчивом стационарном состоянии, в результате концентрация биомассы (Х) в ферментере остается постоянной. В таком случае скорость роста определяется коэффициентом разбавления. Она уравнивается с ним и концентрация субстрата (S) также остается постоянной (равномерно расходуемый субстрат обновляется с равномерной скоростью притока новой питательной среды).
При таком способе культивирования культура (вследствие возникновения феномена синхронизации роста) обладает способностью самостоятельно автоматически подстраиваться к измененным условиям процесса.
Если условия изменяются в сторону ускорения роста, то в ферментере повышается концентрация биомассы и понижается концентрация субстрата, при замедлении роста – концентрация биомассы понизится, а концентрация питающего субстрата повысится.
При кратковременном изменении условий культивирования эти состояния микробной популяции обратимы и на изменение скорости потока культура реагирует соответствующим изменением концентрации биомассы и концентрации субстрата, не выходя из стационарного состояния.
Однако, следует помнить, что чрезмерное увеличение скорости потока, причины сильно замедляющие рост, могут привести к тому, сто скорость роста (µ) окажется меньше коэффициента разбавления (F). И в таком случае культура вымоется из ферментера.
Воспроизведение в потоке определенной точки кривой роста культур широко применяется в промышленности при наращивании биомассы микроорганизмов. Хорошо отработанный периодический процесс выращивания экономически выгодно воспроизводить в проточном варианте, поскольку культура непрерывно находится в состоянии максимальной активности нужного процесса, не тратится время на освобождение емкостей и лаг-фазу.
При наращивании биомассы в проточных условиях биотехнологический процесс стремятся вести при возможно большей скорости потока, но не настолько большой, чтобы в среде оставался недоиспользованный субстрат. Таким образом получают наибольший экономический коэффициент, который при непрерывном культивировании определяют следующим образом:
D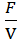 =
=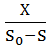
где:
S0 – концентрация питательного вещества в поступающей среде
S – концентрация питательного вещества в культуре, вытекающей из ферментера
Х – концентрация биомассы в вытекающей культуре
В практике микробиологических исследований широко применяют две разновидности открытого проточного культивирования: хемостатный и турбидостатный методы.
2.3.1.2.1. Хемостатный метод
Хемостатный метод культивирования клеток базируется на использовании биореактора, в который с постоянной скоростью подается питательная среда и одновременно же скоростью (например, слив по уровню) отбирается клеточная суспензия. При этом объем выращиваемой суспензии остается постоянным.
Хемостат состоит из сосуда-культиватора, в который из особого резервуара поступает постоянной скоростью питательный раствор. При этом один из компонентов (обычно кислород) поступает в количестве, не достаточном для обеспечения максимальной скорости роста культуры (рис. 49). В результате реактор с биообъектом приобретает свойства саморегулирующейся системы. Например, если скорость разбавления и вымывания биомассы превышает скорость роста клеток, то наступает разбавление культуры свежей средой. Это ведет к повышению концентрации компонента, ограничивающего рост, вследствие чего скорость роста культуры увеличивается. В реакторе начинает концентрироваться биомасса. Увеличивающаяся популяция клеток активно использует субстрат, его концентрация падает, что ведет к торможению роста культуры.
Устройство хемостата:
1) устройство для вливания питательной среды;
2) выпускное приспособление для оттока культуральной жидкости с клетками;
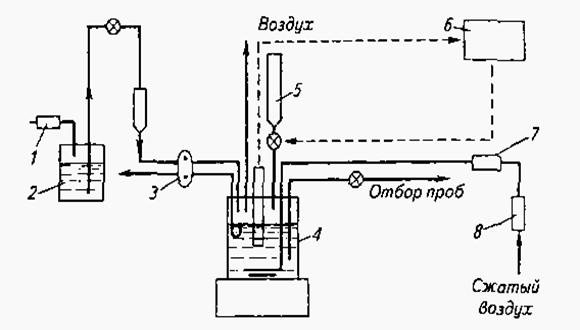 3)
система контроля скорости притока.
3)
система контроля скорости притока.
Рис. 2.3.3. Схема лабораторной установки для хемостатной ферментации
1- воздушный фильтр; 2 – емкость для стерильной среды; 3 – питающий и отводящий насосы; 4 – ферментатор; 5 – емкость для кислоты; 6 – пульт контроля и регулирования рН среды; 7 – воздушный фильтр; 8 - ротаметр
Самый простой вариант хемостата включает насос, постоянно нагнетающий питательную среду в биореактор, и выпускную трубу, по которой жидкость из биореактора вытекает, как только ее уровень поднимается выше горловины этой трубы.
Хемостатное культивирование основано на том, что в простейшей форме рост бактерий можно предоставить как совокупность реакций, в которых скорость роста культуры определяется самой медленной реакцией метаболизма. Хотя в растущей культуре осуществляется метаболизм многих питательных веществ, скорость роста культуры в любой момент времени определяется скоростью метаболизма лишь одного питательного субстрата. Тот субстрат, или тот компонент питательной среды, метаболизм которого осуществляется медленнее всего и который таким образом определяет скорость роста бактериальной культуры, принято называть лимитирующим фактором.
Каким же образом скорость роста культуры зависит от концентрации лимитирующего субстрата? Эту зависимость установил Моно и выразил её следующей формулой:
Уравнение Моно
µ
=µмах*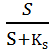
где:
µ - удельная скорость роста
µмах – максимально возможная скорость роста в данной среде
S – концентрация лимитирующего субстрата в среде
Ks
– константа Моно или константа насыщения. Она численно равна концентрации
лимитирующего субстрата, замедляющей вдвое µмах (т.е. = S
при µ= µмах)
µмах)
Совершенно очевидно, что концентрация лимитирующего фактора или субстрата в среде ограничивает и концентрацию вырастающей биомассы. В случае полного использования лимитирующего фактора рост и размножение бактериальных клеток прекращается. Концентрация биомассы в ферменте в стационарном состоянии культуры определяется по формуле:
Х
=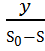
где:
y – экономический коэффициент, или доля потребленного субстрата, пошедшего на синтез биомассы
S0 – концентрация субстрата в поступающей среде
S – концентрация субстрата в ферментере
Концентрацию субстрата в ферментере в стационарном состоянии культуры определяют по формуле:
S
=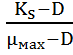
где:
Ks – константа Моно
D – коэффициент разбавления или скорость разбавления
S – концентрация субстрата в ферментере
µмах – максимально возможная скорость роста
Скорость разбавления, или коэффициент разбавления (D) при хемостатном культивировании известен. Он равен:
D=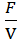
где:
F – скорость потока
V – объем культуры
Величина обратная скорости разбавления характеризует время полной замены имеющейся в ферменте среды новой или, что одно и то же, время пребывания в ферментере каждого компонента питательной среды:
t=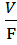
Таким образом, следует рассматривать количественные зависимости, существующие между:
- концентрацией биомассы – Х,
- концентрацией лимитирующего субстрата – S
- скоростью роста - µ
Графически эта зависимость характеризуется хемостатной кривой, которая выглядит следующим образом:
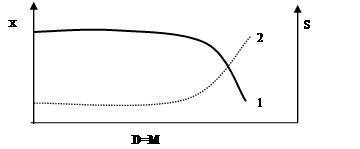
Рис. 2.3.4. График зависимости скорости роста культуры зависит от концентрации лимитирующего субстрата
1.Концентрация биомассы
2.Концентрация субстрата
На приведенной кривой видно, что при увеличении скорости разбавления снижается концентрация биомассы и увеличивается концентрация субстрата. Причем, если вести дельнейшее увеличение скорости разбавления, то концентрация (Х) стремится к 0, т.е. при некотором значении (D) биомасса полностью вымывается из фермента. Эту скорость разбавления назначают критической (Dкр.) или скоростью вымывания клеток. Теоретически Dкр= µмах
Но поскольку концентрация лимитирующего субстрата в аппарате (S) не может быть больше концентрации его в поступающей среде (S0), то:
Dкр=
µмах*
Производительность фермента по выходу (урожаю) биомассы рассчитывают следующим образом:
R=DX
Зная основные константы Ks, µмах и y можно легко рассчитать параметры культуры (Х) и для любого значения при µ=D
Хемостатный метод культивирования незаменим в лабораторных исследованиях физиологии микроорганизмов и клеток тканей. В промышленности он применяется при наращивании микробной биомассы, если известно, какой именно фактор ограничивает рост.
2.3.1.2.2. Турбидостатный метод
Турбидостатный метод предусматривает измерение концентрации клеточной биомассы в биореакторе и ее автоматическое поддержание на постоянном уровне путем изменения скорости протока.
Турбидостат представляет собой самую простую из всех хорошо перемешиваемых систем непрерывного перемешиваемых систем непрерывного культивирования. Концентрация клеток при турбидостатном культивировании регулируется постоянной подстройкой скорости поступления питательных компонентов. Принцип работы турбидостата основан на прямом контроле концентрации биомассы. Метод осуществляется с помощью фотоэлемента и основан на измерении светорассеяния содержимого биореактора. Сигнал от фотоэлемента управляет скоростью протока жидкости, в свою очередь определяющего скорость роста культуры. Повышение концентрации клеток и соответственно светорассеяния автоматически приводят к ускорению протока жидкости, разбавляющей культуру, и, наоборот, убыль биомассы компенсируется замедлением протока.
По своей конструкции турбидостат отличается от хемостата лишь системой контроля скорости протока. Хемостатный режим используется при малом протоке, когда концентрация клеток меняется незначительно с изменением его скорости. Это облегчает саморегулировку системы. При турбидостатном режиме происходит быстрое и резкое изменение концентрации биомассы в ответ на смену скорости протока.
Это обеспечивает своевременное срабатывание фотоэлемента или другого датчика, управляющего скоростью протока жидкости через турбидостат (рис.50).
|
|
Рис. 2.3.4. Схема лабораторной установки турбидостата: 1 – фильтр; 2 – насос для подачи среды; 3 – пульт управления насосом; 4 – фотоприемник света; 5 – источник света; 6 – ферментатор |
При длительном культивировании биообъекта в турбидостате возможно прилипание клеток к фотоэлементу. При засеве смешанной культуры в нем автоматически отбирается наиболее быстрорастущий вид. В определенной степени это предохраняет культуру микроорганизма от заражения посторонней микрофлорой.
В отличии от хемостата концентрацию биомассы в турбидостате выбирает оператор, а скорость разбавления и соответственно концентрация субстратов поддерживается таким образом, чтобы сохранялся заданный уровень биомассы.
Турбидостатное культивирование осуществляют обычно в тех случаях, когда лимитирующий фактор не известен или в лимитирующих количествах субстрата нет необходимости. Поэтому субстрат добавляется в ферментер в избытке. Избыток концентрации всех компонентов питательной среды делает работу турбидостата стабильной даже при удельной скорости роста культуры близкой к максимальной (µмах).
Турбидостат позволяет регулировать систему в широких инервалах концентраций биомассы при скорости разбавления близкой к критической (Dкр). Именно в этих условиях химостат менее стабилен.
Скорость разбавления в турбидостате всегда равна удельной скорости роста:
D=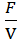 =
µ
=
µ
при условии Х=constanta
В свою очередь, постоянство концентрации микробной биомассы удерживают регуляцией скорости потока, которую осуществляет не оператор, а автоматическая система.
В большинстве случаев с этой целью прибегают к прямому оптическому измерению мутности биомассы, котороя зависит от концентрации клеток (Х).
Для этого ферментер оборудуют фотоэлектроколлориметром или аналогичным ему устройством, работающем по принципу светорассеявания. Если концентрация клеток остается на нужном уровне питательная среда подается с заданной скоростью, а при снижении концентрации клеток подача питательной среды прекращается. Именно этот принцип работы турбидостата обеспечивает его устойчивую работу даже при коэффициенте разбавления близком к критическому – на границе вымывания клеток.
Сигналом для подачи среды может быть не только оптическая плотность (мутность), но и любой параметр среды, поддающийся измерению электродом или другим устройством, переводящим величину измерительного параметра в величину электрического потенциала. Последний усиливается и приводит в действие работу насоса, подающего раствор или питательную среду.
Поскольку основные метаболические функции (поглощение бактериями кислорода, выделение CO2, изменение рН), тесно связанны со скоростью роста клеток и в конечном счете с удельной скоростью роста культуры, именно эти показатели чаще других используют как измеряемые переменные при регулировке потока среды.
Непрерывное культивирование может быть:
- одностадийным (осуществляется в одном биореакторе);
- многостадийным (осуществляется в последовательно или каскадно расположенных биореакторах).
Многостадийное культивирование дает возможность внедрить принцип дифференцированных режимов, которые одновременно осуществляются в последовательно расположенных аппаратах. Например, в первом из биореакторов создают оптимальные условия для роста культуры, а во втором – для биосинтеза целевого продукта.
2.3.2. Поверхностный метод культивирование микроорганизмов
Микроорганизмы поистине являются вездесущими, и они по своей способности заселять объекты внешней среды считаются в экологическом отношении самыми распространенными организмами. На поверхностях различных материалов они образуют скопления, именуемые колониями. Способ выращивания микроорганизмов на поверхности плотных питательных сред называется поверхностным культивированием. Выращивание микробов на плотных питательных средах в бактериологических лабораториях различного направления является одним из основных методов изучения свойств микроорганизмов.
Дело в том, что на плотных питательных средах различные микроорганизмы образуют различные по величине, форме и другим признакам колонии. Колонии представляют собой скопления особей одного вида микроорганизмов, образующихся в результате размножения из одной или нескольких клеток. Колонии бывают плоскими, выпуклыми, куполообразными, вдавленными. Поверхность их бывает гладкой (S-форма, от английского слова smooth — гладкий), шероховатой (R-формой, от английского слова rough — шероховатый). Между S- и R-формами колоний имеются и переходные: О- и М-формы (промежуточные и слизистые). Края колоний могут быть ровными, зазубренными, волокнистыми, бахромчатыми. По величине колонии подразделяются на крупные(4—5 мм в диаметре), средние (2—4 мм), мелкие (1—2 мм) и карликовые (меньше 1 мм). Колонии отличаются и по консистенции, плотности, окраске. Они бывают прозрачными и непрозрачными, окрашенными и бесцветными, влажными, сухими и слизистыми.
Следует иметь в виду, что особенности строения колоний для каждого вида микроба являются специфическими, что позволяет дифференцировать различные микробы по характеру роста их на плотных питательных средах. В качестве таковых сред чаще бывают агаровые. Кроме того, в пределах одного вида могут быть варианты микроорганизма с измененной формой колоний. Этот феномен получил название диссоциации. Она относится к проявлениям фенотипической изменчивости у микроорганизмов.
Следовательно, механизм и характер роста колоний для каждого микроорганизма имеют фундаментальное значение.
Теории и механизмы размножения микроорганизмов на поверхности каких-либо питательных сред менее изучены, чем при выращивании микробов глубинным способом.
Начало роста и размножения микроорганизмов в колониях на плотных питательных средах очевидно связано с анатомическими особенностями микробных клеток. Установлено, что у большинства микроорганизмов на поверхности клеточной оболочки имеются специальные отростки — фимбрии, с помощью которых микроорганизмы прилипают к поверхности объекта, в том числе и к поверхности плотной питательной среды. Прикрепившись к поверхности питательной среды, микробные клетки начинают размножаться. При этом скорость размножения микробов на поверхности питательной среды почти такая же, как и в жидких средах. Фазы роста и размножения микроорганизмов при поверхностном культивировании подчиняются тем же закономерностям, что и при глубинном культивировании. Что же касается механизма и скорости роста самих колоний микроорганизмов, то здесь имеются и неразрешенные вопросы. Однако считают (Pirt S. Y., 1967), что вначале, когда внесено небольшое количество клеток микроорганизма в качестве посевного материала для образования колоний на агаровой питательной среде, размножение протекает так, что почти все клетки в одинаковой степени участвуют в увеличении популяции. Соответственно рост всей популяции идет с максимальной экспоненциальной скоростью до тех пор, пока концентрация питательных веществ среды остается значительно выше константы насыщения и пока сама среда не ингибирует роста колоний. Потребление колонией питательных веществ создает в агаре градиент концентрации. В чашках Петри или другой емкости глубина концентрационного градиента питательной среды ограничена глубиной агара. В таком случае рост колоний по направлению вверх быстро падает почти до нуля из-за противодействия диффузии питательных веществ. В конечном итоге рост колоний идет по периферической зоне радиально в сторону края колонии.
В центре колонии скорость роста лимитирована диффузией субстрата настолько, что она практически равна нулю.
Метод поверхностного культивирования микроорганизмов широко используются в лабораториях и биологической промышленности для следующих целей:
— выделение чистых культур из объектов внешней среды;
— определение контаминации производственных штаммов микроорганизмов, из которых готовят биопрепараты;
— приготовление в лабораторных и промышленных условиях некоторых вакцин и большинства антигенов.
Культивирование хлебопекарных дрожжей
Дрожжевое производство основано на способности дрожжевых клеток (микроорганизмов) расти и размножаться. В основе технологии хлебопекарных дрожжей на дрожжевых заводах лежат биохимические процессы, связанные с превращением питательных веществ культуральной среды при активной аэрации в клеточное вещество дрожжей. При аэрации дрожжи окисляют сахарпитательной среды до воды и диоксида углерода (аэробное дыхание). Выделившаяся при этом тепловая энергия используется дрожжами для синтеза клеточного вещества и обменных процессов. В аэробных условиях в субстрате накапливаются значительно большие биомассы, чем при анаэробном дыхании.
Состав и концентрация питательной среды для культивирования дрожжей обуславливает скорость их размножения и конечный выход продуктов. Для конструктивного и энергетического обмена дрожжей используют сахара, азотистые соединения, зольные элементы и кислород воздуха.
Хлебопекарные дрожжи культивируют на мелассных средах, разбавленных водой. Сахар такой среды легко усваивается дрожжами. Теоретический выход биомассы дрожжей с 75%-ным влагосодержанием находится в пределах 97... 117 % по отношению к массе мелассы, содержащей 46 % сахара. В заводских условиях выход дрожжей составляет лишь 68...92 %.
Дрожжи используют в хлебопечении в качестве возбудителя спиртового брожения и разрыхлителей теста. Их применяют также для получения кваса, витаминов, лекарственных препаратов и питательных сред. На дрожжевых заводах вырабатывают прессованные и сушеные дрожжи, а также дрожжевое молоко. На мелассно-спиртовых заводах получают только прессованные дрожжи. Жидкие дрожжи и хлебные закваски готовят непосредственно на хлебозаводах.
На мелассно-спиртовых заводах вырабатывают 15 % хлебопекарных дрожжей от общего их выпуска. Эти дрожжи получают в качестве отходов производства при сепарации зрелой спиртовой бражки, в 1 м3 которой содержится 18...35 кг дрожжей. Выход прессованных дрожжей составляет до 3,5 кг на 1 дал спирта. Себестоимость хлебопекарных дрожжей, получаемых на спиртовых заводах, на 30 % ниже, чем на дрожжевых.
Стадии технологического процесса. Процесс получения хлебопекарных дрожжей на дрожжевых заводах складывается из следующих стадий:
— приготовление питательной среды;
— выращивание маточных и товарных дрожжей;
— выделение товарных дрожжей из дрожжевой суспензии;
— формование и упаковка прессованных дрожжей;
— сушка дрожжей.
Получение дрожжей из спиртовой бражки на спиртовых заводах состоит из стадий:
— выделение дрожжей из зрелой бражки сепарированием;
— промывание и концентрирование дрожжевой суспензии;
— дозревание дрожжей;
— окончательное промывание и концентрирование дрожжей;
— прессование, формование и упаковка дрожжей;
— хранение.
Характеристика комплексов оборудования. Линия начинается с комплекса оборудования для обработки сырья, состоящего из аппаратов для приготовления питательных сред, сепараторов-кларификаторов для мелассы и пароконтактных установок для стерилизации.
Ведущий комплекс линии представляют дрожжерастильные аппараты, снабженные аэрационной системой для насыщения суспензии кислородом, и воздуходувные машины.
Следующий комплекс линии состоит из аппаратов для выделения дрожжей, в составе которого имеются дрожжевыесепараторы, фильтр-прессы и барабанные вакуум-фильтры.
Наиболее энергоемким комплексом оборудования линии являются сушильные установки, представленные конвейерными ленточными сушилками, установками с виброкипящим слоем, а также вакуумными и сублимационными сушилками.
Завершающий комплекс оборудования линии состоит из машин для формования и завертывания брикетов дрожжей.
 На рис. представлена машинно-аппаратурная схема линии производства хлебопекарных
дрожжей.
На рис. представлена машинно-аппаратурная схема линии производства хлебопекарных
дрожжей.
Рис. 2.3.5. Машинно-аппаратурная схема линии производства хлебопекарных дрожжей
Устройство и принцип действия линии. Из сборника 1 меласса насосом 2 направляется в рассиропник 3, в котором она разбавляется горячей водой (90 °С), выдерживается 30 мин и подается на кларификатор 5, где освобождается от механических примесей.
Осветленное сусло нагревают до 120 °С в пластинчатом теплообменнике 4, выдерживают 30 с, охлаждают до 80 °С и направляют в приточный сборник 6, откуда подают в дрожжерастильные аппараты (8 — предварительный дрожжерастильный аппарат; 9, 10, 11 —дрожжерастильные аппараты соответственно I, II и II стадии маточных дрожжей). Осветление и стерилизация осуществляются в непрерывном режиме.
Минеральные соли (диамонийфосфат, сульфат магния, дестиобиотин и др.) растворяют в бачке 7 и направляют в аппараты для размножения дрожжей 8п21 в строго определенных количествах.
Выращивание хлебопекарных дрожжей складывается из получения маточных и товарных дрожжей. Маточные дрожжи чистой культуры готовят в количестве, обеспечивающем засев непосредственно в товарный аппарат 21, и хранят в виде дрожжевого молока при температуре 2 °С. Перед засевом в товарный аппарат 21 маточные дрожжи подвергают жесткой обработке при рН 1,8...2,0 в течение 30 мин. Товарные дрожжи получают по периодической схеме без отборов среды.
Различия в технологии прессованных и сушеных дрожжей проявляются начиная с выделения и подготовки штамма и до получения товарной продукции. Они состоят в удельной скорости роста, засевов, длительности выращивания и концентрации сред.
Выросшие маточные и товарные дрожжи выделяют из дрожжевой суспензии, промывают холодной водой и сгущают в сепараторах 12, 14, 16 соответственно I, II, III ступени маточных и товарных дрожжей. Дрожжевое молоко после III ступени сепарации маточных и товарных дрожжей собирается в сборник 17, откуда направляется соответственно в сборники 18 и 22 — маточного и товарного дрожжевого молока. Для промывания дрожжей используют специальные промывные бачки 13 и 15. Кислотную обработку маточных дрожжей перед засевом проводят в сборнике 19, куда из мерника 20 дозируется серная кислота.
Окончательное выделение товарных дрожжей
из дрожжевого молока происходит в вакуум-фильтре 24, предварительно
обработанном раствором поваренной соли из сборника 23. Пластины дрожжей из
вакуум-фильтра 24 попадают в сушилку для дрожжей 26 через шнек 25, при этом
пылевидная фракция улавливается в циклоне 27. Прессованные дрожжи формуются в
брикеты и упаковываются.














 (zip - application/zip)
(zip - application/zip)










