СОДЕРЖАНИЕ
ВВЕДЕНИЕ
1. ЛИТЕРАТУРНЫЙ ОБЗОР……………………………………………………
1. 1. ФОРМЫ И РАЗМЕРЫ БАКТЕРИАЛЬНЫХ ОРГАНИЗМОВ И ИХ КРАТКАЯ ХАРАКТЕРИСТИКА……………………………………………….
1.2. СТРОЕНИЕ БАКТЕРИАЛЬНОЙ КЛЕТКИ……………………………….
1.3. ЦИТОПЛАЗМАТИЧЕСКАЯ МЕМБРАНА……………………………….
2.
ДВИЖЕНИЕ И РАЗМНОЖЕНИЕ БАКТЕРИЙ…………………………….
2.1 СПОРООБРАЗОВАНИЕ И ЕГО БИОЛОГИЧЕСКАЯ РОЛЬ…………….
2.2 РАЗМНОЖЕНИЕ БАКТЕРИЙ…………………………………………….
2.2.1 ПРОЦЕССЫ ТРАНСДУКЦИИ И ТРАНСФОРМАЦИИ……………….
3. АНАТОМИЯ БАКТЕРИАЛЬНОЙ КЛЕТКИ. ФИЗИОЛОГИЯ И ГЕНЕТИКА……………………………………………………………………….
3.1 ФИЗИОЛОГИЯ БАКТЕРИЙ………………………………………………..
3.2 ВЫДЕЛЕНИЕ ВЕЩЕСТВ ИЗ БАКТЕРИАЛЬНОЙ КЛЕТКИ……………..
3.2.1 ФЕРМЕНТы В ЖИЗНЕДЕЯТЕЛЬНОСТИ БАКТЕРИЙ………………….
4. ГЕНЕТИКА БАКТЕРИЙ……………………………………………………….
4.1 МИГРИРУЮЩИЕ ГЕНЕТИЧЕСКИЕ ЭЛЕМЕНТЫ……………………….
4.2. ТИПЫ МУТАЦИЙ…………………………………………………………..
ВЫВОДЫ
СПИСОК ИСПОЛЬЗОВАННОЙ ЛИТЕРАТУРЫ
ВВЕДЕНИЕ
Изучение морфолого-анатомических признаков бактерий помогает установить систематическое положение той или иной группы бактерий и, в конечном итоге определить их практическую значимость.
Небольшие размеры бактерий долгое время казались несовместимыми с какой-либо клеточной дифференцировкой. Использование новейших методов исследования позволило выделить клеточные структуры изучить их физиологические функции. Большую роль в изучении бактерий сыграли косвенные методы, основанные на способности клетки реагировать на иммунные антитела. Оказалось, что реагируют в клетке белки с определенной формой и расположением полипептидной цепи. Это позволило изучить то, что лежит за пределами видимости микроскопа.
Исследования показали, что тело микробной клетки морфологически дифференцировано. Снаружи оно покрыто оболочкой или правильнее сказать клеточной стенкой, которая предохраняет клетку, придает ей определенную форму, является барьером для белков и полисахаридов, обладает определенной биохимической активностью. Пример: в оболочке клеток туберкулеза обнаружен фактор, тормозящий продвижение лейкоцитов к очагу и придает упругость клетке, но допускает свободное движение связанное с изгибами тела.
Один из основных признаков прокариотической клетки — отсутствие
внутреннего разделения, обеспечиваемого элементарны-ми мембранами. По сути,
единственная мембранная система прокариотической клетки — ЦПМ, входящая в
состав клеточной оболочки, часто сложно устроенная и проникающая поперечными
складками глубоко в цитоплазму. В составе любой стабильной бактериальной клетки
выделяют условные компартменты — поверхностные структуры, клеточную оболочку и
цитоплазму.
Поверхностные структуры
Основные поверхностные структуры бактериальной клетки — капсула, жгутики и
микроворсинки. Их наличие — относительно стабильный признак, используемый для
идентификации бактерий.
ЛИТЕРАТУРНЫЙ ОБЗОР
1.1 Формы и размеры бактериальных организмов и их краткая характеристика
По форме клеток бактерии разделяются: на шаровидные - кокки, палочковидные или цилиндрические - собственно бактерии и извитые - вибрионы спириллы и спирохеты. Между этими группами имеются переходные формы, например, кокко-бактерии.
Кроме этих основных групп в природе встречаются и другие формы бактерий: нитевидные, микобактерии (палочковидная ветвящаяся форма).
Кокки: по сочетанию друг с другом разделяются на несколько подгрупп: 1. Если клетки располагаются по одиночке - микрококки (micrococcus).
2. Делясь в одной плоскости бактерии могут оставаться соединенными по две диплококки (diplococcus) или образовывать цепочки стрептококки (streptococcus).
3. Иногда деление происходит в двух взаимоперпендикулярных плоскостях, образуется четверка кокков - тетракокки (tetracoccus).
4. При делении бактериальной клетки в трех плоскостях образуются скопления из 8, 16 клеток сарцины (sarcina).
5. У отдельных видов деление происходит беспорядочно и образуются скопления, напоминающие грозди винограда -стафилококки (staphilococcus). Размеры кокков варьируют от 0,5 до 2 микрон.
Кокки, как правило, не подвижны и не образуют спор, за исключением мочевой сарцины. Многие из них являются возбудителями заболеваний -пневмококки - диплококки с вытянутыми в виде свечи клетками,
менингококки - диплококки имеющие форму кофейных зерен, гонококки - возбудители гонореи.
Большая группа представлена палочковидными формами, имеющими цилиндрическую форму тела. Такие бактерии различаются по диаметру, форме концов клеток, взаимному расположению клеток, расположению спор.
Концы бактерий могут быть округлые и срезанные, прямые и выпуклые. Палочки могут быть короткие и длинные, толстые и тонкие. Размеры могут колебаться от нескольких долей микрона: до 10-30 микрон и более. Толщина от 0,5 мк - 2 мк. Представители: кишечная палочка - возбудитель дизентерии от 0,5 - 1 мк в толщину и до 3 мк в длину; возбудитель коклюша; сибиреязвенная палочка.
Все палочковидные бактерии по способности образовывать споры делят на спорообразующие - бациллы (Bacillus) и не образующие спор - собственно бактерии (Bacterium). Для краткости их обозначают - Bact, Вас.
Спора находится внутри клетки и способна менять форму палочки. Поэтому по расположению спор различают собственно бациллы - спора не превышает по диаметру диаметр бактериального организма и расположена в центре и собственно бациллы - диаметр споры которых превышает диаметр палочки и придает ей форму веретена (клостридиальная форма, спора расположена в центре клетки) или форму барабанной палочки (плектридиальная форма, спора смещена к концу клетки).
50% палочковых форм подвижны.
Иногда палочки объединяются по две - диплобактерии, диплобациллы или по нескольку - стрептобактерии, стрептобациллы. Мелкие палочки порой напоминают вытянутые кокки и называются коккобактериями.
Среди палочковидных бактерий много полезных форм: нитрификаторы - бактерии, усваивающие азот из воздуха, но ест и болезнетворные -возбудитель столбняка, гангрены, сибирской язвы, бруцеллеза.
Палочковидные формы занимают господствующее положение среди других форм, т.к. отношений площади тела к объему у них значительно большая величина по сравнению с шаром. Это облегчает питательный обмен.
Третья группа представлена извитыми формами. Здесь отличия наблюдаются не только по размерам, но и по числу и характеру завитков. К извитым относят три типа клеток: вибрионы, спириллы и спирохеты. Если завидок представляет собой одну четвертую оборота спирали это вибрионы (Vibrio) когда завитоков от 1 до 5 - спириллы (Spirillum), длинные и тонкие извитые формы с большим количеством мелких завитков - спирохеты (Spirochetes). Размеры извитых форм могут быть различными. Среди извитых форм много патогенных бактерий: возбудители сифилиса, холеры, зубная спирохета. Извитые формы занимают промежуточное положение между бактериями и протозоа.
У некоторых бактерий палочки имеют боковые выросты, такие формы объединены в группу микобактерий. Микобактерии морфологически сходны с палочковидными бактериями. Имеют сложный цикл развития. Размножение путем перетяжек или образования перегородок. Кроме того, способны образовать почки, которые отделяются и превращаются в палочки. Эта форма бактерий широко распространена в природе: в почве, воде, органических остатках. Есть патогенные виды: туберкулезная палочка и палочка проказы.
Близки к ним корнебактерии, они имеют вздутия на концах или клинообразные заострения - возбудитель дифтерии.
У отдельных видов палочковидные бактерии соединяются в цепочку и покрываются общим слизистым чехлом, образуя нитчатые формы. Это водные бактерии, они прикрепляются к субстрату или плавают в воде. Железобактерии, серобактерии принимают участие в превращениях серы и железа.
Интересными в морфологическом отношении являются стебельковые бактерии, имеющие длинные отростки, являющиеся продолжением слегка искривленной палочки (это характерно для рода Coukobacter). Скопления таких клеток образуют розетку. Эти бактерии сапрофиты распространены в проточной воде, и почве.
Наиболее высокоорганизованными бактериями являются слизистые бактерии или миксобактерии. Клетки имеют обособленное ядро, форма их может быть шарообразной или палочковидной. Характерной особенностью является способность образовывать плодовые тела, состоящие из выделяемой слизи и бактерий. По этим телам их классифицируют. Представитель - нитробактер, который разлагает органические вещества. Передвигается реактивным способом.
Среди микроорганизмов имеются формы не имеющие клеточной оболочки - микоплазмы. Один вид вызывает ОРЗ. Они имеют сферическую или овальную форму, иногда образуют тонкие нити или звездочки. Типичными представителями являются возбудители плевропневмании крупного рогатого скота. Поэтому все микоплазмоподобные организмы часто называют РLO (Plevropneumonialike organismus). Микоплазмы занимают промежуточное положение между бактериями и вирусами. Проходят через бактериальные фильтры, но могут расти на питательных средах Большинство микоплазм - хемоорганотрофы.
Большинство микоплазм растет лишь на сложных питательных средах, содержащих сыворотку крови животных. Для их роста необходимы белки и стероиды. Среди микоплазм встречаются не только возбудители болезней животных, но и сапрофитные виды, обитающие на слизистых оболочках полости рта и половых путей у человека (уреоплазма) и животных. Доказано, что среди них имеются и возбудители болезней растений. Ученые предполагают, что микоплазмы представляют собой природные стабильные L -формы.
К микоплазмам близки L - формы бактерий, которые получаются после действия на бактериальный организм пенициллином, разрушающим оболочку. Некоторые авторы считают, что микоплазмы - это L - формы бактерий.
Риккетсии: промежуточное положение между бактериями и фильтрующимися вирусами. Кокковидные, палочковидные и нитчатые формы, по форме меньше бактерий. Они строгие паразиты, живущие и размножающиеся только в протоплазме клеток, Некоторые относят их к вирусам, однако они имеют выраженный обмен веществ. Паразитируют в насекомых. Клещевой сыпной тиф, ку - лихородка.
1.2. Строение бактериальной клетки
Бактерии являются прокариотами (рис. 1.1) и существенно отличаются от клеток растений и животных (эукариотов). Они относятся к одноклеточным организмам и состоят из клеточной стенки, цитоплазматической мембраны, цитоплазмы, нуклеоида (обязательных компонентов бактериальной клетки). Некоторые бактерии могут иметь жгутики, капсулы, споры (необязательные компоненты бактериальной клетки).
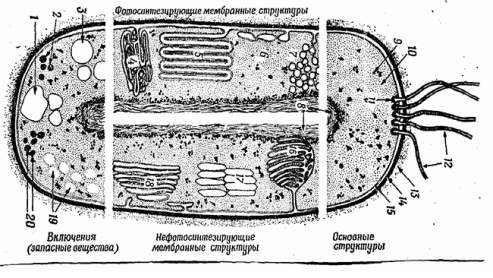
Рис. 1.1Комбинированное схематическое изображение прокариотической (бактериальной) клетки со жгутиками.
1 - гранулы полиоксимасляной кислоты; 2
- жировые капельки; 3 - включения серы; 4 - трубчатые тилакоиды; 5 -
пластинчатые тилакоиды; 6 - пузырьки; 7 - хроматофоры; 8 - ядро (нуклеоид); 9 -
рибосомы; 10 - цитоплазма; 11 - базальное тельце; 12 - жгутики; 13 - капсула;
14 - клеточная стенка; 15 - цитоплазматическая мембрана; 16 - мезосома; 17 -
газовые вакуоли; 18 - ламеллярные структуры; 19 -гранулы полисахарида; 20 -
гранулы полифосфата
Клеточная стенка
Клеточная стенка представляет собой внешнюю структуру бактерий
толщиной 30-35 нм, главным компонентом которой является пептидогликан (муреин).
Пептидогликан является структурным полимером, состоящим из чередующихся
субъединиц N-ацетилглюкозамина и N-ацетилмурамовой кислоты, соединенных
гликозидными связями (рис. 1.2).
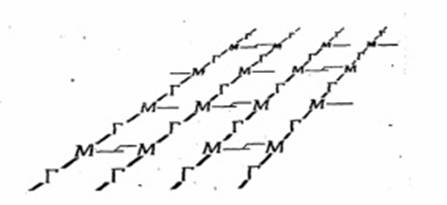
Рис.1.2 Схематическое изображение однослойной структуры пептидогликана
Параллельно расположенные полисахаридные (гликановые) цепи скреплены между собой поперечными пептидными мостиками (рис. 1.3).
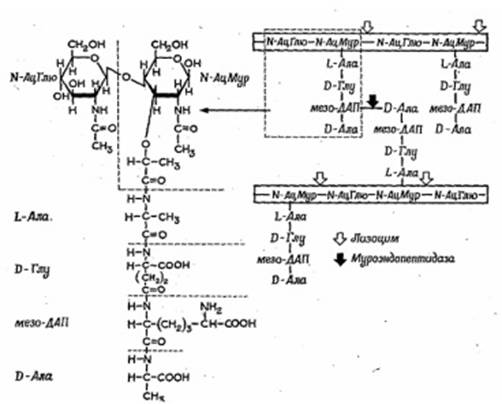
Рис. 1.3 Детальное строение структуры пептидогликана Светлые и черные короткие стрелки указывают связи, расщепляемые соответственно лизоцимом (мурамидазой) и специфической муроэндопептидазой
Полисахаридный каркас легко разрушается лизоцимом - антибиотиком животного происхождения. Пептидные связи являются мишенью для пенициллина, который ингибирует их синтез и препятствует формированию клеточной стенки. Количественное содержание пептидогликана влияет на способность бактерий окрашиваться по Граму. Бактерии, имеющие значительную толщину муреинового слоя (90-95%), стойко окрашиваются генцианвиолетом в сине-фиолетовый цвет и носят название грамположительных бактерий. Грамотрицательные бактерии с тонким слоем пептидогликана (5-10%) в клеточной стенке после действия спирта утрачивают генцианвиолет и дополнительно окрашиваются фуксином в розовый цвет. Клеточные стенки у грамположительных и грамотрицательных прокариот резко различаются как по химическому составу (табл. 1.1), так и по ультраструктуре (рис. 1.4).
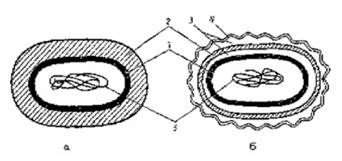
Рис. 1.4 Схематическое изображение клеточной стенки у грамположительных (а) и грамотрицательных (б) прокариот: 1 - цитоплазматическая мембрана; 2 - пептидогликан; 3 - периплазматическое пространство; 4 - наружная мембрана; 5 - ДНК
Кроме пептидогликана, в клеточной стенке грамположительных бактерий содержатся
тейхоевые кислоты (полифосфатные соединения), в меньшем количестве - липиды,
полисахариды, белки.
Таблица 1.1. Химический состав клеточных
стенок грамположительных и грамотрицательных прокариот
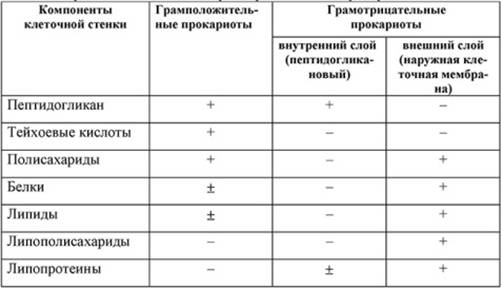
Грамотрицательные прокариоты имеют наружную мембрану, в состав
которой входят липиды (22 %), белки, полисахариды, липопротеины. Клеточная
стенка у бактерий выполняет в основном формообразующую и защитную функции,
обеспечивает ригидность, формирует капсулу, определяет способность клеток к
адсорбции фагов.
1.3. Цитоплазматическая мембрана
Цитоплазма бактериальной клетки ограничена от клеточной стенки тонкой
полупроницаемой структурой толщиной 5-10 нм, называемой цитоплазматической
мембраной (ЦПМ). ЦПМ состоит из двойного слоя фосфолипидов, пронизанных
белковыми молекулами (рис. 1.5).
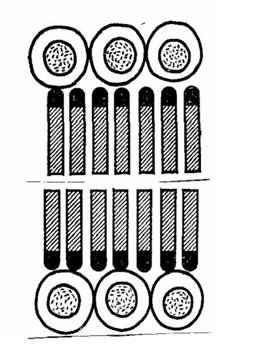
Рис. 1.5 Строение плазматической мембраны
Два слоя фосфолипидных молекул, обращенных гидрофобными полюсами друг к другу и покрытых двумя слоями молекул глобулярного белка. С ЦПМ связаны многие ферменты и белки, участвующие в переносе питательных веществ, а также ферменты и переносчики электронов конечных стадий биологического окисления (дегидрогеназы, цитохром-ная система, АТФ-аза). На ЦМП локализуются ферменты, катализирующие синтез пептидогликана, белков клеточной стенки, собственных структур. Мембрана является также местом превращения энергии при фотосинтезе. Периплазматическое пространство Периплазматическое пространство (периплазма) представляет собой зону между клеточной стенкой и ЦПМ. Толщина периплазмы составляет около 10 нм, объем зависит от условий среды и прежде всего от осмотических свойств раствора. Периплазма может включать до 20 % всей находящейся в клетке воды, в ней локализуются некоторые ферменты (фосфатазы, пермеазы, нуклеазы и др.) и транспортные белки -переносчики соответствующих субстратов. Цитоплазма Содержимое клетки, окруженное ЦПМ, составляет цитоплазму бактерий. Та часть цитоплазмы, которая имеет гомогенную коллоидную консистенцию и содержит растворимые РНК, ферменты, субстраты и продукты обмена веществ, обозначается как цитозоль. Другая часть цитоплазмы представлена различными структурными элементами: мезосомами, рибосомами, включениями, нуклеоидом, плазмидами. Рибосомы - субмикроскопические рибонуклеопротеиновые гранулы диаметром 15-20 нм. В рибосомах находится примерно 80-85 % всей бактериальной РНК. Рибосомы прокариот имеют константу седиментации 70 S. Они построены из двух частиц: 30 S (малая субъединица) и 50 S (большая субъединица)(рис.1.6).
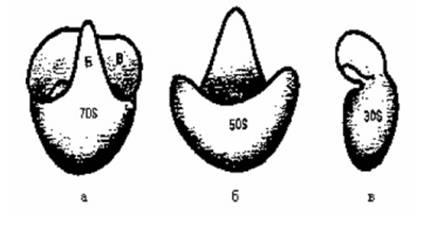
Рис. 1.6. Рибосома (а) и ее субчастицы -
большая (б) и малая (в) Рибосомы служат местом синтеза белка.
Цитоплазматические включения
Нередко в цитоплазме бактерий обнаруживаются различные включения, которые образуются в процессе жизнедеятельности: капельки нейтральных липидов, воска, серы, гранулы гликогена, в-гидроксимасляной кислоты (особенно у рода Bacillus). Гликоген и в-гидроксимасляная кислота служат для бактерий запасным источником энергии. У некоторых бактерий в цитоплазме находятся кристаллы белковой природы, обладающие ядовитым действием на насекомых. Некоторые бактерии способны накапливать фосфорную кислоту в виде гранул полифосфата (зерна волютина, метахроматические зерна). Они играют роль фосфатных депо и выявляются в виде плотных образований в форме шара или эллипса, располагающихся в основном у полюсов клетки. Обычно на полюсах бывает по одной грануле. Нуклеоид Нуклеоид - ядерный аппарат бактерий. Представлен молекулой ДНК, соответствующей одной хромосоме. Она замкнута, располагается в ядерной вакуоле, не имеет ограничивающей от цитоплазмы мембраны. С ДНК связано небольшое количество РНК и РНК-полимеразы. ДНК свернута вокруг центрального стержня, состоящего из РНК, и представляет собой высокоупорядоченную компактную структуру. Хромосомы большинства прокариот имеют молекулярную массу в пределах 1-3 х109, константу седиментации 1300-2000 S. Молекула ДНК включает 1,6х10 нуклеотидных пар. Различия в генетическом аппарате прокариотических и эукариотических клеток обусловливают его название: у первых - нуклеоид (образование, подобное ядру), в отличие от ядра у вторых. В нуклеоиде бактерий содержится основная наследственная информация, которая реализуется в синтезе специфических белковых молекул. С ДНК бактериальной клетки связаны системы репликации, репарации, транскрипции и трансляции. Нуклеоид в прокариотической клетке может быть выявлен в окрашенных препаратах с помощью светового или фазово-контрастного микроскопа.э У многих бактерий в цитоплазме обнаружены внехромосомные генетические элементы - плазмиды. Они представляют собой замкнутые в кольца двухцепочечные ДНК, состоящие из 1500-40000 пар нуклеотидов и содержащие до 100 генов. Капсула Капсула - слизистый слой клеточной стенки бактерий, состоящий из полисахаридов или полипептидов. Микрокапсулу (толщиной менее 0,2 мкм) способны формировать большинство бактерий. Жгутики Жгутики выполняют роль органа движения, позволяющего бактериям передвигаться со скоростью 20-60 мкм/сек. Бактерии могут иметь один или несколько жгутиков, располагающихся по всей поверхности тела либо собранных в пучки у одного полюса, у разных полюсов. Толщина жгутиков в среднем составляет 10-30 нм, а длина достигает 10-20 мкм. Основу жгутика составляет длинная спиральная нить (фибрилла), которая у поверхности клеточной стенки переходит в утолщенную изогнутую структуру - крюк и прикрепляется к базальной грануле, вмонтированной в клеточную стенку и ЦПМ (рис. 1.7).
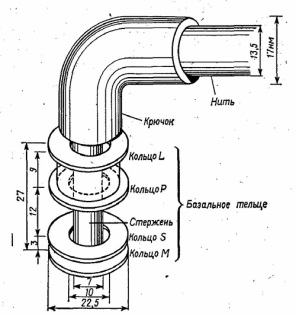
Рис. 1.7. Схематическая модель базального конца жгутика Е. coli, основанная на
электронных микрофотографиях выделенной органеллы Базальные гранулы имеют
диаметр около 40 нм и состоят из нескольких колец (одна пара - у
грамположительных бактерий, четыре - у грамотрицательных прокариот).
Удаление пептидогликанового слоя
клеточной стенки ведет к потере способности бактерий к движению, хотя жгутики
при этом остаются неповрежденными. Жгутики почти полностью состоят из белка
флагеллина с некоторым содержанием углеводов и РНК.
Споры
Некоторые бактерии в конце периода активного роста способны образовывать споры. Этому предшествует обеднение среды питательными веществами, изменение ее рН, накопление ядовитых продуктов метаболизма. Как правило, одна бактериальная клетка образует одну спору - локализация спор различна (центральная, терминальная, субтерминальная - рис. 1.8).
Рис. 1.8. Типичные формы спорообразующих клеток. Если размеры спор не превышают поперечного размера палочковидной бактерии, то последняя называется бациллой.
Когда диаметр споры больше - бактерии имеют форму веретена и носят название клостридий. По химическому составу различие спор от вегетативных клеток состоит лишь в количественном содержании химических соединений. Споры содержат меньше воды и больше липидов. В состоянии споры микроорганизмы метаболически неактивны, выдерживают высокую температуру (140-150°С) и воздействие химических дезинфицирующих веществ, длительно сохраняются в окружающей среде. Попадая в питательную среду, споры прорастают в вегетативные клетки. Процесс прорастания спор включает три стадии: активации, начальной стадии и стадии роста. К активирующим агентам, нарушающим состояние покоя, относят повышенную температуру, кислую реакцию среды, механические повреждения и др. Спора начинает поглощать воду и с помощью гидролитических ферментов разрушает многие собственные структурные компоненты. После разрушения наружных слоев наступает период формирования вегетативной клетки с активацией биосинтеза, заканчивающейся делением клетки.
2.
Движение и размножение бактерий.
2.1 Спорообразование и его биологическая роль
Движение бактерий не является особенностью всех бактерий, только некоторые способны двигаться. Органом движения является жгутик. Подвижные спирохеты движутся за счет ритмических изгибов всего тела. Для миксобактерий характерно реактивное движение за счет выделяющейся слизи. Характер движения у жгутиковых организмов зависит от типа жгутикования. Бактерии с полярным жгутиком всегда движутся по прямой линии, только изредка совершая легкие колебательные движения. Движение перитрихов беспорядочно и связано с оживленным кувырканием. У лофотрихов жгутики перемещаются подобно корабельному винту.
Скорость движения у различных бактерий различна. Некоторые виды при благоприятных условиях могут двигаться на расстояние в 10 раз превышающее размеры клетки.
Процесс спорообразования у бактерий является стадией развития. Спора играет роль защитного приспособления, которым природа снабдила их для борьбы с неблагоприятными условиями. Способностью образовывать споры - особые тельца эллиптической и округлой формы обладают палочковидные бактерии. На образование споры затрачивается или все содержимое клетки или большая часть протоплазматического содержимого. Спора образуется в результате уплотнения протоплазмы в определенном участке, содержащим ядерную субстанцию. Эта часть названа А.А. Имшеницким спорогенной зоной. В дальнейшем из этого участка вначале образуется проспора, которая далее покрывается специальными оболочками и превращается в спору. Длительность процесса 1,5-24 часа.
В начале фазы спора хорошо окрашивается анилиновыми красками, а по мере созревания она становится более плотной и трудноокрашиваемой, что (связано) объясняется малопроницаемой наружной оболочкой. Однако, такое объяснение не вполне удовлетворительно, т.к. в зрелом состоянии оболочка споры окрашивается, а содержимое остается не окрашенным. Это дает основание предположить, что цитоплазма изменила физико-химические свойства. А именно: вода находится в связанном состоянии, благодаря чему спора приобретает теплоустойчивость, увеличивается содержание Са и Mg, что тоже повышает стойкость к нагреванию. В дальнейшем оболочка споры раздваивается: внутреннее - интина - участвует в прорастании споры и на ее базе строится оболочка новой вегетативной клетки. Наружная оболочка -экзина выполняет защитную функцию. По мере созревания споры, вегетативная клетка отмирает. Малая активность ферментов, плохая проницаемость наружной оболочки ограничивают обмен спор с внешней средой, что позволяет им сохранить жизнеспособность десятки и сотни лет. Жизнеспособные споры были выделены из египетских мумий, трупов мамонтов.
Обычно к спорообразованию бациллы приступают при истощении питательной среды или при накоплении в среде продуктов обмена. Механизм спорообразования не ясен.
В благоприятных условиях спора прорастает. Сначала она набухает, увеличивается ее размеры, происходит активизация ферментов, разрывается нарушенная оболочка и проросток выходит наружу. Переход из споры в вегетативную клетку может происходить за 40-50 мин. Обычно споры прорастают полярно, на одном или на обоих концах, иногда экваториально поперечно продольной оси, реже наблюдается косое прорастание.
Некоторые бациллы при определенных условиях теряют способность образовывать споры (например: при накоплении ядовитых веществ в среде возникают целые поколения - аспорогенные расы).
Таким образом, спора - защитное приспособление не имеющее никакого отношения к размножению.
2.2 Размножение бактерий
Основным путем размножения у бактерий является бесполое размножение. Однако у некоторых бактерий встречается и половое размножение - конъюгация.
Бесполое размножение: молодая клетка растет, достигает определенной величины и перпендикулярно ее длине образуется внутренняя перегородка. Затем перегородка расщепляется надвое и получается две дочерние клетки (фактически образуется две клетки: материнская и дочерняя). Скорость размножения зависит от условий, при благоприятных внешних факторах деление отмечается через каждые 20-30 мин, а у термофилов даже через 5 минут.
Разновидностью бесполого размножения является почкование, которое имеет место наряду с делением у микобактерий. Скорость размножения настолько велика, что теоретически микробные клетки заполнили бы все моря и океаны за несколько суток. Однако различные факторы тормозят процесс размножения бактерий: истощение питательных веществ в среде, накопление продуктов обмена, поедание их простейшими, растворение фагами, действие физических и химических факторов.
Некоторые бактерии имеет в своем развитии ряд последовательных изменений, которые можно назвать циклом развития. Пример: молодая сенная палочка (bac.subtilis) несет много жгутиков, которые она перед деление сбрасывает и усиленно делится, образуя длинные цепочки палочек. Затем цепочки распадаются на отдельные клетки и каждая из них вновь размножается. После многократного размножения клетки переходят к спорообразованию. При благоприятных условиях спора прорастает и образуется подвижная палочка.
Половое размножение - конъюгация впервые открыто Ледербергом и Татум (1946) и доказано генетическим методом. После их открытия было подтверждено с помощью электрического микроскопа.
Суть коньюгации: клетка - донор, реципиент сближаются, и между ними образуется цитоплазматический мостик, по которому генетический материал донора переходит в клетку реципиент. После расхождения эти клетки могут делиться бесполым путем. Биологический смысл этого процесса в том, что с передачей генетического материала передаются и определенные свойства, факторы, которыми не обладала клетка реципиент. Так могут чередоваться «факторы устойчивости» к стрептомицину, тетрациклину и др. веществам, в результате бактерии приобретают устойчивость к антибиотикам и другим терапевтическим средствам.
2.2.1 Процессы трансдукции и трансформации.
Передача признаков у бактерий возможна с помощью процессов трансдукции и трансформации.
Трансформация
Трансформацией называется перенос чистой ДНК из одних клеток в другие. Трансформация была открыта бактериологом Ф. Гриффитсом в 1928 г. в опытах с пневмококками. У пневмококков известно два типа штаммов: S– и R–формы.
S–форма характеризуется наличием полисахаридной капсулы, благодаря чему при искусственном культивировании она образует гладкие блестящие колонии; эта форма патогенна для мышей. R–форма не имеет капсулы, при искусственном культивировании она образует шероховатые колонии; эта форма непатогенна для мышей. Но если мышам одновременно ввести убитые S–клетки и живые R–клетки, то мыши погибают. Следовательно, генетические свойства одного штамма влияют на генетические свойства другого штамма.
В 1944 г. О. Эвери, К. МакЛеод и М. МакКарти доказали, что изменение наследственных свойств клеток связано с переносом ДНК.
Способность клетки к трансформации возможна при особом ее состоянии, которое называется компетентностью. У компетентных клеток изменяется состав клеточной стенки и плазмалеммы: стенка становится пористой, плазмалемма образует многочисленные впячивания, а на внешней поверхности появляются особые антигены – факторы компетентности (в частности, специфические белки с низкой молекулярной массой).
В природных условиях внеклеточная чистая ДНК образуется при гибели (лизисе) прокариот.
Как правило, трансформация происходит в пределах одного вида прокариот, но при наличии гомологичных генов наблюдается и межвидовая трансформация.
Процесс трансформации включает следующие стадии:
1. Присоединение трансформирующей двунитевой ДНК к рецепторам на поверхности клетки–реципиента.
2. Превращение двунитевой ДНК в однонитевую.
3. Проникновение однонитевой ДНК в клетку.
4. Интеграция трансформирующей ДНК в хромосому реципиента и рекомбинация генетического материала.
Длина трансформирующей ДНК должна быть от 500 до 200 тысяч пн. Энергия, выделяющаяся при деградации одной из нитей ДНК, используется для активного транспорта оставшейся нити вовнутрь клетки.
Первые три стадии трансформации не зависят от нуклеотидного состава ДНК. Однако процесс интеграции трансформирующей ДНК в хромосому реципиента более вероятен при высокой гомологичности этой ДНК по отношению к ДНК реципиента.
Процесс трансформации изображен на схеме. Каждый отрезок прямой соответствует одной цепи ДНК. Трансформирующая ДНК обозначена черным цветом, а ДНК клетки–реципиента – серым цветом.
На первой стадии трансформирующая ДНК присоединяется к рецепторным сайтам на поверхности клетки–реципиента.
На втором этапе двунитевая ДНК на поверхности клетки превращается в однонитевую за счет расщепления одной из нитей бактериальными нуклеазами.
На третьем этапе оставшаяся нить ДНК транспортируется через мембрану в цитоплазму. При этом используется энергия, выделившаяся при деградации комплементарной цепи.
При репликации бактериальной хромосомы трансформирующая нить ДНК присоединяется к гомологичному (частично комплементарному) участку ДНК клетки–реципиента. При этом из-за отсутствия полной комплементарности образуется гетеродуплекс («молекулярная гетерозигота») – участок двунитевой ДНК, на котором не во всех нуклеотидных парах азотистые основания связаны водородными связями. Остальная часть ДНК реплицируется нормальным образом.
После окончания репликации ДНК клетка–реципиент делится с образованием двух клеток: частично трансформированной клетки с хромосомой, включающей гетеродуплексный участок ДНК, и нетрансформированной клетки. При репликации ДНК в частично трансформированной клетке на обеих цепях ДНК происходит достраивание комплементарных цепей. Одна цепь сохраняет исходные последовательности нуклеотидов, а другая становится полностью трансформированной. После деления частично трансформированной клетки образуется одна нетрансформированная клетка и одна полностью трансформированная, у которой исходная последовательность нуклеотидов замещена на последовательность нуклеотидов трансформирующей ДНК.
Таким образом, при трансформации происходит не добавление новых генов, а замещение генов реципиента на гомологичные нуклеотидные последовательности.
Частота трансформации у прокариот зависит от свойств трансформирующей ДНК, от ее концентрации, от состояния клетки–реципиента, от вида бактерий. Максимальная частота трансформированных клеток не превышает 1 на 100 клеток.
Трансформация известна и для эукариот. Однако на поверхности эукариотических клеток отсутствуют рецепторные сайты, и трансформирующую ДНК вводят в клетки искусственно. Например, в яйцеклетки животных ДНК вводят путем прямой микроинъекции, а в яйцеклетки растений – путем микроинъекции в пыльцевую трубку.
Трансдукцией называется перенос генетического материала с помощью вирусов из клетки-донора в клетку-реципиент.
Явление трансдукции открыл в 1951 г. Н. Зиндер (ученик Дж. Ледерберга).
При трансдукции в вирионы попадает ДНК клетки-хозяина. Вирионы заражают другие клетки, и ДНК исходной бактериальной клетки проникает в другую бактериальную клетку. Вирусная ДНК интегрируется в бактериальную хромосому, а привнесенная бактериальная ДНК рекомбинирует с ДНК бактериальной хромосомы. В результате 50% клеток оказываются трансформированными.
Различают общую (неспецифическую), ограниченную (специфическую) и абортивную трансдукцию.
Общая трансдукция
При общей трансдукции фрагменты бактериальной ДНК донора случайно включаются в созревающую фаговую частицу вместе с фаговой ДНК или вместо фаговой ДНК. Фрагменты бактериальной ДНК образуются при ее разрезании ферментом, контролируемым фагом. В состав фаговой частицы может включаться до 100 бактериальных генов.
Ограниченная трансдукция
При ограниченной трансдукции происходит рекомбинация – бактериальная ДНК замещает часть фаговой ДНК. В состав рекомбинантной ДНК входит небольшое количество бактериальных генов, прилежащих к фаговой ДНК, интегрированной в бактериальную хромосому.
При общей и ограниченной трансдукции донорская ДНК замещает гомологичные участки ДНК реципиента. Этот процесс сходен с трансформацией.
Абортивная трансдукция может быть и неспецифической, и специфической. Ее сущность заключается в том, что трансдуцируемый фагом фрагмент ДНК не включается в хромосому реципиента, а существует как цитоплазматический репликон. Рано или поздно этот репликон утрачивается.
Явление трансдукции вирусами широко используется при переносе генов у эукариот. Если применяется вирус, неспособный формировать капсид (то есть существующий только в форме ДНК), то трансдукция принципиально не отличается от трансформации или от конъюгативного переноса генетического материала с помощью плазмид–векторов. Созданы системы векторов на основе модифицированных вирусов SV40 (они образуют в клетке до 100 тысяч копий), герпеса, осповакцины, вирус мозаики цветной капусты.
Следует еще раз подчеркнуть, что все описанные типы рекомбинации связаны не с добавлением новых участков ДНК, а с замещением уже имеющихся нуклеотидных последовательностей. Чем выше степень гомологии трансформирующей и исходной ДНК, тем выше вероятность успешной рекомбинации. Легче всего удается рекомбинация ферментов, имеющихся у всех организмов. Труднее ввести в геном новые регуляторы, отличающиеся высокой специфичностью. Поэтому для внедрения в геном новых генов используются более сложные методы, связанные с биохимическими модификациями ДНК.
3. Анатомия бактериальной клетки. Физиология и генетика.
3.1 физиология бактерий
Жизнь бактерий, как и других живых существ, в упрощённом виде сводится к таким последовательным событиям: собственное воспроизведение -» обеспечение жизненных функций -» воспроизведение потомства. Нормальная реализация этого круговорота жизни для любого вида бактерий возможна лишь при развитии адекватных ответных реакций на любые воздействия окружающей среды, что во многом обеспечивается генетической информацией организма. Жизнь бактерий, равно как и всех живых существ, характеризуется ростом и размножением, то есть увеличением живой массы отдельной особи и популяции в целом за счет ассимиляции веществ, находящихся вне клетки. В данном аспекте нет никакой существенной разницы между питанием паразитической бактерии или автотрофной бактерии, использующей, подобно высшим растениям, углекислоту и минеральные вещества. Во всех случаях процесс питания сводится к усвоению экзогенных субстратов и превращению их (через каскад сложных реакций) в вещества, необходимые для нормальной жизнедеятельности бактерий.
Питание бактерий
Пишей принято называть любое вещество, которое, попав в организм, служит источником энергии или пластическим материалом для синтеза молекул, используемых для нужд организма. Большинство животных, включая человека, способно заглатывать и переваривать плотные частички пищи в основном за счёт их гидролиза. Подобный тип питания известен как голо- зойныЁ, а организмы — голозои [от греч. hobs,полноценный, + zoikos,относящийся к животным]. Бактерии не способны захватывать твердофазные объекты, поэтому утилизируют питательные вещества в виде относительно простых молекул из водных растворов. Подобный тип питания, присущий также всем растениям, известен как голофитный, то есть бактерии — голофиты [от греч. holos,полноценный, + phytikos,относящийся к растениям]. Тем не менее многие бактерии способны утилизировать твёрдую пищу с помощью так называемого внешнего питания, реализуемого вне клеток, то есть бактериям также присущ и голозойный тип питания. Для этого они имеют мощный ферментативный потенциал, хотя иногда секретируемые ферменты могут полностью инактивироваться в результате разведения, под действием конвекционных токов и других факторов. Контакт пищеварительных ферментов с экзогенным субстратом приводит к образованию низкомолекулярных продуктов, проникающих через клеточную стенку в цитоплазму. Начиная с этого момента, процессы их усвоения (метаболизма) в растительных и животных клетках протекают удивительно сходно.
Клетки всех живых существ, от самых примитивных форм до высокоразвитых животник и растений, не только состоят из одних и тех же веществ, но и используют одни и те же механизмы для получения энергии и для роста. По сравнению с этим фундаментальным биохимическим единством существующие различия и отклонения кажутся незначительными.
Вода
Бода составляет около 80% массы бактерий. Рост и развитие бактерий облигатно зависят от наличия воды, так как все химические реакции, протекающие в живых организмах, реализуются в водной среде. Для нормального роста и развития микроорганизмов необходимо присутствие воды в окружающей среде. Для бактерий содержание воды в субстрате должно быть более 20%. Вода должна находиться в доступной форме: в жидкой фазе в интервале температур от 2 до 60 °С; этот интервал известен как биокипетическая зона. Хотя в химическом отношении вода весьма устойчива, продукты её ионизации — ионы Н+ и ОН” оказывают очень большое влияние на свойства практически всех компонентов клетки (белков, нуклеиновых кислот, липидов и т.д.). Так, каталитическая активность ферментов в значительной мере зависит от концентрации ионов Н+ и ОН".
Усваиваемые соединения
Основные соединения, усваиваемые бактериальной клеткой, — углеводы, аминокислоты, органические кислоты, жирные кислоты, минеральные вещества, витамины и др. Бактериям совершенно безразличны источники питательных веществ; образно говоря, они «лишены вкуса и не страдают несварением желудка». Более того, бактерии иногда утилизируют вещества, не пригодные для животных клеток (например, карболовую кислоту, парафин, мыло и др.). Подобно прочим формам жизни, бактерии нуждаются в одних и тех же макроэлементах — С, Н, О, N, Р, S, К, Са, Mg, Fe. Микроэлементы (следовые элементы) — Mn, Mo, Zn, Си, Со, Ni, Va, В, С], Na, Se, Si, Wo — не нужны каждому организму, но бактериям они необходимы для синтеза коферментов либо поддержания специфического типа метаболизма. Например, для оптимального роста некоторые бактерии нуждаются в высоких концентрациях Na+; их называют галофилами [от греч. hals,соль]. Помимо источников углерода, энергии и элементов минерального питания, многие микроорганизмы нуждаются в некоторых дополнительных веществах, называемых факторами роста. Количественная потребность в питательных элементах и их содержание у различных бактерий варьируют, но принципиально химический состав бактериальной клетки сходен с другими живыми клетками (исключением является отсутствие у бактерий стеролов).
Пути поступления веществ в бактериальную клетку
Для того чтобы питательные вещества могли подвергнуться соответствующим превращениям в клетке, они прежде всего должны в неё проникнуть. Но большинство бактерий обитает в условиях, мало пригодных для поддержания строгих соотношений воды, неорганических и органических веществ, без которых их жизнь просто невозможна. Клеточная стенка бактерий не является существенным барьером для небольших молекул и ионов, но задерживает макромолекулы. Истинный барьер, обеспечивающий избирательное поступление веществ в клетку, — ЦПМ. Она проницаема для одних веществ и непроницаема для других. Потоки веществ движутся в обоих направлениях (внутрь и наружу). Эти перемещения обеспечивают разнообразные транспортные системы, необходимые для выполнения двух важнейших задач.
Обеспечение адекватных концентраций веществ, участвующих в основных биохимических реакциях, в том числе и обеспечение, при необходимости, их быстрого поступления внутрь клетки, невзирая на концентрацию этих веществ в окружающей среде.
Поддержание осмотического давления, оптимального для протекания биохимических реакций. Поступление различных веществ внутрь бактериальной клетки реализуют три механизма: пассивный перенос, активный перенос и транспорт, обусловленный фосфорилированием
Многие вещества способны неспецифически проникать в бактериальную клетку за счёт различия их концентраций по обе стороны ЦПМ. При этом они поступают в клетку только до выравнивания градиента концентрации с внешним раствором. Такое поступление веществ происходит пассивно, без прямых энергетических затрат. Существует два вида пассивной диффузии: простая и облегчённая.
Простая диффузия. Проникновение веществ носит неспецифический характер и целиком зависит от размеров молекул и их липофильности. Скорость подобного переноса незначительна
Транспорт сопровождается образованием комплекса «вещество-пермеаза». После преодоления ЦПМ комплекс диссоциирует, а пермеаза используется для последующего «проведения» других молекул. Подобный тип транспорта реализуется по градиенту концентрации и характерен для эукариотов при поглощении сахаров. У прокариотов единственный пример облегчённой диффузии — проникновение глицерина в клетки бактерий кишечной группы. При этом концентрация проникшего глицерина практически равна его концентрации в окружающей среде. В последующем (в результате реакций фосфорилирования) глицерин трансформируется в глицерин-3-фосфат.
Активный перенос
Концентрация некоторых веществ в бактериальной клетке может в сотни раз превышать их; содержание в окружающей среде. Транспорт таких веществ в клетку происходит против градиента концентрации перемещаемого вещества, требует затрат энергии и реализуется при помощи специфических переносчиков. Например, в случае активного транспорта, как и при облегчённой диффузии, перемещение конкретного вещества через ЦПМ осуществляет специфическая для такого вещества пермеаза.
Активный транспорт сопровождается увеличением свободной энергии, которая составляет] 5,71 lg C2/Cj кДж ¦ моль, где С2 и С( — соответственно более высокая и более низкая концен-; трации. Это обстоятельство делает процесс активного транспорта энергозависимым. У бактеА рий подобный тип поступления веществ доминирует, с его помощью транспортируются многие сахара, белки и другие вещества. Нередко у грамотрицательных бактерий в активном | переносе участвуют специальные белки, отличные от пермеаз, но действующие в ассоциации c l ними. Эти белки локализованы в периплазматическом пространстве. После проникновения вещества в клетку комплекс «субстрат — белок периплазмы — пермеаза» диссоциирует и для попавшего в клетку вещества вероятность выхода наружу резко снижается.
Примером активного транспорта служит концентрирование лактозы в клетках кишечной палочки. Эта система известна как (З-галактозидпермеазная система. Энергия используется для снижения сродства пермеазы к лактозе на внутренней стороне ЦПМ по сравнению с ее сродством к тому же субстрату на внешней. В результате скорость выхода вещества наружу становится меньше, чем скорость его поступления внутрь клетки, и концентрация лактозы в клетке возрастает. Если блокировать образование энергии, то р-галактозидпермеазная система
теряет способность осуществлять активный транспорт и переключается на облегчённую диффузию, обнаруживая одинаковое сродство к р-галактозидам по обе стороны мембраны. Транспорт, обусловленный фосфорилированием
Транспорт, обусловленный фосфорилированием — энергозависимый процесс, используемый при утилизации углеводов. Основной механизм транспорта связан с фосфорилированием субстрата, что делает невозможным его выход из клетки. Первоначально происходит фосфори- лирование мембранного фермента (так называемый фермент 2, или Ф2) в цитоплазме за счёт фосфоенолпирувата. Фосфорилированный фермент связывает углевод (например, глюкозу или маннозу) на поверхности ЦПМ и транспортирует его в цитоплазму. Затем комплекс диссоциирует с высвобождением углевода, связанного с фосфатной группой. За счёт фосфорилирова- ния углевод аккумулируется в клетке и не способен выходить из неё. Данный тип транспорта не рассматривают как активный, поскольку концентрация неизменённого питательного вещества внутри клетки может быть одинаковой с его внеклеточным содержанием. Но в целом этот процесс напоминает активный транспорт против градиента концентрации вещества, так как концентрация химически изменённого питательного соединения внутри клетки может значительно превышать концентрацию неизменённого соединения в среде.
3.2. Выделение веществ из бактериальной клетки
Бактерии секретируют широкий спектр БАБ — ферменты, токсины, антибиотики и др. Некоторые соединения секретируются в окружающую среду непосредственно через ЦПМ, другие (обычно белки) первоначально попадают в периплазматическую полость в виде предшественников. Предшественник содержит сигнальный пептид, с помощью которого молекула белка проходит во внешнюю среду. На поверхности ЦПМ сигнальная пептидаза отщепляет сигнальный пептид, и этим завершает превращение внутриклеточного предшественника в зрелый сек- ретируемый белок. Процессы выделения в среду определённых соединений из бактериальной клетки нельзя рассматривать как выброс «шлаков»: это скорее механизмы адаптации микроорганизмов к условиям внешней среды, которые требуют конкурентной борьбы либо использования особых полимерных субстратов. В первом случае продукция антибиотиков даёт преимущество штам му-продуценту по сравнению с другими микроорганизмами, во втором — секреция гидролаз позволяет утилизировать труднодоступный субстрат, что обеспечивает их продуцентам успех в борьбе за источники питания в данной экологической нише.
3.2.1 ферменты в жизнедеятельности бактерий
Все питательные вещества и любые элементы, подвергающиеся взаимодействиям и превращениям с участием бактерий, вступают в реакции при участии ферментов. Ферменты [от лат. fermentum,закваска], или энзимы [от греч. enzyme, дрожжи или закваска], — специфичные и эффективные белковые катализаторы, присутствующие во всех живых клетках. За каждое превращение одного соединения в другое ответственен особый фермент.
Ферменты снижают энергию активации, обеспечивая протекание таких химических реакций, которые без них могли бы проходить только при высокой температуре, избыточном давлении и при других нефизиологических условиях, неприемлемых для живой клетки.
Ферменты увеличивают скорость реакции примерно на 10 порядков, что сокращает полупери- од какой-либо реакции с 300 лет до одной секунды.
Ферменты «узнают» субстрат по пространственному расположению его молекулы и распределению зарядов в ней. За связывание с субстратом отвечает определённый участок молекулы ферментативного белка — его каталитический центр. При этом образуется промежуточный фермент-субстратный комплекс, который затем распадается с образованием продукта реакции и свободного фермента.
Регуляторные (аллостерические) ферменты воспринимают различные метаболические сигналы и в соответствии с ними изменяют свою каталитическую активность.
Эффекторные ферменты. Известно шесть основных классов ферментов, катализирующих следующие реакции: оксидоредуктазы — перенос электронов; трансферазы — перенос различных химических групп; гидролазы — перенос функциональных групп на молекулу воды; лиазы — присоединение групп по двойным связям и обратные реакции; изомера- зы — перенос групп внутри молекулы с образованием изомерных форм; лигазы — образование связей С-С, С-S, С_0, C-N за счёт реакций конденсации, сопряжённых с распадом аденозинтрифосфата (АТФ).
Бактерии способны синтезировать все ферменты, необходимые для утилизации широкого спектра питательных субстратов. Определённый субстрат в среде вызывает синтез ферментов, обеспечи- < вающих его катаболизм. В этом случае говорят об индукции катаболических ферментов индуцирующим субстратом (иидуцибельные ферменты). Образование анаболических ферментов в процессах биосинтеза регулируется путём репрессии конечным продуктом (репрессибельные ферменты). Если в среде имеются одновременно два субстрата, то бактерия использует субстрат. обеспечивающий более быстрый рост. Синтез ферментов для расщепления второго субстрата репрессируется; такой вариант известен как катаболитная репрессия. Ферменты, синтезируемые вне зависимости от условий среды, — конститутивные ферменты.
Определение ферментативной активности бактерий играет огромную роль в их идентификации. Например, все аэробы или факультативные анаэробы обладают супероксид дисму- тазой и каталазой — ферментами, защищающими клетку от токсичных продуктов кислородного метаболизма. Практически все облигатные анаэробы не синтезируют эти ферменты. Только одна группа аэробных бактерий — молочнокислые бактерии каталазонегативны, но аккумулируют псроксидазу — фермент, катализирующий окисление органических соединений под действием Н202 (восстанавливается до воды). Наличие аргининдигидролазы — диагностический признак, позволяющий различить сапрофитические виды Pseudomonasот фитопатогенных. Среди пяти основных групп семейства Enterobacteriaceaeтолько две — Escherichiae и Erw"miae— не синтезируют уреазу. Часто вирулентность штамма связана с повышенной активностью ферментов, ответственных за синтез токсинов.
Получение микробных ферментов— важнейшая отрасль промышленной микробиологии. Например, для улучшения пищеварения применяют готовые препараты ферментов — амилазы, целлюлазы, протеазы, липазы, облегчающих соответственно гидролиз крахмала, целлюлозы, белка и липидов. При изготовлении сладостей для предупреждения кристаллизации сахарозы применяют инвертазу дрожжей, для осветления фруктовых соков — пектиназу. Коллагеназа клостридий и стрептокиназа стрептококков, гидролизующие белки, способствуют заживлению ран и ожогов. Литические ферменты бактерий, секретируемые в окружающую среду, действуют на клеточные стенки патогенных микроорганизмов и служат эффективным средством в борьбе с последними, даже если они обладают множественной устойчивостью к антибиотикам. В качестве инструментария в биоорганической химии, генной инженерии и генотерапии используют выделенные из бактерий рибонуклеази, дезоксирибонуклеазы, полимеразы, ДНК-лигазы и прочие ферменты, направленно модифицирующие нуклеиновые кислоты.
Питательные субстраты бактерий
Кислород, водород, углерод и азот — основные элементы, своего рода «кирпичики» (органо-гены), составляющие органические вещества. По типу питания растительные и животные орга-4 низмы разительно отличаются, их рассматривают соответственно как аутотрофы и гетеро- трофы. Аутотрофы способны синтезировать все необходимые органические соединения из yr-J лекислоты, гетсротрофы нуждаются в органических источниках углерода. Для микроорганизмов] дачная классификация недостаточна, поскольку многообразие способов их питания можно от-] разить лишь с учётом источников энергии, углерода и донора водорода. Поэтому понятия «ауто-І трофпосты» и «гетеротрофность» в отношении бактерий применяют, имея в виду происхождеА пие клеточного углерода как источника энергии. і
УГЛЕРОД
Наиболее доступные источники углерода для бактерий — углеводы и аминокислоты, что! учитывают при изготовлении питательных сред.
Аутотрофия. Пищевые потребности аутотрофных [от греч. auto,сам, + trophe,питаниея бактерий ограничены; для их роста достаточно внесения в среду неорганических соединений,! содержащих азот и другие минеральные элементы. Аутотрофные бактерии в качестве источА ника углерода утилизируют двуокись углерода или карбонаты. Такие бактерии способны синте-1 зировать Rce необходимые соединения из простых веществ. К ним относят фото- и хемотрофные! (хемосинтезирующие) бактерии, использующие соответственно в качестве источника энергий! электромагнитное излучение (свет), либо энергию окислительно-восстановительных реакций я участием субстратов, которые служат для них источником питания. Среди аутотрофов не обна-1 ружено видов, имеющих медицинское значение.
Гетеротрофия [от греч. hetero,другой, + trophe,питание]. Некоторые бактерии не способны полностью обеспечить собственный метаболизм за счёт своих синтетических возможностей и нуждаются в наличии минимально одного органического соединения (обычно нужны аминокислоты как источник углерода и азота или углеводы в качестве источника углерода) в окружающей среде. Гетеротрофные бактерии в качестве источников углерода используют различные углеродсодержащие соединения — гексозы, многоатомные спирты, аминокислоты, органи-ческие кислоты и углеводороды. К гетеротрофным бактериям также относят бактерии-сапрофиты (метатрофы), развивающиеся на мёртвых органических остатках и бактерии-паразиты (пара- трофы), усваивающие органические соединения в форме сложных веществ живого организма.
Азот
Азот необходим бактериям для синтеза аминокислот (белков), пуриновых и пиримидиновых нуклеотидов, а также некоторых витаминов. Поскольку азот во всех живых организмах содержится в восстановленной форме, все минеральные формы азота с большей, чем у аммиака, степенью окисленности должны быть восстановлены.
Ряд микроорганизмов способен утилизировать азот только из органических соединений (ами- ногетеротрофы). Некоторые из микроорганизмов усваивают азот в виде неорганических форм (аминоаутотрофы). Однако многие микроорганизмы способны использовать как органический, так и минеральный азот.
Использование неорганического азота
В природе атомы минерального азота существуют в различной степени окисленности: от N5+ (N205, азотный ангидрид) до N3_ (NH3, аммиак). Степень усвояемости минеральных соединений азота бактериями определяется лёгкостью их превращения в аммиак, так как он является самым простым предшественником высокомолекулярных азоторганических соединений. В этой группе бактерий возможны два разнонаправленных процесса: ассимиляция (связывания минеральных форм азота в органический материал) и диссимиляция (выделения газообразных форм азота).
Ассимиляционные процессы. Связывание минеральных форм азота происходит в ходе
азотфиксации, ассимиляции аммиака и ассимиляционной нитратредукции.
Азотфиксация. Азотфиксирующие бактерии (например, Rhizobium, Azotobacter, Clostridium, Klebsiellaи др.) способны утилизировать азот из атмосферного воздуха, восстанавливая его до аммония с помощью специального фермента (нитрогеназа) в процессе, называемом азотфиксация.
Ассимиляция аммиака. Большинство бактерий усваивает аммоний в ходе ассимиляции аммиака. Бактерии, растущие на средах с аммонием, могут непосредственно включать его в органические соединения. Следует помнить, что после потребления неорганических аммонийных солей в среде накапливаются анионы (SO|~, СГ, Н3Р03~ и др.), снижающие pH среды, что замедляет рост культур. Аммонийные соли органических кислот менее подкисляют среду и более благоприятны для роста бактерий.
Ассимиляционная нитратредукция. Подавляющее большинство бактерий и грибов, как и растения, усваивают нитрат в процессе ассимиляционной нитратредукции. На первом этапе нитраты восстанавливаются до нитритов, цикл этих превращений катализирует специфический фермент — ассимиляционная нитратредуктаза В. Второй этап представляет комплекс восстановительных реакций, катализируемых нитритредуктазой, что приводит к образованию аммиака, который используется для синтеза аминокислот и других азотсодержащих компонентов клетки.
Диссимиляционные процессы. Выделение газообразных форм азота происходит при помощи нитрификации, диссимиляционной нитратредукции и аммонификации нитрата.
Нитрификация. Нитрифицирующие бактерии (Nitrobacter, Nitrococcus, Nitrosomonasи др.) окисляют соли аммония и нитриты до нитратов в процессе, называемом нитрификация.
Диссимиляционная нитратредукция (денитрификация). Ряд бактерий (Pseudomonas fluorescens, Bacillus licheniformis, Thiobacillus denitrificansи др.) ведёт восстановление нитратов и нитритов с образованием молекулярного азота в процессе диссимиляционной нитратредукции с участием фермента нитратредуктазы А.
Аммонификация нитрата. Бактерии кишечной группы способны выделять аммиак в процессе аммонификации нитрата, когда диссимиляционная нитратредуктаза А проводит только первый этап — восстанавливает нитрат до нитрита, а далее нитрит переходит в аммиак в процессе ассимиляции.
Выявление продуктов превращения исходных форм азота в среде культивирования может быть использовано для идентификации микроорганизмов. Например, денитрифицирующие бактерии выявляют на 5-6-е сутки культивирования по присутствию газа в поплавке (С02, N2) и отрица-тельной реакции на нитриты (используют реактив Грйсса) и нитраты (реакция с дифениламином). Использование органического азота
При утилизации азота из органических субстратов он включается в биомассу бактерий в виде аминогрупп. Минерализация органических соединений происходит с выделением аммиака — аммонификация органических соединений. Выделение аммиака в ходе этого процесса используют на практике для идентификации отдельных бактерий. Выделяющийся в атмосферу аммиак меняет цвет подвешенной над средой культивирования красной лакмусовой бумажки на синий. Накопление аммиака в среде определяют реактивом Нёсслера. Первая реакция характерна для многих гнилостных бактерий, вторая — для бактерий кишечной группы. Аммо-нификацию органических соединений можно рассматривать как промежуточный процесс между диссимиляцией (высвобождение аммиака) и ассимиляцией, поскольку часть органического азота при этом усваивают аммонифицирующие бактерии. Основной источник азота для аминогете- ротрофов — аминокислоты, менее значимы пурины и пиримидины. Потребность в азотсодержа-щих субстратах у бактерий варьирует.
Среди представителей рода Spirillumвид S. graniferumможет утилизировать азот мочевины, а S. annulus— нет.
Отдельные виды (например, Agrobacterium radiobacter) могут расти на среде, содержащей одну аминокислоту (в данном примере аспарагиновую), используя её как единственный источник углерода и азота. Другие способны расти лишь при наличии всех необходимых субстратов, используемых для биосинтеза белка (например, Agrobacterium rub і). Способность разлагать определённые аминокислоты (например, фенилаланин) применяют для идентификации различных бактерий.
Высокомолекулярные соединения не способны проходить через клеточную стенку бактерий, поэтому утилизировать белковый азот способны лишь бактерии, выделяющие экзоферменты (протеазы), расщепляющие белки до низкомолекулярных пептидов и аминокислот. Наиболее часто о протеолитической активности бактерий судят по способности гидролизовать (разжижать) желатину. При выращивании бактерий in vitroчасто в качестве источников азота используют пептоны — препараты неполного гидролиза белков. Лучше усваиваются пептоны со свободными аминокислотами и низкомолекулярными пептидами. Широкое распространение получили также белковые гидролизаты, не подкисляющие среду (в отличие от неорганических аммонийных солей) и удовлетворяющие потребность в аминокислотах у видов, неспособных к их синтезу.
Фосфор
В клетках бактерий фосфор присутствует в виде фосфатов (преимущественно фосфатов сахаров) в составе нуклеотидов и нуклеозидов. Фосфор также входит в состав фосфолипидов различных мембран. Фосфаты играют особую роль в энергетическом обмене, расщеплении углеводов и в мембранном транспорте. Ферментативный синтез ряда биополимеров может начаться только после образования фосфорных эфиров исходных соединений (то есть после их фосфо рилирования). Основной природный источник фосфора для бактерий — неорганические фосфаты и нуклеиновые кислоты. Они присутствуют в составе бульонов, в синтетические питательные среды их вносят дополнительно.
Сера
Сера входит в состав некоторых аминокислот (цистеин, метионин), витаминов (биотин, тиамин), пептидов (глутатион) и белков; участвует в синтетических процессах в восстановленном состоянии — в виде R-SH-групп, обладающих высокой реакционной способностью и легко дегидрирующих в R-S-S-R’-группы. Последние используются для образования более сложных соединений, соединённых дисульфидными (S—S) мостиками. Гидратирование этих соединений восстанавливает их и разрывает мостики. Подобные реакции имеют важное значение для регуляции окислительно-восстановительного потенциала в цитоплазме бактерий. Основной серосодержащий компонент бактериальной клетки — цистеин, в состав которого сера входит в виде тиоловой (—SH) группы. Так, сера в составе метионина, биотина, тиамина и глутатиона происходит из тиоловой группы цистеина. Хотя сера входит в состав аминокислот и белков в восстановленной форме, большинство бактерий утилизирует серу в форме сульфатов. Перевод окисленной серы из сульфат-иона в восстановленную форму в тиоловой группе известен как ассимиляционная сульфатредукция. У значительно меньшего числа бактерий (например, анаэробных бактерий рода Desulfovibrio)происходит диссимиляционная сульфатредукция, при которой сульфаты, сульфиты или тиосульфаты используются как терминальные акцепторы электронов. При этом образуется сероводород (H2S), как продукт восстановления. Способность бактерий выделять сероводород применяют на практике как дифференциально-диагностический признак. Отдельные группы бактерий (например, серобактерии родов Beggiatoa, Thiothrix) могут окислять сероводород и элементную серу до сульфатов.
Кислород
Кислород, входящий в состав органических веществ бактерий, включается в них двояким путём: опосредованно (из молекул воды либо из С02) и непосредственно. Специальные ферменты — оксигеназы — включают кислород (О2-) в органические соединения непосредственно из молекулярного кислорода (02). Оксигеназы необходимы для разложения многих веществ (например, ароматических углеводородов), трудно поддающихся действию других ферментов. Многие бактерии удовлетворяют свои энергетические потребности за счёт дыхания, в процессе которого кислород выступает в качестве терминального акцептора электронов и протонов в дыхательной цепи. В соответствии с потребностями в молекулярном кислороде бактерии разде-ляют на пять основных групп.
Облигатные (строгие) аэробы способны получать энергию только путём дыхания и поэтому обязательно нуждаются в молекулярном кислороде. К строгим аэробам относят, например, представителей рода Pseudomonas.
Облигатные (строгие) анаэробы. Рост таких бактерий может быть остановлен даже при низком р02 (например, при 10"sатм), поскольку у них отсутствуют ферменты, расщепляющие токсические соединения кислорода (каталазы, супероксид дисмутазы). К облигатным анаэробам относят роды Bacteroides, Desulfovibrio.
Факультативные анаэробы растут как в присутствии, так и в отсутствии 02. К факультативным анаэробам относят энтеробактерии и многие дрожжи, способные переключаться с дыхания в присутствии 02 на брожение в отсутствии 02.
Аэротолерантные бактерии способны расти в присутствии атмосферного кислорода, но не использовать его в качестве источника энергии. Энергию аэротолерантные бактерии получают исключительно с помощью брожения (например, молочнокислые бактерии).
Микроаэрофильные бактерии хотя и нуждаются в кислороде для получения энергии, луч-ше растут при повышенном содержании С02, поэтому они также известны как «капнофиль- ные микроорганизмы» [от греч. kapnos,дым, + philos,любовьі. К микроаэрофилам относят большинство аэробных бактерий (например, бактерии родов Campylobacters Helicobacter). Бактерии могут существовать в среде, содержащей кислород только при наличии толерант-ности к кислороду, которая связана со способностью бактериальных ферментов нейтрализо-вать токсичные соединения кислорода. В зависимости от количества электронов, одновременно переносимых на молекулу 02, образуются: ион пероксида О2- (образуется флавиновыми оксида- зами при переносе 2е_), супероксид-радикал (могут образовать ксантин оксидаза, альдегид ок- сидаза, НАДФН-оксидаза при переносе 1е“), и гидроксил-радикал (продукт реакции супероксид-радикала с перекисью водорода). В детоксикации реактивных кислородных радикалов уча-ствуют супероксид дисмутаза, пероксидаза и катал аза.
Супероксид дисмутаза конвертирует супероксид-радикал (наиболее токсичный метаболит) в Н202. Фермент присутствует в аэробных и аэротолерантных бактериях.
Каталаза превращает Н202 в Н20 и 02. Фермент имеется у всех аэробных бактерий, но отсутствует у аэротолерантных организмов. Строгие анаэробы обычно каталаза- и супероксид- дисмутаза- отрицательны.
Пероксидаза. Из всех каталаза-отрицательных микроорганизмов лишь молочнокислые бакте-рии способны расти в присутствии воздуха. Их аэротолерантность связана со способностью накапливать пероксидазу. Фермент нейтрализует Н202 в реакции с глутатионом; при этом перекись водорода превращается в воду.
Энергетический метаболизм бактерий
Метаболизм [от греч. metahole,изменение] — совокупность всех химических превращений, происходящих в клетках. Этот термин объединяет два процесса: катаболизм (диссимиляция, или энергетический метаболизм) и анаболизм (ассимиляция, или конструктивный метаболизм). Первый процесс включает расщепление различных субстратов для получения энергии, второй — синтез высокомолекулярных соединений, используемых для образования клеточных структур. Промежуточный обмен веществ, превращающий низкомолекулярные фрагменты питательных веществ в ряд органических кислот и фосфорных эфиров, называют амфиболизм. Различия в метаболизме у разных групп бактерий нередко используют в качестве фенотипических маркёров при идентификации микроорганизмов. На практике любая схема идентификации неизвестной бактерии включает исследование следующих параметров.
Способность к утилизации различных веществ в качестве источника углерода.
Способность к образованию специфических конечных продуктов в результате разложения субстратов.
Способность смещать pH среды культивирования в кислую или щелочную сторону. Метаболизм большинства бактерий осуществляется посредством биохимических реакций
разложения органических (реже неорганических) веществ и синтеза компонентов бактериаль-ной клетки из простых углеродсодержащих соединений. Для нормальной жизнедеятельности любому живому организму необходимы структурные фрагменты и энергия. Реакции, ведущие к синтезу различных компонентов бактериальных клеток (например, полимеризация аминокислот в белки), представляют собой эндэргонические процессы, то есть процессы, не протекающие самопроизвольно, поскольку изменение в них свободной энергии Гиббса (AG) положительно. Спонтанно в живой клетке могут происходить только экзэргонические реакции, сопро-вождающиеся снижением содержания в ней свободной энергии. Иными словами, для синтеза нового клеточного материала отдельные синтетические реакции должны быть сопряжены с реакциями, в результате которых высвобождается энергия, идущая на этот синтез.
Реакции, связанные с затратой энергии, реализуются через специальные макроэргические соединения. У бактерий таковыми являются нуклеозидтрифосфаты, ацилфосфаты и ацилтиоэфиры. Среди них наиболее важен АТФ, играющий роль своеобразной «разменной монеты» энергетического метаболизма. АТФ — термодинамически неустойчивая молекула и последовательно отщепляет фосфат с образованием аденозиндифосфата (АДФ) или аденозин- монофосфата (АМФ). Именно эта неустойчивость позволяет АТФ выполнять функцию переносчика химической энергии, необходимой для удовлетворения большей части энергетических потребностей клеток. Энергия каждой из двух этих фосфатных связей приблизительно равна 7,5 ккал, тогда как у обычных фосфатных связей она не превышает 2 ккал. Иными словами, для образования фосфатных связей АТФ требуется больше энергии, но и при их разрыве она выделяется в больших количествах. Другие макроэргические соединения бактериальных клеток: гуанозинтрифосфат (ГТФ), уридинтрифосфат (УТФ), цитидинтрифосфат (ЦТФ), дезокситими- динтрифосфат (дТТФ), ацетилфосфат, фосфоенолпируват, креатинфосфат, ацетилкоэнзим А (аце- тил-КоА). Долгое время считали, что единственный тип энергетической валюты — высокоэнергетические химические соединения, а среди них прежде всего АТФ, однако последние работы биоэнергетиков опровергли эту догму. Оказалось, что клетка располагает тремя типами энергетической валюты: наряду с АТФ такую роль выполняют протонный и натриевый потенциалы на биологических мембранах.
Синтез (регенерация) АТФ
Синтез АТФ осуществляется тремя способами: фотосинтетическое фосфорилирование, окислительное фосфорилирование (сопряжённое с транспортом электронов по дыхательной цепи) и субстратное фосфорилирование. В первых двух процессах преобразование поступившей с потоком электронов энергии в энергию фосфоэфирных связей АТФ осуществляет особый фермент — АТФ -синтетаза. Этот фермент присутствует во всех мембранах, участвующих в преобразовании энергии (мембраны бактерий, митохондрий и хлоропластові. АТФ-синтетаза катализирует присоединение неорганического фосфата (Фн) к АДФ, образование которого осуществляет аде- нилаткиназа (АМФ + АТФ = 2 АДФ). Активность АТФ-синтетазы можно обнаружить по обратной реакции гидролиза АТФ: АТФ + Н20 = АДФ + Фн + Н+. Благодаря обратимости реакции фосфорилирования, накопившийся АТФ может быть использован для создания протонного градиента, обеспечивающего энергией движение жгутиков и осмотическую работу. Энергия также направляется для обратного переноса электронов, необходимого для восстановления никотинамидадениндинуклеотида (НАД) при использовании бактериями неорганических доноров электронов (SO2-, N03, Fe2+и др.).
ПОЛУЧЕНИЕ ЭНЕРГИИ В ПРОЦЕССЕ ФОТОСИНТЕЗА. Основной источник энергии для жизни на Земле — Солнце, но непосредственно утилизировать энергию инсоляции в мире бактерий способны лишь немногочисленные бактерии-фототрофы [от греч. photos,свет, + trophe,питание]. Фотосинтезирующие бактерии, подобно растениям, превращают энергию видимого света в протонный потенциал на энергопреобразующей мембране. В последующем с помощью АТФ- синтетазы энергия консервируется в АТФ. Основной признак, отличающий фотосинтетические реакции у пурпурных и зелёных бактерий от таковых у растений и цианобактерий, — отсутствие выделения кислорода (так как в качестве донора электронов они используют не воду, a H2S или органические вещества). У бактерий аналог хлоропластов растительных клеток — хроматофоры, содержащие хлорофилл и каротиноидные пигменты. Таким образом, под фотосинтезом понимают происходящее в клетках фототрофных организмов преобразование световой энергии в биохимически доступную энергию (протонный градиент на мембране тилакоидов и хлоропластов, АТФ) и восстановительную силу НАДФН+, а также связанный с этим синтез клеточных компонентов. Реакции фотосинтеза протекают в две стадии (световая и темновая фазы).
Световая фаза. Под действием фотонов электрон хроматофора активируется, затем он возвращается в исходное состояние. При этом высвобождается энергия, используемая для создания протонного градиента, а затем синтеза АТФ и восстановления никотинамидадениндинук- леотидфосфата (НАДФ) до НАДФН+. Последнее может происходить за счёт обратного транспорта электронов с затратой АТФ.
Темновая фаза. Образовавшиеся макроэргические соединения используются для ассимиля-ционного восстановления С02 в глюкозу. Глюкоза содержит значительное количество энергии (около 690 ккал/моль), что и используют гетеротрофные бактерии, разлагая глюкозу и «запасая» энергию в универсальном хранителе — АТФ.
Получение энергии при окислении химических соединений.
Преобладающую часть бактерий составляют бактерии-хемотрофы, получающие энергию в результате окислительно-восстановительных реакций расщепления химических веществ, которые в ряде случаев служат для них также источником питания. Разные бактерии получают энергию либо в процессе брожения либо в процессе дыхания. При брожении АТФ образуется исключительно путём субстратного фосфори- лирования, а в процессе дыхания преимущественно путём окислительного фосфорилирования за исключением начальных этапов превращения гексоз в триозы (гликолиз, см. ниже).
Получение энергии субстратным фосфорилированием
Субстратное фосфорилирование может происходить при различных реакциях промежуточного метаболизма. При дегидрировании некоторых определённых субстратов часть энергии, освободившейся при окислении, сохраняется в форме высокоэнергетического фосфата. Богатая энергией фосфатная группа затем переносится на АДФ с образованием АТФ. Такой процесс называют фосфорилированием на уровне субстрата (субстратное фосфорилирование). В обмене углеводов важнейшие реакции, приводящие к регенерации АТФ, катализируют фосфоглицераткиназа (1,3-бифосфоглицерат + АДФ - 3-фосфоглицерат + АТФ), пируваткиназа(фосфоэнолпируват + АДФ = пируват + АТФ) и ацетаткиназа(ацетилфосфат или бутирилфосфат + АДФ = ацетат или бутират + АТФ).Бактерии и дрожжи, сбраживающие сахара, располагают лишь тем АТФ, который получается с помощью этих ферментов.
Брожение.При брожении происходит анаэробное разложение углеводов и образование АТФ посредством субстратного фосфорилирования. Брожение характерно для факультативных и облигатных анаэробов. При брожении продукты расщепления органического субстрата могут служить одновременно и донорами и акцепторами водорода. Отдельные этапы окисления представляют собой дегидрирование, при котором водород переносится на НАД. Акцепторами водорода в составе НАДН+ служат промежуточные продукты расщепления субстрата. Кислород подавляет брожение, и оно у факультативных анаэробов сменяется дыханием. По выходу энергии брожение уступает дыхательному метаболизму: при сбраживании микроорганизмами 1 моля глюкозы образуется от 1 до 4 молей АТФ. Для сравнения: у дрожжей на 1 моль сброженной глюкозы образуется 2 моля АТФ, а при дыхании — 38. При ферментации субстратов в среде накапливаются конечные продукты (лактат, бутират, ацетон, 2-пропанол, этанол, ацетоии и др.). Определение природы этих продуктов— важный момент для идентификация анаэробов. Например, образование ацетоина определяют в реакции Фогеса-Проскауэра, кислотообразова- ние — в тесте с метиловым красным, индолообразование — по методу Грациана. Применяют и другие тесты, разработанные для идентификации бактерий. Любое брожение проходит две стадии: первая (окисление) включает превращение глюкозы в пировиноградную кислоту, вторая (восстановление) — присоединение атомов водорода для восстановления пировиноградной кислоты (рис. 4-7). Сам процесс образования пировиноградной кислоты включает серию реакций, общих для брожения и аэробного дыхания. У микроорганизмов выделяют три пути образования триоз (пировиноградной кислоты и глицеральдегидфосфата) из углеводов: гликолитичес- кий (фруктозо-1,6-бифосфатный), пентозофосфатный и 2-кето-3-дезокси-6-фосфоглюконатный (КДФГ-путь, путь Энтнера-Дудорова-Парнаса). Согласно образующимся продуктам, брожение разделяют на следующие типы.
Спиртовое брожение включает превращение пирувата в С02 и этанол. В течение многих веков способность дрожжей (особенно Saccharomyces cerevmae)утилизировать глюкозу в анаэробных условиях с высоким выходом этанола и углекислоты применяют в пивоварении и виноделии. Аналогично дрожжам образует этанол Sarcina ventriculi.Бактерии кишечной группы, молочнокислые бактерии и клостридии образуют этанол в качестве побочного продукта сбраживания сахаров.
Гетероферментативное брожение (образуется смесь различных продуктов) характерно для бифидобактерий и молочнокислых бактерий, для рода Leuconostoc.Оно приводит к образованию молочной и уксусной кислот в ряде сходных процессов. Конечными продуктами могут быть дополнительно С02 и этанол, а при сбраживании фруктозы — маннитол. Муравьинокислое брожение. Этот тип брожения выделяют на том основании, что характерный, хотя и не главный продукт брожения — муравьиная кислота. Часто этот тип называют брожение смешанного типа, поскольку, кроме формиата, образуется ряд других органических кислот. Так, для большинства членов семейства Enterobacteriaceaeхарактерно выделение муравьиной и других кислот. Индивидуальные признаки брожения, осуществляемого кишечной палочкой, — расщепление пирувата с образованием ацетил-КоА и формиата, разложение формиата на углекислоту и молекулярный водород, восстановление ацетил-КоА до этанола, и, в отличие от Enterobacter aerogenes,отсутствие способности образовывать из пирувата ацетони и 2,3-бутандиол.
Пропионовокислое брожение. Пируват или лактат карбоксилируется до оксалоацетата, затем оксалоацетат преобразуется в пропионовую кислоту через метилмалонил-коэнзим А у большинства пропионовых бактерий и через акрилоил-коэнзим А у Clostridium propionicumи Bacteroides ruminicola.
Масляно-кислое и ацетонобутиловое брожение. Масляная кислота (бутират), бутанол, ацетон, 2-пропанол и ряд других органических кислот и спиртов — типичные продукты сбраживания углеводов анаэробными спорообразующими бактериями (клостридиями). Если споры С. histolyticumили С. septicumпопадают в открытую рану, где нет доступа воздуха, то они начинают расти, образуя дурно пахнущие продукты брожения.
Гомоацетатное брожение. Некоторые клостридии (С. formicoaceticum, С. acidi-urici) способны переносить водород, отщепляемый от субстрата, только на С02. При этом образуется исключительно ацетат.
Получение энергии окислительным фосфорилированием
У всех дышащих бактерий имеется система транспорта электронов (дыхательная цепь). К компонентам этой системы относят локализованные в мембране ферменты с относительно прочно связанными низкомолекулярными простетическими группами. У эукариотов такие ферменты локализуются на внутренней мембране митохондрий, у прокариотов — в плазматической мембране. Перенос электронов осуществляется по следующей стандартной схеме: органичес-кий субстрат -э НАД -* флавопротеины ¦* железосерные белки ¦* хиноны -* цитохромы (а, Ь, с) -* конечный акцептор (молекулярный кислород либо иной акцептор электронов). При движении
3-5819 электронов по дыхательной цепи создаётся градиент протонов, энергия которого запасается в виде АТФ в процессе окислительного фосфорилирования.В дыхательной цепи имеются только три точки окисления, в каждой из которых освобождается столько энергии, сколько содержится в одной высокоэнергетической связи АТФ. При переносе пары протонов от НАД* на кислород может образоваться 3 молекулы АТФ. При использовании в качестве субстрата сукцината, от которого водород включается в цепь только на уровне флавопротеинов, образуется 2молекулы АТФ. Фумаратное дыхание сопряжено с образованием 1 молекулы АТФ.
Наиболее часто бактерии получают энергию в результате окисления органических субстратов (чаще всего углеводов) до С02и Н20; иначе этот процесс известен как дыхание. Следуеі помнить, что дыханием следует считать окисление не только органических субстратов, так как бактерии могут окислять вещества, не подверженные ассимиляции, например сероводород или трёх валентное железо (так называемое «сероводородное дыхание», «железное дыхание»).
Если в реакциях окисления органических и неорганических веществ дегидрогеназами конечным акцептором электронов служит молекулярный кислород, то такой тип метаболизма называют аэробное дыхание. При этом молекулярный кислород переходит в ион О2-. Пары протонов, отщеплённые от органических субстратов, взаимодействуя с ионизированным кислородом при аэробном дыхании, образуют воду. Если терминальными акцепторами электронов выступают соединения, содержащие «связанный кислород» (нитраты, нитриты, сульфаты, карбонаты, а также способные к восстановлению элементная сера, трёхвалентное железо и органически! акцептор — фумарат), то такой тип метаболизма называют анаэробное дыхание. Аэробное дыхание — наиболее распространённый процесс получения энергии среди коммен салов и патогенных для человека бактерий.
Анаэробное дыхание осуществляют факультативно анаэробные бактерии и строгие анаэро бы. Многие факультативные анаэробы при отсутствии кислорода в качестве акцепторов элёкт ронов используют нитраты (процесс известен как нитратное дыхание). При этом образу ются характерные продукты восстановления — нитриты и другие восстановленные формы азота, что используют на практике для идентификации бактерий.
В зависимости от природы утилизируемого соединения выделяют бактерии-органотрофы использующие в качестве доноров водорода и электронов органические вещества, и бактерии литотрофы [от греч. tithos,камень, + trophe,питание], использующие в тех же целях неорга нические соединения (Н2, NH3, H2S, S, СО, двухвалентное железо и др.). Среди хемолитотроф ных бактерий имеющих медицинское значение видов не обнаружено. Обычно ограничивают указанием на основной способ получения энергии и природу донора водорода и электронов.
Кишечную палочку, таким образом, относят к хемоорганотрофам, так как она получает энер гию путём окисления химических соединений, используя в качестве донора водорода и элек тронов органические соединения.
Нитрифицирующие бактерии относят к хемолитотрофам, а растения, цианобактерии и пур пурные серобактерии — к фотолитотрофам.
Катаболизм углеводов
В качестве источника питания и энергии при выращивании в искусственных условиях бакте рии наиболее часто используют углеводы. Способность утилизировать различные углеводы - важный диагностический признак. Базовый субстрат — глюкоза, которую бактерии разла гают в процессе дыхания либо брожения.Многие реакции катаболизма глюкозы протекаю1 одинаково у аэробных и анаэробных бактерий, в частности три пути превращения гексоз і триозы (гликолиз, пентозофосфатный путь и путь Энтнера-Дудорова).
Пентозофосфатный путь включает не только образование пен- тозофосфатов, но и реакции превращения пентозофосфатов в триозо-3- фосфаты. В результате изомеризации фруктозо-6-фосфата в глюкозо-6-фосфат и конденсации двух молекул триозо-3-фосфата в гексозо- фосфат все перечисленные реакции замыкаются в цикл, при одном обороте которого из 3 молекул глюко- зо-6-фосфата образуются 2 молекулы фруктозо-6-фосфата, одна молекула триозо-3-фосфата, 3 молекулы С02 и трижды по 2 восстановленных ИАДФ (НАДФН+).Последовательность подобных превращений глюкозы у бактерий идентична тако-вой у высших организмов.
Иуть Энтнера-Дудорова
Путь Энтнера-Дудорова, или КДФГ-путь (назван по характерному образующемуся продукту — 2-кето-3-дезокси-6-фосфоглюконату), — сравнительно редкий тип метаболизма, наблюдаемый у ряда бактерий (Pseudomonas aeruginosa, Alcaligenes eutrophus)",у высших организмов он отсутствует (рис. 4-10). Этот путь — основной для расщепления гексоз у бактерий с дефицитом фосфофруктокиназы (например, у бактерий рода Pseudomonas).
Катаболизм азотсодержащих органических соединений
Доступные субстраты для получения углерода, азота и энергии — аминокислоты, пурины и пири- мидины. Как аэробные, так и анаэробные бактерии используют эти соединения для синтеза белка либо непосредственно, либо после ряда превращений и вовлечения в промежуточный обмен. Аминокислоты
Декарбоксилирование и дезаминирование. Первой реакцией катаболизма аминокислот может быть декарбоксилирование либо дезаминирование. Декарбоксилазы действуют обычно в кислой среде, образуя С02 и первичные амины (так называемые биогенные амины, трупные яды — кадаверин, путресцин, агматин). Поскольку при этом высвобождаются основные группы (амины), то такой процесс рассматривают как механизм нейтрализации среды и сохранения pH в физиологических пределах.
Дезаминирование аминокислот идёт с выделением аммиака. В зависимости от судьбы углеродного скелета различают дезаминирование окислительное(наиболее распространённое, например, превращение глутаминовой кислоты в 2-оксоглутаровую), гидролитическое и приводящее к образованию ненасыщенных соединений.Ферменты, катализирующие эти реакции, обычно специфичны для D- и L-изомеров аминокислот. Углеродные фрагменты, не содержащие азота, используются в процессах брожения или дыхания. Если в состав аминокислот входит сера, то последняя обычно высвобождается в форме сероводорода или меркаптанов. Разложение ароматических аминокислот (например, триптофана) происходит с образованием индола и скатола. У некоторых микроорганизмов в качестве источников энергии могут использоваться лишь некоторые продукты дезаминирования. Например, эшерихии и протеи дезаминируют триптофан с образованием индола и пирувата, из которых лишь последний утилизируется как источник энергии. Поскольку индол накапливается в культуре, то его наличие легко обнаруживают с помощью реактива Эрлиха(смесь n-диметиламинобензальдегида и НС1 в этаноле), что используют для идентификации бактерий на практике.
Некоторые бактерии обладают специальными механизмами получения энергии при расщеплении аминокислот. Например, аргинин расщепляет аргининдегидролазная система, состоящая из нескольких ферментов. Первоначально аргининдезаминаза катализирует его превращение в цитрул- лин, затем последний превращается в орнитин через реакцию, сопряжённую с синтезом АТФ.
На средах, содержащих смесь аминокислот, многие клостридии получают большую часть энергии не из отдельных компонентов, а путём сопряжения окислительно-восстановительных реакций между парами подходящих аминокислот, известного как механизм Стйклэнда. С этих позиций аминокислоты можно разделить на акцепторы (глицин, орнитин, пролин) и доноры водорода (аланин, изолейцин и валин). Первоначально донор окисляется до кетокислоты, затем «доокисляется» до жирной кислоты. Образующийся при этом НАДЬГ утилизируется для восстановления другой аминокислоты — акцептора (или, реже, другого азотистого соединения). Переаминирование. Кроме реакций дезаминирования и декарбоксилирования, аминокислоты могут подвергаться переаминированию, то есть переносу целой аминогруппы от аминокислоты к а-кетокислотам без промежуточного образования аммиака. Участвующая в переамини- ровании аминокислота (донор аминогруппы) превращается в а-кетокислоту (продукт окислительного дезаминирования), а а-кетокислота (акцептор) подвергается восстановительному аминированию. Реакции катализируют специфические трансферази. В реакциях переаминиро- вания участвуют все L-аминокислоты, при этом на а-кетокислоты переносятся аминогруппы не только в a-положении, но и в других положениях.
Пурины и пиримИДИНЫ
Пурины и пиримидины становятся доступными для энергетического метаболизма лишь после гидролиза нуклеотидов и нуклеозидов. В результате их разложения образуются углекислота, аммиак, муравьиная, уксусная и молочная кислоты, часть из которых включается в рассмотренные выше энергетические пути.
Катаболизм жиров и жирных кислот
Жиры (сложные эфиры глицерина и жирных кислот) и воска (сложные эфиры жирных кислот и одноатомных спиртов) — восстановленные субстраты и доступны бактериям в качестве источников энергии. Первоначально эфиры жирных кислот гидролизуются до глицерина или одноатомного спирта и свободных жирных кислот (гидролиз катализируют внутри- и внеклеточные липазы). После фосфорилирования глицерин может включаться в гликолитический путь и‘ утилизироваться с образованием АТФ. Жирные кислоты метаболизируются через каскад окислительных реакций. Цель этих превращений — образование ацетил-КоА, вступающего в цикл Кребса.
Эндогенный энергетический метаболизм
Большинство бактерий способно длительно выживать При отсутствии экзогенных ИСТОЧНИ- I ков энергии. При этом бактерии нередко проявляют признаки активного метаболизма (например, сохраняют подвижность). Это связано со способностью бактерий продуцировать энергию окислением внутриклеточных компонентов. Основные внутриклеточные эндогенные источники энергии — ЛПС, липиды и поли-р-масляная кислота. Они расщепляются деполимеризующими ферментами до мономеров, которые включаются в вышеперечисленные пути. Эффективность подобных превращений может быть выше традиционных. Например, при гликолизе внутриклеточного крахмала или гликогена на 1 моль глюкозы образуется 3 моля АТФ, а не 2, как при простом включении глюкозы в этот путь. Это объясняется тем, что в результате расщепления крахмала с помощью а-1,4-глюканфосфорилазы (фосфоролиза) образуется глюкозо-1-фосфат, превращающийся в глюкозо-6-фосфат ещё до вступления в путь Эмбдена-Мейерхофа-Парнаса. Следовательно, АТФ не затрачивается на его образование, и, значит, общий выход АТФ выше.
Конструктивный метаболизм
Совокупность биосинтетических реакций включения низкомолекулярных соединений в клеточные полимеры составляет суть конструктивного метаболизма. Комплекс этих реакций иногда называют пластическим обменом.
Углеродные соединения для биосинтетических реакций
Для биосинтеза клеточных компонентов необходимы соответствующие низкомолекулярные соединения-предшественники (например, сахара или аминокислоты). При наличии таких предшественников в окружающей среде они непосредственно вовлекаются в различные биосинтетические пути. Однако гораздо чаще бактериям приходится предварительно синтезировать большую часть молекул-предшественников из доступных исходных продуктов. Огромное разнообразие субстратов, которые бактерии могут использовать в качестве источников питания, вытекает из широкого спектра их метаболических возможностей. Исходные продукты для биосинтеза образуются в ходе различных путей катаболизма, включая гликолиз, КДФГ-путь, пентозофос- фатный путь, окисление пирувата и ЦТК. Например, углеродные фрагменты из ЦТК — сукцинил-КоА и ацетил-КоА — используются соответственно для образования тетрапирролов и жирных кислот. Следует помнить, что подобное «изъятие» интермедиатов из ЦТК возможно лишь при постоянном восполнении их дефицита.
Биосинтез аминокислот и белков
Аминокислоты. Большинство свободно живущих бактерий способно синтезировать все необходимые им аминокислоты. Теоретически все 20 необходимых аминокислот могут находиться в окружающей среде и быть доступными для утилизации. Кроме того, бактерии способны получать аминокислоты из белковых молекул, расщепляя их бактериальными протеазами и пептидазами. Образующиеся при этом олигопептиды и аминокислоты транспортируются в клетку, где включаются в биосинтетические пути либо расщепляются на низкомолекулярные продукты. Паразитические бактерии потребляют готовые аминокислоты из организма хозяина. Бактериям, культивируемым на питательных средах, содержащих только неорганические источники азота или ограниченное количество аминокислот, приходится синтезировать некоторые из них (или даже все) из доступных азотсодержащих соединений. Основное назначение источников азота — поступление в бактериальную клетку «сырья» для формирования аминных (NH2) и иминных (NH) групп в молекулах аминокислот, нуклеотидов, гетероциклических оснований и других химических компонентов. При этом азотсодержащие вещества, помимо сырья для пластического обмена, могут включаться в энергетический метаболизм (например, у анаэробов некоторые аминокислоты могут образовывать окислительно-восстановительные системы). Наиболее доступные минеральные источники азота в природе — аммонийный ион (NHj) и аммиак (NH3), легко проникающие в клетки и просто трансформирующиеся в амино- и иминогруппы, Основные исходные соединения для синтеза аминокислот — пируват (образуется в гликоли- тическом цикле), а-кетоглутарат и фумарат (образуются в ЦТК). При синтезе молекул аминокислот атом азота вводится на последних этапах биосинтеза путём переаминирования; лишь L-аланин, L-глутамат и аспартат образуются через прямое аминирование.
Пептиды и белки. Бактериальная клетка способна синтезировать несколько тысяч различных белков, каждый из которых содержит в среднем 200 аминокислотных остатков. Информация, направляющая синтез этих белков, закодирована в последовательности нуклеотидов ДНК. Синтез полипептидной цепи происходит в цитоплазме клетки на рибонуклеопротеидных частицах (рибосомах) в сочетании с молекулой мРНК или информационной РНК (иРНК), которая синтезируется на матрице ДНК в процессе транскрипции. Бактериальная рибосома обладает массой 2,7106Д и состоит на 65% из рибосомной РНК (рРНК) и на 35% из белка (примерно 50 различных белков). Информация, содержащаяся в молекулах мРНК, транслируется в поли- пептидную цепь при участии особого класса молекул РНК, известных как тРНК. Многофункцио-нальность тРНК позволяет им присоединяться к определённым аминокислотам, связываться с рибосомой и узнавать определённые последовательности из трёх нуклеотидов (кодон) в составе мРНК. Узнаваемый кодон соответствует конкретной аминокислоте; нужная аминокислота «подаётся» при помощи узнающей её молекулы тРНК к концу растущей полипептидной цепочки. Так растёт будущая молекула белка.
Биосинтез нуклеотидов и нуклеиновых кислот
Пуриновые и пиримидиновые нуклеотиды. Образование пуриновых и пиримидиновых нуклеотидов de novoиз низкомолекулярных соединений происходит независимыми друг от друга путями. Источник рибозилфосфатной части всех нуклеотидов— 5-фосфорибозил-1-пирофосфат — образуется после взаимодействия рибозо-5-фосфата с АТФ. Дезоксирибонуклеотиды образуются путём восстановления соответствующих рибонуклеотидов.
Пуриновые нуклеотиды построены на основе фосфорибозилпирофосфата, с которого и начинается путь их синтеза. Девятичленное пуриновое кольцо синтезируется последователь-ным присоединением аминогрупп и мелких углеродсодержащих групп, причём все интермедиаты биосинтеза— рибонуклеотиды.
Пиримидиновые нуклеотиды формируются в серии последовательных превращений карбоксилсодержащих интермедиатов, начиная с карбамоилфосфата. Рибозофосфатный остаток присоединяется только после того, как шести членное пиримидиновое кольцо полностью синтезировано конденсацией аспарагиновой кислоты и карбамоилфосфата.
Нуклеиновые кислоты. Большинство синтезируемых нуклеотидов полимеризуется в РНК и ДНК, небольшая часть используется для синтеза коферментов и богатых энергией соединений. Основная часть бактериальной ДНК находится в виде двухцепочечной кольцевой молекулы — бактериальной хромосомы. Б процессе репликации хромосома с высокой точностью удваивается, обеспечивая передачу информации потомкам и давая им возможность синтезировать те же самые белки, что и родительская клетка. Синтез ДНК из субстратов-мономеров, четырёх дезоксинуклеозидтрифосфатов (дАТФ, дГТФ, дЦТФ и дТТФ), катализируют ДНК-полимеразы. При этом на каждой одиночной цепи ДНК происходит синтез новой комплементарной цепи: ДНК-полимеразы встраивают нуклеотиды в соответствии с правилами водородного связывания (Гуанин против Цитозина, Аденин против Тимина). Процесс удвоения клеточной ДНК называют репликацией. Если цепь ДНК служит матрицей, на которой полимеризуется цепь РНК (мРНК), то этот процесс называют транскрипцией.
Биосинтез олиго и полисахаридов
На дрлю внутриклеточных олиго- и полисахаридов может приходится до 60% сухой массы бактериальной клетки, тогда как количество синтезируемых внеклеточных полисахаридов может во много раз превышать массу бактерии. При отсутствии сахаров в окружающей среде бактерии синтезируют их из доступных источников углерода. Например, бактерии, растущие на средах, содержащих трёхуглеродные соединения, синтезируют гексозофосфаты из пирувата с помощью реакций, характерных для фруктозодифосфатного пути. Бактериальные олиго- и полисахариды образуются путём присоединения к акцепторным молекулам остатков сахаров из нук- леозиддифосфосахаров. Например, трегалоза, содержащая два остатка глюкозы, соединённых а-1,4-связями, образуется из уридиндифосфатглюкозы и глкжозо-6-фосфата. Характерная особенность синтеза полисахаридов, как и в случае синтеза ДНК, — необходимость затравки — короткого фрагмента того же полисахарида, который будет синтезироваться; он служит акцептором новых мономерных фрагментов.
Биосинтез липидов
Липиды — гетерогенный класс клеточных компонентов, выделенный на основании их растворимости в неполярных растворителях (эфир, бензол, хлороформ) и нерастворимости в воде. К ним относят жиры, фосфолипиды, стероиды, изопреноиды и поли-р-оксибутират. Липиды подразделяют на два большие класса: липиды, содержащие жирные кислоты, связанные эфирной связью (например, поли-р-оксимасляная кислота, гликолипидный компонент мембраны цианобактерий, ЛПС клеточной стенки), и липиды, состоящие из повторяющихся пятиуглеродных изопреновых фрагментов (например, бактопренол, к которому прикрепляются составляющие компоненты клеточной стенки во время её синтеза). Липиды с изопреновыми единицами содержат хлорофиллы и хиноны. Жирные кислоты синтезируются отдельно, а затем с помощью эфирной связи включаются в липиды. Число типов жирных кислот у каждого вида бактерий строго определено. У прокариот преимущественно встречают насыщенные жирные кислоты, образование которых начинается с переноса ацетильной группы с ацетил-КоА на особый ацил- переносящий белок. Этот комплекс служит акцептором, к которому последовательно присоединяются двух угле родные фрагменты, пока не будет достигнута длина, характерная для соединения, присущего данной бактерии (обычно C14-C|g). Для удобства понимания конструктивный и энергетический обмены были рассмотрены выше по отдельности. Однако разграничить процессы получения энергии и процессы, связанные с конструктивным метаболизмом, крайне сложно, так как они тесно взаимосвязаны. Особенно трудно произвести это разделение в том случае, когда одно и то же вещество потребляется и для построения клетки и как энергетический субстрат. Связующие звенья процессов распада и биосинтеза — продукты неполного окисления — ценны для бактерий не только в плане последующего выделения энергии, но и как строительный материал. Поэтому иногда даже не возникает необходимость в глубоком окислении субстрата для получения возможно большего количества энергии. Бактериальная клетка всегда поддерживает гибкий (в зависимости от условий внешней среды) баланс между реакциями катаболизма и анаболизма.
Метаболизм бактерий с различным типом питания
У гетеротрофных бактерий существует два направления использования углерода: часть его входит в состав конечных продуктов катаболизма, а часть — в строительные блоки биосинтетических путей. У аутотрофных микроорганизмов углерод включается только в реакции биосинтеза,образуя различные интермедиаты в результате тех же последовательностей реакций, которые у гетеротрофов приводят к образованию АТФ, но только в обратном направлении. Подтверждение этого принципа можно найти в метаболических путях различных аутотрофных микроорганизмов.
Облигатные хемо- и фотоаутотрофы используют ряд реакций ЦТК. Поскольку эти бактерии неспособны окислять органические соединения, ЦТК у них не играет никакой роли в образовании АТФ. Однако они синтезируют все ферменты ЦТК, кроме а-кетоглутарат дегидрогеназы. Отсутствие этого фермента нарушает цикличность системы, но не влияет на её биосинтетические функции — образование а-кетоглутаровой, янтарной и щавелевоуксусной кислот.
У кишечной палочки, растущей при избытке сахаров за счёт брожения, ЦТК функционирует так же, как у аутотрофов, но цикл нарушен между а-кетоглутаровой и янтарной кислотами. При аэробном же окислении органических соединений индуцируется синтез а-кетоглутарат дегидрогеназы, и цикл функционирует также и в качестве АТФ-образующей системы. Таким образом, при аэробном росте цикл выполняет одновременно дыхательную и биосинтетическую функции.
Пировиноградная кислота как ключевой метаболит
Превращение глюкозы в пировиноградную кислоту, катализируемое ферментами гликолиза, — основной этап катаболизма углеводов в клетках аэробных и анаэробных микроорганизмов. Обратный процесс — превращение пировиноградной кислоты в глюкозу — центральный путь биосинтеза моно- и полисахаридов. Таким образом, пировиноградная кислота занимает центральное место в обмене веществ у бактерий и в равной степени служит целям ассимиляции и диссимиляции. Особую ценность имеет свойство пирувата постепенно высвобождать энергию в ходе последовательных реакций катаболизма. При этом пировиноградная кислота служит энергетическим субстратом не только при распаде углеводов, но и белков, так как окислительное дезаминирование аминокислот приводит к образованию кетокислот, а также пирувата. В пластическом обмене пируват служит источником синтеза углеводов, белков, жиров и др. Таким образом, пировиноградная кислота или любое соединение, превращение которого ведёт к образованию пирувата, может быть единственным органическим веществом, обусловливающим рост и развитие разнообразных бактерий.
Активированные формы метаболических интермедиатов
АТФ может служить донором фосфатной группы для множества промежуточных продуктов обмена (интермедиатов), переводя их в активированную форму. Стандартная свободная энергия (AG) интермедиатов при этом повышается настолько, что позволяет им в фосфорилированной форме участвовать в термодинамически выгодных процессах (-AG). В то же время подобная реакция с участием нефосфорилированной формы реагирующего вещества была бы термодинамически невыгодной (+ДО). Фосфорилирование гексоз— первый этап как в процессах синтеза полимерных углеводов, так и при катабояическом разложении сахаров.Таким образом, перед фосфорилированным углеводом всегда стоят две взаимоисключающие возможности — быть трансформированным в компонент цитоплазмы (полисахарид), либо быть разложенным на более простые вещества. Эта равнонаправленная потенция ключевых интермедиатов в фосфорилированной форме предоставляет клетке ещё одну возможность сбалансированной регуляции путей катаболизма и биосинтеза.
Регуляция метаболизма
Метаболизм микроорганизмов прежде всего регулируется факторами внешней среды. Так, кислород подавляет брожение; у денитрифицирующих бактерий нитратное дыхание может начаться лишь при недостатке кислорода; изменение pH в культурах Enterobacterи Clostridium влияет на природу образующихся продуктов брожения и прочее. Многообразие обменных процессов требует их хорошей координации. Только в этом случае клетка может приспосабливаться к меняющимся условиям внешней среды и оптимально согласовывать между собой различные метаболические процессы. Объектами такой оптимизации выступают ферменты. Регуляция клеточного метаболизма происходит на двух уровнях — на уровне синтеза ферментов и на уровне изменения их активности.
Существует два класса аллостерических белков: аллостерические ферментыи регуляторные аллостерические белки.Последние лишены каталитической активности и регулируют синтез определённых ферментов путём присоединения к бактериальной хромосоме вблизи соответствующих генов, активность которых находится под контролем этих белков. Связывание регуляторных аллостерических белков с молекулами-эффекторами приводит к изменению скорости синтеза мРНК, кодируемых этими генами (регуляция на уровне синтеза ферментов). Регуляция на уровне изменения активности свойственна, как правило, только ключевым ферментам клеточного метаболизма, которые обычно образуются вне зависимости от условий среды.
4. Генетика бактерий
4.1 мигрирующие генетические элементы
В наши дни приоритетным направлением естествознания можно считать молекулярную биологию. Она тесно связана с микробиологией и в известном смысле является её детищем, так как в качестве основных моделей использует бактерии и вирусы, а одно из основных направлений молекулярной биологии — молекулярная генетика — долгое время являлась не чем иным, как генетикой бактерий и бактериофагов. Изучение генетики бактерий имеет также и несомненный прикладной интерес, например в плане установления механизмов передачи патогенных свойств и устойчивости к лекарственным препаратам. Бактерии — удобная модель для генетических исследований. Их отличает: относительная простота строения генома, позволяющая выявлять мутанты с частотой 10~9 и ниже; гаплоидность, исключающая явление доминантности; половая дифференциация в виде донорских и реципиентыых клеток; наличие обособленных, и интегрированных фрагментов ДНК (плазмид, транспозонов и т.д.); лёгкость культивирования и возможность получения популяций, содержащих миллиарды микробных тел.
Как и у других организмов, совокупность генов бактериальной клетки — геном — определяет её свойства и признаки (генотип). Фенотип бактериальной клетки — результат взаимодействий между бактерией и окружающей средой — также контролирует геном (так как сами признаки закодированы в бактериальных генах).
Генетический материал бактерий
Ядерные структуры бактерий имеют характерное строение, отличающее их от ядер эукариотических клеток; их образуют так называемые хромати новые тельца, или нуклеоиды, лишённые оболочки и включающие в себя почти всю ДНК бактерии.
Ядерные структуры можно наблюдать в фазово-контрастный микроскоп, где они выглядят как менее плотные участки цитоплазмы. Для их выявления в фиксированных мазках предложена реакция Фёльгена-Россенбёка.
В растущих бактериальных клетках нуклеоиды активно делятся, их количество иногда достигает 2-4.
Прокариотический геном
У бактерий обычно имеется одна замкнутая кольцевидная хромосома, содержащая до 4000 отдельных генов, необходимых для поддержания жизнедеятельности и размножения бактерий, то есть бактериальная клетка гаплоидна, а удвоение хромосомы обычно сопровождается её делением.
Некоторые виды (например, Brucella melitensis)стабильно содержат две кольцевые хромосомы, другие (Leptospira interrogans)— одну кольцевую хромосому и одну большую плазмиду, третьи — одну линейную хромосому [Streptomyces ambofaciens), то есть обладают сложными геномами.
Бактериальная хромосома содержит до 5"106пар оснований. Для сравнения: геном человека составляет 2,9409пар оснований. Длина бактериальной хромосомы в развёрнутом состоянии составляет около 1 мм (Escherichia coli).
Некоторые бактерии содержат внехромосомные молекулы ДНК (плазмиды) и мобильные элементы (либо плазмидные, либо хромосомные).
Внехромосомные факторы наследственности
Внехромосомные факторы наследственности бактерий представлены плазмидами, вставочными последовательностями и транспозонами. Все они образованы молекулами ДНК, различающимися между собой по молекулярной массе, кодирующей ёмкости, способности к автономному реплицированию и др.
Плазмиды
Плазмиды— фрагменты ДНК с молекулярной массой порядка 10e-108D, несущие от 40 до БОгенов. Выделяют автономные (не связанные с хромосомой бактерии) и интегрированные (встроенные в хромосому) плазмиды.
Автономные плазмиды существуют в цитоплазме бактерий и способны самостоятельно репродуцироваться; в клетке может присутствовать несколько их копий.
Интегрированные плазмиды репродуцируются одновременно с бактериальной хромосомой. Интеграция плазмид происходит при наличии гомологичных последовательностей ДНК, при которых возможна рекомбинация хромосомной и плазмидной ДНК (что сближает их с профагами).
Плазмиды также подразделяют на трансмиссивные (например, F- или R-плазмиды), способные передаваться посредством конъюгации, и нетрансмиссивные.
Плазмиды выполняют регуляторные или кодирующие функции.
Регуляторные плазмиды участвуют в компенсировании тех или иных дефектов метаболизма бактериальной клетки посредством встраивания в повреждённый геном и восстановления его функций.
Кодирующие плазмиды привносят в бактериальную клетку новую генетическую информацию, кодирующую новые, необычные свойства (например, устойчивость к антибиотикам).
В соответствии с определёнными признаками, кодируемыми плазмидными генами, выделяют следующие группы плазмид.
F-плазмиды. При изучении процесса скрещивания бактерий оказалось, что способность клетки быть донором генетического материала связана с присутствием особого F-фактора [от англ. fertility,плодовитость]. F-плазмиды контролируют синтез F-пилей, способствующих спариванию бактерий-доноров (F+) с бактериями-реципиентами (F ). В связи с этим можно указать, что сам термин «плазмида» был предложен для обозначения «полового» фактора бактерий (Джошуа Лёдерберг, 1952). F-плазмиды могут быть автономными и интегрированными. Встроенная в хромосому F-плазмида обеспечивает высокую частоту рекомбинации бактерий данного типа, поэтому их также обозначают как Hfr-плазмиды 1от англ. high frequency of recombinations, высокая частота рекомбинаций].
R-плазмиды [от англ. resistance, устойчивость] кодируют устойчивость к лекарственным препаратам (например, к антибиотикам и сульфаниламидам, хотя некоторые детерминанты устойчивости правильнее рассматривать как связанные с транспозонами [см. ниже]), а также к тяжёлым металлам. R-плазмиды включают все гены, ответственные за перенос факто-ров устойчивости из клетки в клетку.
Неконъюгативные плазмиды обычно характерны для грамположительных кокков, но встречаются также у некоторых грамотрицательных микроорганизмов (например, у Haemophilus influenzae, Neisseria gonorrhoeae).Они обычно имеют небольшие размеры (молекулярная масса примерно 1 —10" 106D). Обнаруживают большое количество мелких плазмид (более 30 на клетку), так как только наличие такого количества обеспечивает их распределение в потомстве при клеточном делении. Неконъюгативные плазмиды могут быть также перенесены из клетки в клетку при наличии в бактерии одновременно конъюгативных и неконъюгативных плазмид. При конъюгации донор может передать и неконъюгативные плазмиды за счёт связывания генетического материала последних с конъюгативной плазмидой.
Плазмиды бактериоциногении кодируют синтез бактериоцинов — белковых продуктов, вызывающих гибель бактерий того же или близких видов. Многие плазмиды, кодирующие образование бактериоцинов, также содержат набор генов, ответственных за конъюгацию и перенос плазмид. Подобные плазмиды относительно крупные (молекулярная масса 25-150-106D), их довольно часто выявляют у грамотрицательных палочек. Большие плазмиды обычно присутствуют в количестве 1~2 копий на клетку. Их репликация тесно связана с репликацией бактериальной хромосомы.
Плазмиды патогенности контролируют вирулентные свойства многих видов, особенно энтеробактерий. В частности F-, R-плазмиды и плазмиды бактериоциногении включают tax:+- транспозоны (мигрирующий генетический элемент, см. ниже), кодирующие токсинообразова- ние. Нередко /0Х+-транспозоны кодируют синтез интактных протоксинов (например, дифтерий- ного или ботулинического), активируемых клеточными протеазами, образование которых контролируют гены бактериальных хромосом.
Скрытые плазмиды. Криптические (скрытые) плазмиды не содержат генов, которые можно было бы обнаружить по их фенотипическому проявлению.
Плазмиды биодеградации. Обнаружен также ряд плазмид, кодирующих ферменты деградации природных (мочевина, углеводы) и неприродных (толуол, камфора, нафталин) соединений, необходимых для использования в качестве источников углерода или энергии, что обеспечивает им селективные преимущества перед другими бактериями данного вида. Патогенным бактериям подобные плазмиды придают преимущества перед представителями аутомикрофлоры.
Мигрирующие генетические элементы
Мигрирующие генетические элементы — отдельные участки ДНК, способные осуществлять собственный перенос (транспозицию) внутри генома. Транспозиция связана со способностью мигрирующих элементов кодировать специфический фермент рекомбинации — транспозазу.
Вставочные (инсерционные) последовательности [IS-элементы (англ. insertion,вставка, + sequence,последовательность)] — простейший тип мигрирующих элементов ; их величина не превышает 1500 пар оснований (в среднем 800-1400). IS-элементы самостоя-тельно не реплицируются и не кодируют распознаваемых фенотипических признаков. Содержащиеся в них гены обеспечивают только их перемещение из одного участка в другой.Основные функции IS-последовательностей — регуляция активности генов бактериальной клетки (могут инактивировать гены, в которые включились, или, встраиваясь в хромосому, проявлять эффект промотора, включающего либо выключающего транскрипцию соответствующих генов), индукция мутаций типа делеций или инверсий (при перемещении) и дупликаций (при встраивании в хромосому), координация взаимодействий плазмид, траспозонов и профагов (как между собой, так и бактериальной хромосомой).
Транспозоны (Tn-элементы) состоят из 2000-25 000 пар нуклеотидов, содержат фрагмент ДНК, несущий специфические гены, и два концевых IS-элемента. При включе-нии в ДНК бактерий транспозоны вызывают дупликации, при выходе из определённого участка ДНК — делеции, при выходе и включении обратно с поворотом фрагмента на 180° — инверсии. Транспозоны не способны к самостоятельной репликации и размножаются только в составе бактериальной хромосомы. Каждый транспозон обычно содержит гены, привносящие важные для бактерии характеристики типа множественной устойчивости к антибактериальным агентам. Поскольку транспозоны содержат гены, определяющие фенотипически выраженные признаки (например, устойчивость к антибиотикам), то их легче обнаружить, чем IS-элементы. В общем, для транспозонов характерны те же гены, что и для плазмид (гены устойчивости к антибиотикам, токсинообразования, дополнительных ферментов метаболизма).
4.2. Типы мутаций
Термин «мутация» предложил де Фриз как понятие «скачкообразного изменения наследственного признака» при изучении наследственности у растений. Позднее Бёйеринк распространил это понятие и на бактерии. Мутация — изменение первичной структуры ДНК, проявляющееся наследственно закреплённой утратой или изменением какого-либо признака или группы признаков. Мутации подразделяют по происхождению, характеру изменений структуры ДНК, фенотипическим последствиям для клетки-мутанта и др. Факторы, вызывающие мутации, известны как мутагены. Они обычно имеют физическую или химическую природу. По происхождению выделяют мутации индуцированные, то есть вызванные искусственно, и спонтанные («дикие», возникают в популяции бактерий без видимого вмешательства извне).
Спонтанные мутации
К появлению спонтанных мутаций приводят ошибки репликации, неправильное формирование комплементарных пар оснований или структурные искажения ДНК под действием естественный мутагенов. Спонтанные мутации могут вызывать благоприятные и неблагоприятные генетические изменения. Примерный уровень спонтанного мутирования — одна мутация на каждые 106-107 клеток. Численная доля мутантов в клеточной популяции для разных признаков различна и может варьировать от 10"4 до 10~п. Для конкретного гена частота мутирования составляет величину порядка 10“&, а для определённой пары нуклеотидов 10~8. Например, если на среду с антибиотиком посеять миллион бактерий, можно ожидать, что в результате спонтанной мутации одна колония выживет. Несмотря на то что уровень мутаций в популяции бактерий для отдельных клеток кажется незначительным, нужно помнить, что популяция бактерий огромна, и они размножается быстро. Следовательно, уровень мутаций с точки зрения целой популяции довольно значителен. Кроме того, появившиеся спонтанно и устойчивые к действию какого-либо антибиотика мутанты имеют при размножении преимущество по сравнению с «диким» типом бактерий и быстро образуют устойчивую популяцию.
Обратные мутации {реверсии) возвращают спонтанно мутировавшую клетку к исходному генетическому состоянию. Их наблюдают с частотой одна клетка на 107—10е (то есть по меньшей мере в 10 раз реже, чем прямые спонтанные мутации).
Индуцированные мутации
Химический мутагенез. Некоторые химические вещества (мутагены) значительно повышают частоту мутирования до одной мутантной клетки на 103-104клеток. К таким веществам относят аналоги азотистых оснований (например, бромурацил), включающиеся в молекулу ДНК и вызывающие вставку некорректного основания при репликации (в частности, бромурацил аналогичен по структуре тимину, он включается в ДНК как партнёр аденина, а затем переходит в энольную форму и узнаётся полимеразой как цитозин, что приводит к включению гуанина вместо аденина); алкилирующие агенты (например, этилметансульфонат алкилиру- ет преимущественно атом азота гуанина); азотистая кислота, дезаминирующая азотистые основания; интеркалирующие агенты {например, акридиновые красители), внедряющиеся между основаниями ДНК и вызывающие увеличение расстояния между ними, что приводит к утрате нуклеотидов, включению дополнительной пары нуклеотидов и др.
Радиационный мутагенез обычно приводит к образованию пиримидиновых димеров. УФ-, рентгеновские лучи и другие виды ионизирующего излучения оказывают на микроорганизмы как летальное (подавляющее жизнедеятельность), так и мутагенное воздействие.
Мутации могут индуцировать следующие события: модификации оснований (изменения отдельных нуклеотидов), вставки (включение дополнительных оснований), делении (потеря одного основания или группы оснований) и деформации спирали ДНК.
Модификация оснований включает химическое изменение азотистого основания в кодирующей последовательности, что приводит к изменению кодона. В результате вместо одной аминокислоты кодируется другая либо возникает бессмысленный кодон.
Вставка либо делеция какого-либо основания (аналогов оснований) в ДНК приводит к фреймшифт-мутациям (мутации со сдвигом рамки считывания), что вызывает изменение позиции рамки считывания триплетного кодона, и, таким образом, изменение всех последующих кодонов.
Деформации спирали ДНК (структурные искажения ДНК) образуются в результате индуцированной УФ-излучением димеризации расположенных близко нуклеотидов (особенно ти- мина). Образовавшееся циклобутановое кольцо нарушает симметрию ДНК и препятствует правильной репликации. Репликация может быть нарушена также при образовании поперечных межцепочечных сшивок ДНК.
Б зависимости от синтеза «правильных» или «неправильных» полипептидов при считывании мРНК, отразившей изменения ДНК (то есть в зависимости от сохранения смысловой функции образующегося полипептида), различают несколько видов мутаций.
«Молчащие» мутации (мутации «без изменения смысла», то есть не вызывающие изменения аминокислотной последовательности белка). Их появление возможно вследствие вырожденности генетического кода. Получившийся в результате мутирования триплет кодирует ту же самую аминокислоту, что и исходный триплет, поэтому синтезируемый белок остаётся без изменений.
Миссенс-мутации (мутации «с изменением смысла») возникают при условии, что изменения кодирующей последовательности приводят к появлению в полипептиде иной аминокислоты. Получающийся изменённый белок может быть функциональным или нефункциональным в зависимости от значимости затронутой мутацией области.
Нонсенс-мутации («антисмысловые», «бессмысленные» мутации) приводят к образованию одного из трёх кодонов-терминаторов (УАГ, УАА, УГА), вызывающих преждевременное окончание синтеза полипептидной цепи. Когда рибосома достигает такого кодона, процесс элонгации полипептидной цепи заканчивается, и высвобождается неполный пептид (вероятно, такое действие терминальных кодонов обусловлено отсутствием тРНК, связывающихся с данными кодонами). Эта мутация приводит либо к синтезу очень коротких нефункциональных белков, либо к полному прекращению синтеза белка.
ВЫВОДЫ
Изучение морфолого-анатомических признаков бактерий помогает установить систематическое положение той или иной группы бактерий и, в конечном итоге определить их практическую значимость.
По форме клеток бактерии разделяются: на шаровидные - кокки, палочковидные или цилиндрические - собственно бактерии и извитые - вибрионы спириллы и спирохеты. Между этими группами имеются переходные формы, например, кокко-бактерии.
Бактерии являются прокариотами (рис. 1.1) и существенно отличаются от клеток растений и животных (эукариотов). Они относятся к одноклеточным организмам и состоят из клеточной стенки, цитоплазматической мембраны, цитоплазмы, нуклеоида (обязательных компонентов бактериальной клетки). Некоторые бактерии могут иметь жгутики, капсулы, споры (необязательные компоненты бактериальной клетки).
Движение бактерий не является особенностью всех бактерий, только некоторые способны двигаться.
Процесс спорообразования у бактерий является стадией развития. Спора играет роль защитного приспособления, которым природа снабдила их для борьбы с неблагоприятными условиями. Способностью образовывать споры - особые тельца эллиптической и округлой формы обладают палочковидные бактерии.
Основным путем размножения у бактерий является бесполое размножение. Однако у некоторых бактерий встречается и половое размножение - конъюгация.
Жизнь бактерий, как и других живых существ, в упрощённом виде сводится к таким последовательным событиям: собственное воспроизведение -» обеспечение жизненных функций -» воспроизведение потомства. Нормальная реализация этого круговорота жизни для любого вида бактерий возможна лишь при развитии адекватных ответных реакций на любые воздействия окружающей среды, что во многом обеспечивается генетической информацией организма. Жизнь бактерий, равно как и всех живых существ, характеризуется ростом и размножением, то есть увеличением живой массы отдельной особи и популяции в целом за счет ассимиляции веществ, находящихся вне клетки.
Бактерии — удобная модель для генетических исследований.
СПИСОК ЛИТЕРАТУРЫ
1.Морфология и анатомия высших растений. Рубрика: Естественные науки. Название: Морфология и анатомия высших растений. Автор: А. А. Седов
2.Медицинская микробиология: конспект лекций для вузов В.А. Подколзина,
3. Микробиология - Дикий И.Л.
4. Руководство к лабораторным занятиям «Микробиология» Лысак В.Ю.
5. Ксения Викторовна Ткаченко «Микробиология»
6. Интернет сайт http://bibliofond.ru/view.aspx?id=606606
7. Интернет сайт http://www.studfiles.ru/preview/1777984/
8. Интернет сайт http://medbe.ru/materials/mikrobiologiya-i-biotekhnologii/
9. Интернет сайт http://atlas.ztom.ru/index.php/morfologiya-mm/anatomiya-bak-kletki-mm
10. Интернет сайт http://studopedia.ru/3_25993_morfologiya-i-ultrastruktura-bakterialnih-kletok.html













 (zip - application/zip)
(zip - application/zip)










