МИНОБРНАУКИ РОССИИ
Федеральное государственное бюджетное образовательное учреждение высшего профессионального образования
«НОВОСИБИРСКИЙ НАЦИОНАЛЬНЫЙ ИССЛЕДОВАТЕЛЬСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ»
Факультет естественных наук
Курсовая по органической химии
«Реакции ароматического нуклеофильного замещения. Синтез полифторзамещенного пентаоксокаликсарена»
Работу выполнил:
Гусаченко Егор Алексеевич
Преподаватель:
Осташевская Людмила Анатольевна
Научный руководитель:
Ковтонюк Владимир Николаевич
Содержание
Введение. 3
Литературный обзор. 4
Основная часть. 11
Эксперементальная часть. 14
Выводы.. 17
Используемые источники. 18
Приложения. 19
Введение
В представленной курсовой работе рассматривается трехстадийный синтез соединения относящегося к классу оксокаликсаренов. В настоящее время эти соединения представляют исследовательский интерес, так как имеют макроциклическую структуру и могут применяться в области супрамолекулярной химии для селективных реакций вследствие возможности образовывать комплексы по типу гость-хозяин с входящими молекулами. Оксакаликсарены используются в супрамолекулярной химии в качестве одной из платформ для разработки различных молекулярных рецепторов, образующих специфические комплексы с катионами металлов и нейтральными соединениями. Было показано также образование комплексов оксакаликсаренов с различными анионами. Последние достижения в области синтеза оксакаликсаренов связаны с методом, базирующимся на реакциях ароматического нуклеофильного замещения. Нуклеофильным агентом в этих реакциях выступают 1,3-дигидроксиароматические соединения. В настоящее время соединения со сходной структурой успешно применяются в стационарной жидкостной хроматографии для определения содержания меланина в детских смесях. Также на их основе был сделан электрохимический сенсор на аденин и гуанин.
Цель этой работы, используя фрагментный подход установить возможность образования пентаоксокалексарена как основного продукта, а также осветить основные механизмы, по которым может протекать нуклеофильное замещение. В данном случае в качестве субстратов использовались перфторированные ароматические соединения, активированные за счет акцепторного влияния атомов фтора, а также ароматические соединения имеющие заместитель способный выступать в роли нуклеофила. Для достижения этой цели необходимо решить ряд задач. Среди которых получение двух фрагментов конечной молекулы. А также анализ соотношения основных продуктов реакции и примесей.
Литературный обзор
Реакции нуклеофильного замещения в ароматическом кольце.
Существует несколько способов нуклеофильного замещения в ароматическом кольце:
1)Через соли диазония
2) Механизм отщепление- присоединение
3) Механизм присоединение-отщепление
Нуклеофильное замещение через ион диазония
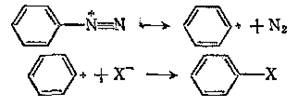 |
Замещение диазогруппы основано на чрезвычайно хорошей уходящей группе, атоме азота N2. При ее отщеплении образуется арильный катион. Этот катион не очень устойчив, так как свободная орбиталь лежит в плоскости кольца и не участвует в сопряжении, поэтому заряд не делокализован, однако он все-таки образуется, так как отщепляющаяся молекула азота является очень хорошей, устойчивой уходящей группой.[1]
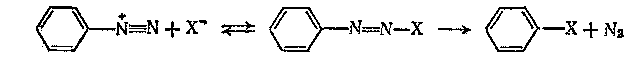
В
других реакциях интермедиатом является аддукт нуклеофила и диазониевого иона.
Замещение происходит, когда элиминируется азот.
И последним способом является замещение по радикальному типу с переносом электрона, этот механизм наиболее вероятно реализуется в рекакциях катализируемых солями меди.[2]
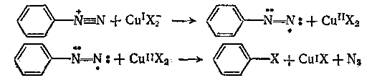 |
Приведенные механизмы реализуются соответственно в реакциях а) гидролиз арилдиазониевых солей в фенолы, б) реакции арилдиазониевых ионов с N-3 с образованием арилазидов, в) реакция Зандмейера катализируемая хлоридом или бромидом меди(I).
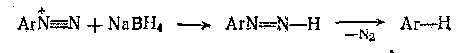 |
Часто в синтезах полезно применять реакцию замещения на водород. Обычно это используется после введения нитро или амино группы для ориентации заместителей. Замену диазо группы лучше всего проводить реакцией с ортофосфорной кислотой или с боргидридом натрия.
Замещение диазо группы на галоген является важным способом, так как образуется единственный изомер, в отличии от галогенирования. Фторирование происходит при реакции разложения тетрафторборатов диазония, при их термическом разложении образуется арилфторид.[2]
Нуклеофильное замещение по типу отщепление-присоединение.
Неактивированные арилгалогениды, в которых хотя бы одно из двух ортоположений по отношению к атому галогена не занято заместителем, сильными нуклеофилами реагирует по механизму, включающему последовательные стадии отщепление и присоединение. Нуклеофил Nu на первой стадии действует как основание отрывая протон в орто-положении к атому галогена ароматического субстрата. Отщепляется именно орто протон, поскольку в арилгалогенидах орто протон самый «кислый». Образовавшийся карбанион быстро выбрасывает анион Hal-, в результате чего оразуется незаряженная очень не стабильная частица, которую можно представить в виде бензольного кольца с тройной связью. На этом заканчивается стадия отщепления.[3]
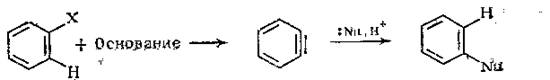 |
Механизм отщепление-присоединение протекает через очень неустойчивый интермедиат, который называют дегидробезолом или бензином.
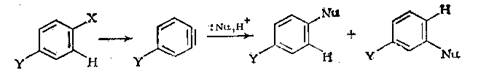 |
Отличительным свойством этого механизма является то, что входящий нуклеофил не обязательно присоединяется к тому атому углерода, к которому была присоединена уходящая группа.[2]
Ранее всего дегидробензол был обнаружен как интермедиат в реакции хлорбензола с амидом калия. В результате которой 14C метка в исходном веществе распределилась в анилине так, как этого следует ожидать при образовании дегидробензола. Этому механизму способствуют эффекты благоприятствующие уходу водорода из ароматического кольца в виде протона. Присоединение нуклеофилов протекают очень быстро.[2]
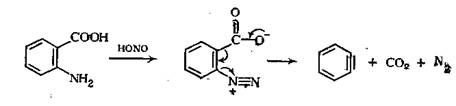 |
Кроме катализируемого основаниями, существует еще один способ генерирования дегидробензола. Некоторые из них применяются в синезах. Одним из наиболее приемлемых способов является диазотирование α-амино бензойных кислот. После диазотирования происходит синхронное элиминирование азота и CO2.Образование дегидробензола таким образом возможно в присутствии соединений которые быстро с ним реагируют.[2]
Нуклеофильное замещение по типу присоединение-отщепление.
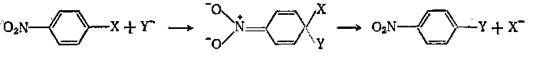 |
Присоединение нуклеофила к ароматическому кольцу с последующим отщеплением заместителя приводит к нуклеофильному замещению. Основным энергетическим требованием для протекания этого процесса является образование промежуточного продукта присоединения. Стадия присоединения облегчается электронакцепторными заместителями, поэтому нитроароматические субстраты являются лучшими для нуклеофильного ароматического замещения. Другие акцепторные заместители в меньшей степени повышают реакционную способность. В определенных условиях промежуточные аддукты достаточно устойчивы, их называют комплексами Мейзенгеймера.
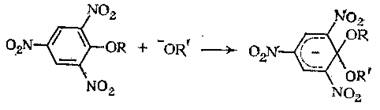 |
Аддукты, полученные из нитросоединений, сильно окрашены. Хорошими примерами подобных комплексов являются соединения полученные реакцией алкоксильных ионов с алкил-2,4,6-тринитрофениловыми эфирами:
Нуклеофильное замещение протекает через аналогичные интермедиаты, если ароматическое кольцо имеет потенциальную уходящую группу. Наиболее обычным случаем является замещение галогена, но по механизму присоединение-отщепление можно заместить также алкокси-, нитро-, и цианогруппы. Следует заметить, что способность уходящей группы к отщеплению в таких реакциях оказывается иной, чем при нуклеофильном замещении у насыщенного углерода. Например, фтор часто является лучшей уходящей группой в реакциях нуклеофильного ароматического замещения, чем другие галогены.[2]
Нуклеофильное замещение является основным методом введения заместителей в перфторированное ароматическое кольцо. Протекание этих реакций облегчено повышенной электронакцепторностью полифторированного ароматического кольца.[1]
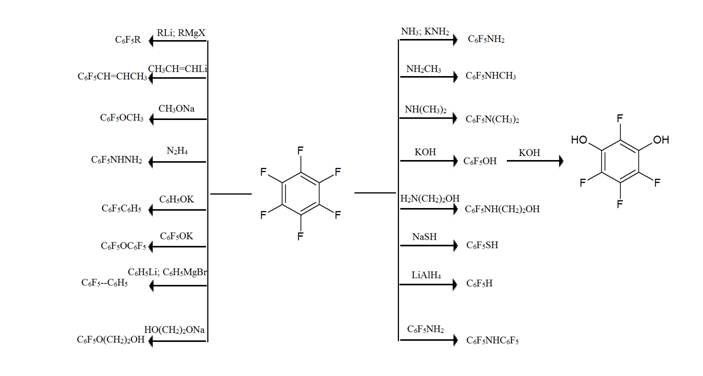
Замена
одного атома в гексафторбензоле легко протекает при действии самых различных
нуклеофильных агентов. Эти реакции привели к получению большого числа
пентафторзамещенных производных бензола с различными функциональными группами.[1]
В общем случае место вступления второго заместителя в соединения типа C6F5X определяется конкуренцией влияния заместителя X и влиянием атомов фтора.
Если X является сильным электронодонорным заместителем, то его влияние может преобладать над влиянием атомов фтора. Так при действии гидроокиси калия на пентафторфенол образуется тетрафторрезорцин, а при действии аммиака на гексафторбензол или пентафторанилин преимущественно тетрафтор-m-фенилендиамин.
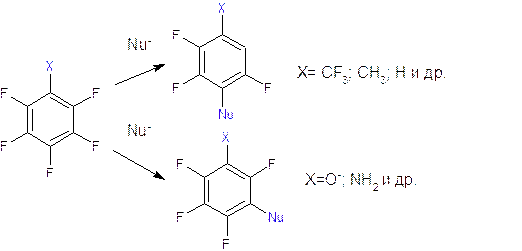 |
В случае других электронодонорных заместителей влияние атомов фтора преобладает и при действии на C6F5X образуются преимущественно пара-изомеры.
При реакции соединений типа C6F5X содержащих электроноакцепторные заместители (X= NO2, SO2CH3, COOCH3 и др.) с нуклеофильными агентами возможно отщепление как в орто, так и в пара положениях к заместителю.
В пентафторпроизводных бензола типа C6F5X содержащих электроноакцепторные заместители (X= CF3, C2F5, CN и др.) под действием нуклеофильных агентов отщепляется атом фтора находящийся в пара-положении к заместителю.
При замещение пентафторзамещенных производных бензола типа C6F5X следует также учитывать возможность взаимодействия входящей группы с уже имеющейся. Так например, если находящийся в ароматическом кольце заместитель способен образовывать водородные связи или комплексы донорно-акцепторного типа с атакующим нуклеофилом, то в этом случае большое влияние на направление реакции оказывает растворитель. Можно полагать, что замещение орто-атома фтора происходит через образование
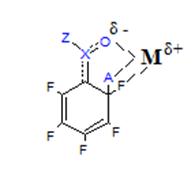 |
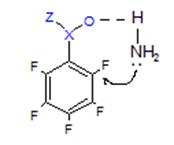 |
||
циклического переходного состояния.
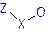 = NO2,
COOR, COOH,
COR.[4]
= NO2,
COOR, COOH,
COR.[4]
В том случае, когда реакция проводится в малополярных растворителях, преимущественно замещается атом фтора в орто-положении к заместителю. При проведении реакции в полярных растворителях, особенно в диполярных апротонных растворителях, препятствующих образованию циклических переходных состояний, преобладает замещение атома фтора в пара-положении. Это дает возможность управлять реакцией и получать орто- или пара-дизамещенные продукты в зависимости от необходимости.[4]
Основная часть
Нашей задачей было попытаться синтезировать полифторированный пентаоксокаликсарен из двух фрагментов, используя в качестве составных частей трифениловый эфира 1 и бисфенол 2.
Для получения конечного продукта был применен фрагментный подход, при котором итоговое соединение собирается из двух несимметричных фрагментов. В своей работе я провел три превращения. Сначала были получены два предшественника, из которых был составлен конечный продукт. Рассматриваемые соединения не имеют тривиальных названий, а номенклатурные названия слишком громоздкие, поэтому мы их пронумеруем. Данные соединения исследуются в узких кругах, поэтому к ним довольно трудно найти характеристические данные.
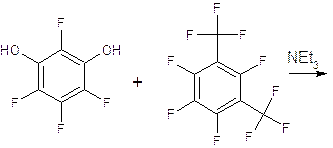 |
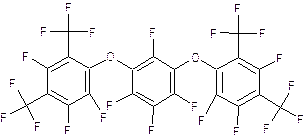 |
||
Для получения первого фрагмента (вещество I) были использованы смесь полностью фторированных мета- и пара- ксиолов и тетрафторрезорцин. Допускается использование смеси ксиолов, так как пара-ксиол значительно менее реакционно способен и не вступает во взаимодействие с ризорцином. Реакцию проводили в ацетонитриле с добавлением триэтиламина.
Вещество I
Реакция протекает по механизму присоединение-отщепление описанному выше. В результате происходит замещение атома фтора. Для проведения реакции использовался значительный избыток ксиолов. Отогнали избыток ксиолов и растворитель, а затем для очистки вещества использовали хроматографию. Перегоняли, используя метод перегонки короткого пути. Методом хромато-масс-спектрометрии было установлено, что в результате смесь продуктов содержит примерно 89% весовых необходимого вещества.
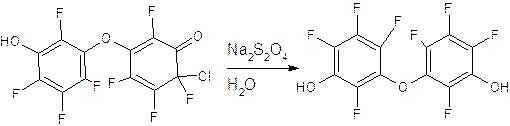 |
Для получения второго фрагмента использовали следующую реакцию. К раствору диенона в ацетонитриле добавили воду и твердый дитионит натрия. В результате этого превращения образуется бисфенол (вещество II).
Вещество II
Выделили бисфенол экстакцией в хлористом метилене. В качестве анализа продуктов реакции использовали 19F-ЯМР спектр, в котором видны четыре пика равной интенсивности, что соответствует парам эквивалентных ядер 19F, что согласуется с симметричной структурой молекулы. Пики наблюдаются при -1,9; - 0,9; +0,7; +4,0 ppm.
Последней стадией при смешении вещества I и вещества II ожидалось появление пентаоксокаликсарена (вещество III). Реакцию проводили в условиях аналогичных первому эксперименту.
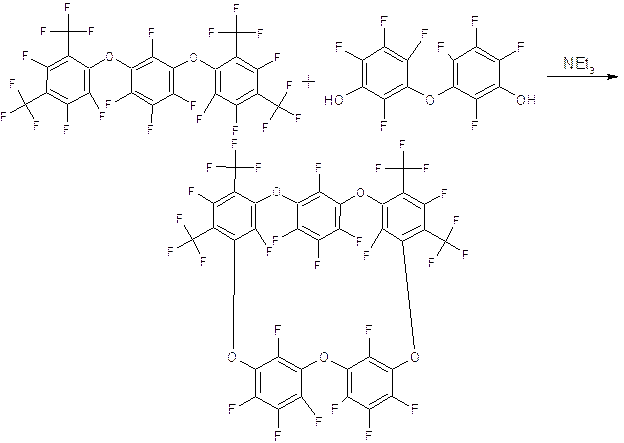
Данный
эксперимент проводился впервые и его целью было установить возможность
протекания этой реакции и определить какую долю составляет искомый
пентаоксокаликсарен. В результате реакции получена смесь, содержащая соединение
3 в качестве основного продукта, наряду с тетраоксакаликсареном и небольшим
количеством исходного соединения 2. Продукт 3 выделен 3-кратной кристаллизацией
из ССl4.
Таким образом было установлено, что в этой реакции действительно образуется
искомый пентаоксокаликсарен. Для идентификации использовали 19F-ЯМР
спектр. Спектр данного вещества оказался довольно сложным и содержит аномальный
хим. сдвиг на одном из ядер.
Эксперементальная часть
|
Название |
М.В |
Количество |
Соотношение молей |
||
|
ммоль |
г |
мл |
|||
|
Перфторксиол C6F4(CF3)2 |
286 |
17,48 |
5 |
6 |
|
|
Тетрафторрезорцин C6F4(OH)2 |
182 |
3 |
0,55 |
1 |
|
|
Ацетонитрил CH3CN |
25 |
||||
|
Триэтиламин |
1,5 |
||||
|
Дитионит натрия Na2S2O4 |
174 |
11,5 |
2 |
2 |
|
|
Диенон (раствор в ацетонитриле) |
380,5 |
5,25 |
2г (в-во) |
15 (р-р) |
1 |
I. Первая стадия.
1) В коническую колбу небольшого объема поместили 0,55г тетрафтор резорцина, шестикратный избыток смеси перфторированных ксиолов 5г, 10 мл ацетонитрила и 1г триэтиламина.
2) Перемешивал несколько часов на магнитной мешалке.
3) Смесь стояла две недели.
4) На роторном испарителе отогнал смесь ксиолов и избыток ацетонитрила.
5) Методом колоночной хроматографии очистил продукт от примесей используя в качестве растворителя четыреххлористый углерод. Собирал растворитель в пробирки.
6) Методом ТСХ определил в каких пробирках находится основной продукт.
7) Отогнал на роторном испарителе избыток четыреххлористого углерода.
8) Методом перегонки «короткого пути» на масляной бане отогнал продукт при температуре не выше 150°C. Получил 0,5 г вязкого жидкого продукта.
9) Отдал вещество на анализ хромато-масс-спектрометрию. Получил смесь с содержанием основного продукта 89% весовых.
II. Вторая стадия
1) Смешал раствор диенона в ацетонитриле с 10мл воды и дитионитом натрия.
2) Перемешивал 30 мин
3) 4 раза экстрагировал хлористым метиленом по 40 мл. Раствор имеющий щелочную среду долго расслаивался.
4) Очистил продукт методом колоночной хроматографии сперва хлороформом, затем хлористым метиленом.
5) Отогнал избыток хлористого метилена. Получил 0,6г кристаллического продукта.
6) Отдал на 19F-ЯМР спектр. Содержание целевого продукта ~94%.
7) Отобрал необходимое количество вещества для проведения последней стадии.
III. Третья стадия
1) Смешал 0,5г вещества I и 0,25г вещества II в 15 мл ацетонитрила и 0,5г триэтиламина.
2) Кипятил при температуре ̴ 80°C в течении 10 часов.
3) Упарил избыток растворителя.
4) Очистил продукт хроматографией. Выделил 0,67г вязкой массы.
5) Отдал на 19F-ЯМР спектр.
В результате первого первращения удалось выделить ̴ 0,5г вещества I. В результате второго превращения было выделено ̴ 0,6г вещества II. Для проведения последней стадии необходимо было взять вещества в соотношении 1:1. Исходя из расчетов, было отобрано 0,25г вещества II. После проведения реакции и очистки хроматографией в первой фракции было получено 0,67г вещества. Вещество представляет собой вязкую прозрачную маслянистую жидкость. При проведении реакции на первой и последней стадии при смешивании реагентов наблюдалось интенсивное темное окрашивание раствора.
Выводы
Нуклеофильное замещение в ароматическом кольце не является широко распространенным методом в синтетической химии, так как имеет определенные ограничения и происходит только с активированными субстратами или в жестких условиях, которые успешно реализуются в промышленности. Однако в некоторых случаях он может быть единственным способом позволяющим ввести новый заместитель в ароматическое кольцо. Нуклеофильное замещение в ароматическом кольце довольно успешно применяется в синтезе замещенных полифторорганических соединений, поскольку они проявляют достаточную активность. Этим способом могут быть получены в том числе довольно крупные циклические молекулы. В частности оксокаликсарены могут быть получены с использованием реакции присоединения-отщепления. На данный момент изучение оксокаликсаренов представляет интерес, так как они могут применяться в области супрамолекулярной химии.
Мной было получено вещество, относящееся к классу оксокаликсаренов, которое в настоящий момент представляет интерес, так как может обладать свойствами, позволяющими образовывать комплексы по типу гость-хозяин с другими молекулами. Трудно судить о том насколько этот метод может быть применен как способ синтеза этих соединений, так как наряду с необходимым продуктом образуются примеси других веществ в значительных количествах. Целью нашей работы было ответить на вопрос возможно ли таким способом получить и выделить данное вещество в качестве основного продукта. По результатам анализа можно сказать, что мной было выделено довольно чистое вещество с чистотой около 94% по молям. По моему мнению, я добился поставленной задачи.
Используемые источники
1) Беленький Г. Г. Синтезы фторорганических соединений. / И. Л. Кнунянца, Г. Г. Якобсон. ‑ Изд.1. 1-е, М., «Химия», 1973.‑312с.
2) Кери Ф., Сандберг Р. Углубленный курс органической химии / Пер. с англ. Г. В. Гришина, В. М. Демьянович, В. В. Дунина. – М.: Химия 1981. – 456с.
3) РеутовО. А., Курц А. Л., Бутин К. П. Органическая химия: в 4ч. М.: 1999. – 2336с.
4) Якобсон Г. Г. Реакционная способность полифторароматических соединений. – Новосибирск: Наука, 1983. – 251с.
Приложения
Приложение1. 19F-ЯМР спектр вещества I.
Приложение 2. Хромато-масс-спектр вещества 1.
Приложение 3. 19F-ЯМР спектр вещества III.














 (zip - application/zip)
(zip - application/zip)










