1.Теория растворов сильных электролитов Дебая – Хюккеля.
В 1923 г Дебай и Хюккель вывели формулу для расчета коэффициента активности разбавленных водных растворов с ионной силой I >0,01:
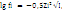
где fi – коэффициент активности i – катиона (аниона);
zi - заряд i – катиона (аниона). Активность ионов зависит от концентрации электролита, природы ионов и температуры.
Приближенные коэффициенты активности некоторых ионов при различной ионной силе раствора сведены в таблицы.
Теория Дебая-Хюккеля оказалась очень полезной для объяснения свойств электролитов. Она представляет собой предельный закон для малых концентраций. Уравнение превосходно согласуется с экспериментом при значениях ионной силы, меньших 0,01. При более высоких значениях ионной силы можно воспользоваться уточненными законами уравнения Дебая-Хюккеля.
2. Активность ионов и коэффициент активности. Расчет коэффициентов активности.
Под активностью электролита понимают эффективную концентрацию, в соответствии с которой он участвует в различных процессах. Активность связана с истинной концентрацией растворенного вещества соотношением: а(Х) = f(X)*c(X),
где а(X) – активность электролита Х, моль/л;
f(Х) - коэффициент активности;
с(Х) – молярная концентрация электролита, моль/л.
Коэффициент активности f характеризует влияние электростатических сил на способность ионов к химическому взаимодействию. В очень разбавленных растворах f = 1, т.е. ионы ведут себя согласно истинной концентрации. В не очень разбавленных растворах сильных электролитов межионные взаимодействия определяются зарядами ионов и их концентрацией.
Активность ионов зависит от концентрации электролита, природы ионов и температуры. С уменьшением концентрации раствора (уменьшением ионной силы) коэффициенты активности возрастают и при предельном разбавлении стремятся к единице. В растворах, содержащих многозарядные ионы, наиболее сильно проявляются межионные взаимодействия и активность ионов уменьшается. При увеличении температуры усиливается тепловое движение, которое способствует разрушению “ионной оболочки” и следовательно активность ионов возрастает.
3. Ионная сила раствора. Правило ионной силы Льюиса.
Количественной характеристикой межионных электростатических взаимодействий является ионная сила раствора I
Ионная
сила раствора I- это величина, измеряемая полусуммой произведений концентраций
всех находящихся в растворе ионов на квадрат их заряда: 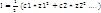
Правило ионной силы: “Коэффициент активности сильного электролита в растворе определяется только ионной силой, но не химической природой электролита.”
4. Удельная электропроводность растворов сильных и слабых электролитов.
Удельная электрическая проводимость рассчитывается по формуле :
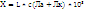
Удельная электрическая проводимость есть сила тока, создаваемая ионами, находящимися в 1 м3 раствора через площадку в м2 при напряжении в 1 вольт
В целом удельная электрическая проводимость зависит от природы электролита, природы растворителя, температуры и концентрации ионов в растворе.
5. Влияние концентрации электролита на величину удельной электропроводности.
Зависимость удельной электропроводности растворов электролитов от
концентрации выражается графически следующим образом:
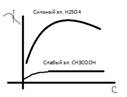 в
разбавленных растворах сильных
электролитов
в
разбавленных растворах сильных
электролитов
Рост электропроводности с концентрацией обусловлен изменением кол-ва ионов. Однако, в области концентрированных растворов одновременно с ростом концентрации ионов увеличиваются силы электростатического притяжения между ионами, что приводит к уменьшению скорости подвижности ионов. При определенном значении концентрации влияние уменьшения скорости движения ионов начинает преобладать над влиянием увеличивающейся ионной концентрации, в результате удельная электропроводность уменьшается.
В растворах слабых электролитов, всвязи с наличием малой концентрацией ионов силы электростатического взаимодействия незначительны. Скорость движения ионов практически не зависит от концентрации , поэтому в уравнении для электропроводности ( χ = αC(ƛа + ƛк) * 10-3). Поэтому в уравнения для определения χ определяется фактически произведением С*α.
В области разбавленных растворов, когда α близка к 1, небольшой рост удельной электропроводности обусловлен изменеием кол-ва ионов слабого электролита. В концентрированных же растворах α уменьшается и влияние ее начинает преобладать над увеличивающейся концентрацией слабого электролита.
6. электрофоретический и релаксационный эффекты.
Релаксационный эффект объясняется тем, что перемещение иона в электрическом поле сопровождается разрушением ионной атмосферы в одном положении иона и образованием ее в другом. Этот процесс происходит не мгновенно, в течение некоторого времени, называемого временем релаксации. В результате ионная атмосфера теряет центральную симметрию и позади движущегося иона возникает избыток заряда противоположного знака. Действующая при этом сила электростатического притяжения тормозит движение иона.
Электрофоретический эффект торможения возникает за счет того, что сольватированная ионная атмосфера, обладая зарядом, противоположным по знаку заряда центрального иона, движется в противоположном направлении. Таким образом, сольватированный центральный ион под действием электрического напряжения не в неподвижной среде, а в среде, перемещающейся ему на встречу, что приводит к снижению его скорости движения.
Силы релаксационного и электрофоретического торможения зависят от ионной силы раствора, природы растворителя и температуры.
7. Молярная электропроводность растворов сильных и слабых электролитов.
Электропроводность раствора характеризует не только величину удельной электропроводности (χ), но и эквивалентной (λ), которую относят к 1 молярной массе эквивалента.
Эквивалентная электропроводность представляет собой проводимость раствора, помещённого между одинаковыми электродами, расположенных на расстоянии 1 м, при этом S электрода должна быть такой, чтобы V раствора между ними содержалась молярная масса эквивалента вещества.
λ= α * V = χ * 10-3/С
V – разведение равное 10 -3
С – молярная концентрация
χ – удельная электропроводность
Разведение (V) показывает объём раствора (м3) в котором разведена 1 молярная масса эквивалента.
λ = α (λК + λА) [λ] = [см*м2/моль]
λ (эквивалентная электропроводность), как и χ (удельная электропроводность) зависит от природы растворителя, температуры и степени диссоциации. Механизм влияния этих факторов такой же, как и для χ.
Зависимость λ от концентрации для сильных и слабых электролитов представлена на графике:

С увеличением разбавления эквивалентная электропроводность растёт и в области разбавления раствора стремится к предельному значению λ∞.
Предельная эквивалентная электропроводность λ∞ - предельная электропроводность бесконечно разбавленного раствора характеризующееся полной диссоциацией электролита и отсутствии сил электростатического взаимодействия между ионами.
λ∞ = λ∞А + λ∞К
Предельная эквивалентная электропроводность λ∞ катионов или предельная подвижность катионов.
Величина предельной эквивалентной электропроводности λ∞ бесконечно разбавленного раствора электролита представляет собой сумму независимых величин предельных подвижностей ионов.
Из интернетов
Молярная электропроводность раствора λ есть величина, обратная сопротивлению раствора, содержащего 1 моль растворенного вещества и помещенного между электродами, расположенными на расстоянии 1 см друг от друга. С удельной электропроводностью κ и молярной концентрацией раствора Смолярная электропроводность связана следующим соотношением:
λ = 1000к/С ,Ом-1см2моль-1
Молярная электропроводность как сильных, так и слабых электролитов увеличивается с уменьшением концентрации (т.е. увеличением разведения раствора V = 1/С), достигая некоторого предельного значения λo, называемого молярной электропроводностью при бесконечном разведении

Для слабого электролита такая зависимость молярной электропроводности от концентрации обусловлена в основном увеличением степени диссоциации с разбавлением раствора. В случае сильного электролита с уменьшением концентрации ослабляется взаимодействие ионов между собой, что увеличивает скорость их движения и, следовательно, молярную электропроводность раствора. Последнюю связывает с абсолютными скоростями движения катионов и анионов U+ и U– уравнение Аррениуса:
λ = αF (U+ + U-)
8. Влияние концентрации электролита на величину молярной электропроводности.
Молярная электропроводность раствора λ есть величина, обратная сопротивлению раствора, содержащего 1 моль растворенного вещества и помещенного между электродами, расположенными на расстоянии 1 см друг от друга. С удельной электропроводностью κ и молярной концентрацией раствора С молярная электропроводность связана следующим соотношением:
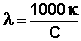 , Ом-1см2моль-1
(III.34)
, Ом-1см2моль-1
(III.34)
Молярная электропроводность как сильных, так и слабых электролитов увеличивается с уменьшением концентрации (т.е. увеличением разведения раствора V = 1/С), достигая некоторого предельного значения λo, называемого молярной электропроводностью при бесконечном разведении (рис. 1 – 2).
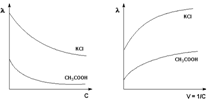
Рис. 1 Зависимость молярной Рис.2 Зависимость молярной электропроводности от концентрации. электропроводности от разведения
Для слабого электролита такая зависимость молярной электропроводности от концентрации обусловлена в основном увеличением степени диссоциации с разбавлением раствора. В случае сильного электролита с уменьшением концентрации ослабляется взаимодействие ионов между собой, что увеличивает скорость их движения и, следовательно, молярную электропроводность раствора. Последнюю связывает с абсолютными скоростями движения катионов и анионов U+ и U– уравнение Аррениуса
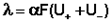
9. Закон Кóльрауша. Скорость движения и подвижность ионов. Подвижность и гидратация ионов.
Величина предельной эквивалентной электропроводности
бесконечно разбавленного раствора электролита представляет собой сумму
независимых величин предельной подвижности ионов:
Закон Кольрауша:
В бесконечно разбавленном растворе ионы движутся
независимо один от другого.
Скорость направленного движения иона, т. е.
путь, пройденный ионом в растворе под действием электрического поля в
направлении к электроду за единицу времени, зависит от действующей на ион силы,
т. е. от напряженности электрического поля:
V = иЕ
где V — скорость движения иона, м/с;
Е - напряженность поля, В/м;
и - коэффициент пропорциональности, называемый
электрической подвижностью иона или просто подвижностью иона, м2/(В • с).
ПОДВИЖНОСТЬ ИОНА характеризует его способность
преодолевать сопротивление среды при направленном движении в электрическом
поле.
Заряд и радиус иона, т. е. его природа: чем
больше заряд и чем меньше радиус иона, тем сильнее гидратируется ион, тем ниже
подвижность иона в растворе.
Природа растворителя, его диэлектрическая
проницаемость и вязкость. Чем полярнее растворитель, тем больше размеры
гидратированного иона и меньше его подвижность. Вязкость растворителя
обуславливает сопротивление среды движущемуся иону: чем больше вязкость, тем
меньше подвижность иона.
Температура раствора. При повышении температуры
уменьшаются вязкость растворителя и толщина сольватных оболочек ионов, а также
снижается межионное взаимодействие. Все это приводит к увеличению подвижности
ионов.
Ионная сила раствора. Чем больше ионная сила
раствора, тем сильнее межионное электростатическое взаимодействие и создаваемые
им тормозящие эффекты.
Концентрация ионов. Чем больше концентрация
ионов в растворе, тем сильнее электростатическое взаимодействие ионов,
снижающее их подвижность. Концентрация ионов зависит от силы электролита и его
количества в растворе. При разбавлении растворов сильных электролитов
подвижность соответствующих ионов растет, поскольку уменьшается их
концентрация, а следовательно, снижается межионное взаимодействие в растворе. В
растворах слабых электролитов (обычно а < 0,03) подвижность ионов
практически не зависит от разбавления, так как концентрация ионов в этих
растворах всегда невелика.
Сольватация (гидратация) иона увеличивает его
размер и снижает его подвижность.Чем выше диэлектрическая проницаемость
(полярность) растворителя, тем сильнее сольватируется ион; при этом
увеличиваются его размеры и понижается подвижность.
Предельная подвижность ионов зависит его
природы, от природы растворителя и температуры, но не зависит от природы
другого иона в данном электролите.
10. Электрод. Механизм возникновения электродного потенциала.
Электродом, называют электронопроводящую фазу (металлы или полупроводники), контактирующую с ионным проводником (электролитом).
Электродные процессы представляют собой ОВР, протекающие на электродах. В ходе этих реакций происходит переход электронных зарядов из одной фазы в другую в результате чего на поверхности одной фазы сосредотачиваются отрицательные заряды, а на поверхности другой положительные, что что приводит к образованию двойного электрического слоя, которому соответствуют определённые скачки потенциала.
Электронопроводящая фаза, вместе с раствором или расплавом электролита образует полуэлемент. Один полуэлемент окислительный другой восстановительный. Вместе они образуют гальванический элемент.
Гальванический элемент работает за счёт окислительно-восстановительной химической реакции, вследствие которой является перенос электронов, а, следовательно, появление электрического тока.
В гальваническом элементе возникают 3 потенциала:
Контактный
Диффузионный
Электродный
Ме1 активный, а Ме2 пассивный, то Ме1 будет отдавать электроны (Ме0 1 –ne Men+1), (Mez+2 +ne Me02)
ε0 = ϕок – ϕвос + ϕкон + ϕдиф
Электродвижущая сила электрохимической цепи гальванического элемента равна алгебраической сумме скачков потенциала возникающих на границе всех фаз.
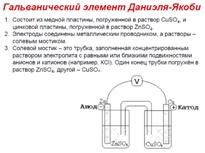
Химическим гальваническим элементом называют устройство из 2ух электродов, в котором химическая энергия превращается в электрическую. Между растворами отдельных электродов устанавливают контакт с помощью электрического мостика, заполненного насыщенным раствором KCl или NaCl. Этот мостик обеспечивает электрическую проводимость между растворами, но препятствуют их взаимной диффузии.
Электродный потенциал рассчитывается по уравнению Нернста.
Из учебника
Двойной электрический слой возникает в результате окислительно- восстановительных процессов и отражает способность материала электрода к окислению. Чем легче материал электрода окисляется, тем больше количество ионов, при прочих равных условиях, выходит из кристаллической решётки электрода в раствор и тем отрицательнее его потенциал. Поэтому потенциал электрода, измеренный в нормированных условиях, получил название окислительно- восстановительного потенциала.
11. Уравнение Нернста.
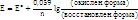
Е- стандартный электродный потенциал
n – число электронов, присоединяемых или теряемых одной частицей вещества
уравнение, связывающее окислительно-восстановительный потенциал системы с активностями веществ, входящих в электрохимическое уравнение, и стандартными электродными потенциалами окислительно-восстановительных пар.
12. Стандартные электродные потенциалы. Стандартный водородный электрод. Измерение электродных потенциалов.
Стандартный электродный потенциал- потенциал, возникающий на границе металл/раствор при активности катионов металла в растворе 1 моль/л и температуре 298К.
Стандартный водородный электрод — электрод, использующийся в качестве электрода сравнения при различных электрохимических измерениях и в гальванических элементах.
Для определения стандартного электродного потенциала(φ0), исследуемый электрод требуется поместить в раствор с активностью потенциалообразующих ионов, равной единице. Например, для экспериментального определения φ0Zn2+/Znможно воспользоваться цинковым электродом, помещённым в раствор цинка с aZnSO4 =1.Раствор водородного электрод и ячейку, заполненную раствором сульфата цинка, необходимо электрически соединить солевым мостиком. Если убрать мостик, цепь окажется разомкнутой; ток между ячейками с раствором протекать не сможет, и электрические измерения станут невозможными.
13. Электроды I рода. Водородный газовый электрод. Устройство водородного газового электрода. Электродная реакция, протекающая при работе этого электрода. Схематическая запись и формула Нернста для потенциала водородного газового электрода.
Электродами первого рода называют электроды с активной твёрдой или газообразной формой, обратимые либо относительно катионов, либо только относительно анионов.
К ним относятся: металлические электроды, обратимые относительно катионов, металлоидные электроды, обратимые относительно анионов, и газовые электроды, обратимые или по отношению к анионам, или к катионам.
(обратимость относительно тех или иных ионов означает зависимость его потенциала от концентрации данных ионов)
Газовые электроды, обратимые относительно анионов, обычно образуются при опускании инертного металла, насыщенного газом, в раствор хорошо растворимого электролита, анионом которого является восстановленная форма газа.
Примером таких электродов являются: (Pt)Cl2| HCl; (Pt)O2 | NaOH.
На их поверхности протекает реакция газ+ ze= анион. Например, в кислородном электроде: O2 + 2H2O +4e = 4OH-; в хлорном Сl2 +2e = 2Cl-. Их потенциал описывается выражением: φ=φ0+𝑅𝑇𝑧𝐹𝑅𝑇𝑙𝑛(𝑎ГАЗ𝑎АНИОН)=φ0−𝑅𝑇𝑧𝐹𝑅𝑇𝑙𝑛(𝑎АНИОН)
Газовые электроды могут быть обратимыми и относительно катиона. Типичным примером такого электрода является водородный электрод, характеризующийся реакцией: H2 -2e = 2H+
14. Электроды II рода. Хлорсеребряный электрод. Электродная реакция, протекающая при работе этого электрода. Схематическая запись и формула Нернста для потенциала хлорсеребряного электрода.
Электродом,
называют электронопроводящую фазу (металлы или полупроводники), контактирующую
с ионным проводником (электролитом).
Электродами второго рода называют сложные
многофазные электроды, формально обратимые как относительно катионов, так и
относительно анионов.
Состоят из металла, труднорастворимой соли этого
металла и второго соединения, хорошо растворимого и содержащего тот же анион,
что и труднорастворимая соль.
Хлорсеребрянный электрод имеет обозначение Ag |
AgCl | KCl. Он представляет собой серебряную проволоку, покрытую слоем AgCl,
опущенную в насыщенный раствор KCl.
ОВ процессом на этом электроде является реакция:
Ag+ +e = Ag0
Ей соответствует электродный потенциал:
EAgCl/Ag = E°Ag+/Ag +
RT/nF·ln aAg+ = E°Ag+/Ag +
RT/nF·ln ПР(AgCl)/aCl- =
E°AgCl/Ag - RT/nF·ln aCl-
Серебряная проволока в электроде контактирует с
пастой, представляющей собой перетёртую смесь малорастворимого соединения AgCl
c жидким KCl.В пасте хлорид серебра диссоциирует на ионы и образует насыщенный
раствор:
AgCl= Ag+ + Cl-
16. Ионнообменные электроды. Стеклянный электрод. Схема записи электрода. Электродный процесс на стеклянном электроде. Уравнение Нернста для стеклянного электрода. Применение стеклянного электрода в лабораторной практике: преимущества и недостатки.
Особенность данных электродов состоит в том, что они включают такую (обычно твердую) фазу, которая избирательно высвобождает в раствор или сорбирует из него те или иные ионы. Это приводит к созданию разности потенциалов
Наиболее известным и важным является стеклянный электрод, используемый в рН-метрах. Он представляет собой хлорсеребряный электрод, заключенный в стеклянную оболочку из специального токопроводящего стекла, заканчивающуюся тонкостенным шариком. Ag| AgCl| HCl
Принцип действия основан на том,что стеклянный электрод долго находится в воде. При этом в поверхностном слое стекла происходит гидролиз силиката Na:
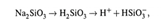
Ионы водорода частично переходят в раствор, что создает разность потенциалов (∆Ψ) между поверхностью и жидкой средой. Ясно, что величина ∆Ψ зависит от концентрации ионов H + в растворе.
Причем, в данном случае у нас — две поверхности: - внутренняя, где скачок потенциала (∆Ψin) постоянен и определяется раствором НСl внутри стеклянного электрода; - внешняя, где скачок потенциала (∆Ψex) зависит от рН исследуемого раствора. Следовательно, зависит от рН и разность потенциалов, измеряемая в элементе между внутренней и внешней средами.

Для измерения pH широко применяется стеклянный электрод. Применение стеклянного электрода основано на том, что стекло содержит катионы, которые могут обмениваться с катионами, находящимися в растворе.
Стеклянный
электрод имеет высокое сопротивление, отсюда требование к измерительному
рН-метру. Другой недостаток – ограничение диапазонов рН. При высоких рН
происходит нарушение соотношения 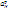 > >
> > 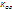
 (К – константа
обмена, а – равновесные активности катионов натрия и водорода в растворе) и
электрод становится обратимым относительно катионов натрия. Также потенциал
изменяется во времени, правильные результаты при работе можно получить только
при регулярной градуировке электрода. Главный «+» - индифферентность
(безразличие) электрода к окислителям и восстановителям.
(К – константа
обмена, а – равновесные активности катионов натрия и водорода в растворе) и
электрод становится обратимым относительно катионов натрия. Также потенциал
изменяется во времени, правильные результаты при работе можно получить только
при регулярной градуировке электрода. Главный «+» - индифферентность
(безразличие) электрода к окислителям и восстановителям.
17. Окислительно-восстановительные электроды. Хингидронный электрод. Устройство и схема записи электрода. Реакция, протекающая на хингидронном электроде. Уравнение Нернста для этого электрода. Применение хингидронного электрода в лабораторной практике.
а)
В принципе, каждый электрод является окислительно-восстановительным. Но под
термином «редокс-электроды» понимают такие полуэлементы, где все компоненты
полуреакции (Ох и Red) находятся в растворе; металлические же
электроды, погруженные в раствор, в реакции не участвуют, а служат лишь
переносчиками электронов.
б) Компонентами ОВ-пары при этом могут быть неорганические вещества
Однако для органических веществ редокс-электроды особенно важны, т.к. являются единственным способом образовать полуэлемент
Наиболее
известный пример — хингидронный электрод: (Pt) |  ,
, 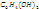 ,
, 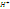
Здесь платиновая пластинка погружена в насыщенный раствор хингидрона в присутствии твердого хингидрона. Растворенный хингидрон диссоциирует на эквивалентные количества хинона (Ох) и гидрохинона (Rd), связанные реакцией восстановления
В данной полуреакции фигурируют протоны; поэтому потенциал электрода зависит от рН
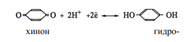
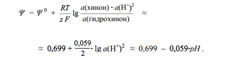
Зависимость потенциала от рН позволяет использовать хингидронный электрод для измерения рН. Правда, в этих целях он применим в области значений рН, не больших 8. Дело в том, что в щелочной среде гидрохинон ведет себя как слабая кислота, т.е. теряет протоны, отчего они перестают фигурировать в уравнении полуреакции.
ХЭ применяют в ряде случаев при потенциометрических измерениях для определения рН раствора.
15. Термодинамика гальванического элемента. Схематическое изображение гальванического элемента Даниэля-Якоби. Формула записи и уравнение Нернста для ЭДС
Термодинамика гальванического элемента.
Пусть в электрохимическом элементе протекает реакция вида:
M + Nn+ = Mn+ + N.
Работа,
производимая элементом при растворении 1 моля вещества М, определяется
произведением величины заряда q = n  e-
e-  NA = nF на
величину разности потенциалов между электродами, называемую электродвижущей
силой (ЭДС) гальванического элемента:
NA = nF на
величину разности потенциалов между электродами, называемую электродвижущей
силой (ЭДС) гальванического элемента:
A
= n  F
F E,
(9.1)
E,
(9.1)
где Е - ЭДС гальванического элемента, В.
Если
элемент работает обратимо в условиях р = const, то A = n  F
F E
= -
E
= - GT. (9.2)
GT. (9.2)
Из (9.2) очевидно, что Е определяется величиной А. Дифференцируя (9.2)
и подставляя (9.3) в уравнение Гиббса - Гельмгольца (4.72):
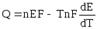 . (9.5)
. (9.5)
Уравнения (9.5) - это уравнения Гиббса - Гельмгольца для гальванического элемента.
Тепловой эффект химической реакции, происходящей в гальваническом элементе в соответствии с (9.5) может быть представлен в виде:
Q = A + Q’, (9.6)
где Q’ - часть теплового эффекта химической реакции.
В соответствии с (9.5):
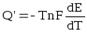 .
(9.7)
.
(9.7)
Итак,
если при работе гальванического элемента энергия выделяется в окружающую среду
(Q’ > 0), то 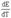 <
0 (9.7). Это означает, что с увеличением температуры ЭДС гальванического элемента
уменьшается.
<
0 (9.7). Это означает, что с увеличением температуры ЭДС гальванического элемента
уменьшается.
Если
работа гальванического элемента сопровождается поглощением энергии из
окружающей среды (Q’ < 0), то  >
0, т. е. ЭДС гальванического элемента будет увеличиваться при увеличении
температуры. Гальванические элементы - эталоны, например гальванический элемент
Вестона, характеризуется тем, что у них
>
0, т. е. ЭДС гальванического элемента будет увеличиваться при увеличении
температуры. Гальванические элементы - эталоны, например гальванический элемент
Вестона, характеризуется тем, что у них 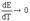 .
.
Работа химической реакции, протекающей в гальваническом элементе, связана с изменением активностей ионов в растворе, поэтому применение уравнения изотермы химической реакции дает:
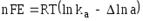 .
.
Для гальванического элемента Даниэля - Якоби, в котором протекает реакция
Zn + Cu2+ = Zn2+ + Cu,

где
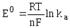 -
стандартная (нормальная) ЭДС гальванического элемента. Е0 равна ЭДС при
активности всех участников реакции, равной единице.
-
стандартная (нормальная) ЭДС гальванического элемента. Е0 равна ЭДС при
активности всех участников реакции, равной единице.

Активность чистых металлов постоянна и принимается единичной, поэтому ЭДС элемента Даниэля - Якоби равна
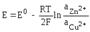 .
.
Схематическое изображение гальванического элемента Даниэля-Якоби
Величина электродного потенциала металлического электрода зависит от температуры и активности (концентрации) иона металла в растворе, в который опущен электрод; математически эта зависимость выражается уравнением Нернста (здесь F – постоянная Фарадея, z – заряд иона):
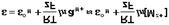 (III.40)
(III.40)
В уравнении Нернста ε° – стандартный электродный потенциал, равный потенциалу электрода при активности иона металла, равной 1 моль/л. Стандартные электродные потенциалы электродов в водных растворах составляют ряд напряжений. Величина ε° есть мера способности окисленной формы элемента или иона принимать электроны, т.е. восстанавливаться.
Рассмотрим расчёт ЭДС элемента Даниэля-Якоби с помощью уравнения Нернста. ЭДС всегда является положительной величиной и равна разности электродных потенциалов катода и анода:
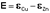 (III.41)
(III.41)
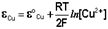 (III.42)
(III.42)
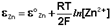 (III.43)
(III.43)
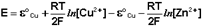 (III.44)
(III.44)
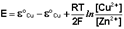 (III.45)
(III.45)
Как видно из уравнения (III.45), ЭДС элемента Даниэля-Якоби зависит от концентрации (точнее говоря, активности) ионов меди и цинка; при их равных концентрациях ЭДС элемента будет равна разности стандартных электродных потенциалов:
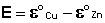 (III.46)
(III.46)
Анализируя уравнение (III.45), можно определить предел необратимой работы гальванического элемента. Поскольку на аноде идет процесс окисления цинка, концентрация ионов цинка при необратимой работе гальванического элемента постоянно увеличивается; концентрация ионов меди, напротив, уменьшается.
18. Кондуктометрические методы анализа. Кондуктометрический метод определения степени и константы диссоциации слабого электролита в водных растворах. Кондуктометрическое титрование сильных и слабых электролитов.
После рассмотрения основ электропроводности растворов кратко остановимся на использовании этого явления в целях физико-химического анализа.
а) Измерение электропроводности раствора электролита называется кондуктометрией (от англ. «to conduct» — проводить).
б) Для подобных измерений созданы специальные приборы — кондуктометры.
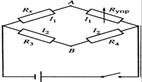
В основе их — схема из четырех сопротивлений — мост Уитстона (рис. 13.6). Исследуемый раствор помещают в кондуктометрическую ячейку, после чего этот раствор служит одним из сопротивлений схемы, а именно, сопротивлением Rχ.
Еще одно сопротивление является переменнным (Rупр). Изменяя его, добиваются того, чтобы разность потенциалов между точками А и В обратилась в нуль.
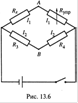 в) Тогда выполняются
соотношения:
в) Тогда выполняются
соотношения:
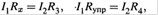

откуда измеряемое сопротивление равно
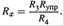 (13.55)
(13.55)
г) Зная его и параметры ячейки (l, S), по формулам (13.28—13.30) нетрудно найти удельную и эквивалентную электропроводность:
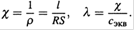
Из многих применений кондуктометрии отметим лишь два.
1. Определение степени и константы диссоциации слабого электролита.
Вариант I. Для ионов, на которые диссоциирует электролит, известны предельные эквивалентные подвижности — λ 01и λ 02.
а) Исходя из формулы (13.50), получаем:

б) Следовательно, определив экспериментально λ, можно оценить степень диссоциации слабого электролита при данной его концентрации.
в) А зная α — с помощью закона разведения Оствальда рассчитать и константу диссоциации:

Вариант II.
Величины λ 01и λ 02 неизвестны. Как в этом случае найти α и Ka?
а) Соотношение (13.56, а) можно записать и так:

где λ0— предельная эквивалентная проводимость раствора. Подставляем его в (11.25):
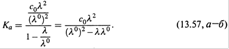
б) Последнее уравнение преобразуем к виду:

что после деления на λ дает:
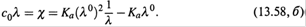
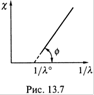
В итоге получается линейная зависимость χ (удельной электропроводности) от 1/λ (рис. 13.7).
в) Следовательно, если по экспериментальным данным построить график такой зависимости, то по точке его пересечения с осью абсцисс можно найти 1/λº, затем для какой-либо концентрации — α (по формуле (13.56,6)) и, наконец, Ka (11.25).
г) Что касается Ka, то можно воспользоваться и указанным графиком:
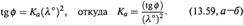
2. Кондуктометрическое титрование.
а) А этот метод применяется для определения концентрации веществ. Принцип основан на том, что в т.н. критических точках титрования (КТТ) резко меняется зависимость проводимости раствора от количества титранта. Три примера кривых титрования приведены на рис. 13.8.
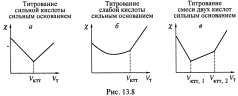
б) Чтобы
объяснить первую кривую, обратимся к реакции
I. При добавлении в ячейку NaOH подвижные ионы H+ связываются с
гидроксил–ионами b заменяются на менее подвижные ионы Na+. Поэтому
электропроводность ячейки снижается и в критической точке титрования (VKTT) она
минимальна.
II.
Но затем, по мере добавления избыточных количеств ионов Na+ и OH-, которые уже
ни с чем не связываются и ничего не замещают, а просто накапливаются в ячейке,
электропроводность, очевидно, опять повышается.
в) При
титровании слабого электролита (рис. 13.8,б) небольшой подъем χ
наблюдается за-долго до VKTT — из-за того, что увеличивается степень
диссоциации электролита. Но после VKTT проводимость начинает возрастать гораздо
быстрей.
19. Потенциометрические методы анализа. Потенциометрическое определение рН растворов.
Потенциометрия
Измерение ЭДС гальванических элементов в целях физико-химического анализа. Данный подход обозначается как потенциометрия. Возможные его применения весьма многообразны.
а) Например, найдя для OB-реакции ΔΨрц (при нескольких температурах), можно рассчи-тать термодинамические параметры этой реакции — ΔGрц, ΔG0рц, Kp, ΔН0рц и ΔS0рц.
б) С помощью потенциометрии определяют также характеристики растворенного вещества:
- коэффициент активности сильного электролита (активность рассчитывают по формуле Нернста и сравнивают с реальной концентрацией),
- рН раствора и
- константу кислотности слабого электролита (в эквимолярной буферной смеси, составленной с участием этого электролита, рН совпадает с pKa), и т.д.
2. Подробней остановимся на потенциометрическом титровании.
а) Это метод, используемый для определения концентрации какого-либо вещества (электролита). – Составляют гальванический элемент; в полуэлемент с исследуемым раствором последовательно добавляют титрант и измеряют каждый раз ЭДС элемента.
б) В критической точке титрования происходит резкое изменение ЭДС.
3. Пример: титрование раствора FeCl3 раствором SnCl2.
а) Пусть требуется определить в растворе концентрацию соли FeCl3. Составим гальванический эле-мент (рис. 15.6): один электрод водородный, другой — редокс-электрод с изучаемым раствором FeCl3.

б) В принципе, некоторое количество ионов Fe3+ могло бы восстанавливаться за счет окисления H2. Но из-за высокого сопротивления во внешней цепи этот процесс совершенно незначителен. Поэтому до титрования в левом полуэлементе ОВ-пары ещѐ нет, так как имеется только один ее компонент — ионы Fe3+.
в) Начнем добавлять к раствору FeCl3 в данном полуэлементе раствор соли SnCl2 .
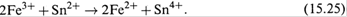
Будет происходить реакция:
Поскольку появятся ионы Fe2+, то образуется пара Fe3+/Fe2+, и измеряемая ЭДС будет определяться соотношением еѐ компонентов:
ΔΨ = Ψ (Fe3+/Fe2+) = Ψ0Fe3+/Fe2+)
+ 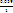 ∙
lg
∙
lg
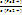 . (15.26,а-б)
. (15.26,а-б)
г) А. По мере добавления SnCl2 отношение c(Fe3+)/c(Fe2+) и, следовательно, ЭДС будет снижаться (ветвь I на рис. 15.7).

Б. В критической точке титрования (КТТ) будет оттитровано всѐ количество Fe3+, так что в растворе останутся только про-дукты реак-ции – ионы Fe2+ и Sn4+, т.е. ОВ-пары в растворе вновь больше нет. Но определить прохождение системой КТТ можно лишь после дальнейшего титрования.
д) А. Действительно, при добавлении очередных порций раствора SnCl2 в системе возник-нет новая ОВ пара – Sn4+/Sn2+, и теперь ЭДС определяется ею (ветвь II на рис. 15.7):
ΔΨ
= Ψ (Sn4+/Sn2+) = Ψ0 (Sn4+/Sn2+) +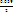 ∙ lg
∙ lg 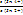 . (15.27,а-б)
. (15.27,а-б)
Б. По мере добавления SnCl2 соотношение c(Fe3+)/c(Fe2+) тоже падает, так что ΔΨ про-должает снижаться.
е) Но теперь критический объѐм титрования (VКТТ) легко определить по точке перегиба кривой – от ветви I к ветви II. Тогда, зная количество соли в этом объѐме, можно найти и количе-ство исчезнувшей соли FeCl3 (оно в 2 раза больше), а значит и концентрацию FeCl3 в исходном растворе.
ж) Кроме того, можно оценить и стандартные редокс-потенциалы обеих ОВ пар, если они неизвестны. Действительно,
при V1 = 0,5 VКТТ ΔΨ = Ψ0 (Fe3+/Fe2+), (15.28, а-б)
а при V1 = 2 VКТТ ΔΨ = Ψ0 (Sn4+/Sn2+) (15.29, а-б)
Заметим, что самомỳ критическому объѐму (VКТТ ) соответствует такое ΔΨ, которое равно среднему арифметическому значению Ψ0 (Fe3+/Fe2+) и Ψ0 (Sn4+/Sn2+).
20. Потенциометрическое титрование. Значение этих методов в фармацевтической практике.
Потенциометрическое титрование – метод определения концентрации или количества вещества потенциометрическим кривым титрования(КТ).
КТ получают многократным измерением ЭДС цепи после каждого прибавления порции титранта к титруемому раствору, находящемуся в гальваническом элементе, состоит из индикаторного электрода и электрода сравнения.
Цель титрования: добавление титранта, в количестве химически эквивалентном количеству реагирующего с ним вещества. Эта цель достигается в точке эквивалентности.
Потенциометрическое определение конечной точки титрования возможно, если в области точки эквивалентности наблюдается резкое изменение потенциала индикаторного электрода.

Потенциометрия обладает такими же способностями как кондуктометрия, но отличается тем, что присутствуют в растворе электролиты как правило не мешают титрованию.
Значение этих методов в фармацевтической практике.
Метод потенциометрического титрования применяется для анализа лекарственных веществ, например, кислоты аскорбиновой, сульфамидных препаратов, барбитуратов, алкалоидов и др. Метод обладает высокой точностью, хорошей чувствительностью и позволяет проводить титрование в мутных, окрашенных, неводных средах, раздельно определять компоненты смеси в одном анализируемом растворе, например, хлорид- и иодид - ионы при аргентометрическом титровании.
21. Потенциометрическое определение стандартной энергии Гиббса реакции и константы химического равновесия
Потенциаметрическое определения изобарного потенциала реакции начинается с разделения ОВР на полуреакции. Затем подбираются электроды, на которых реализуются составленные полуреакции. Наконец, составляется гальванический элемент, измеряется его ЭДС при активностях потенциалообазующих ионов равной 1,и по уравнению
∆G= ∆G0 + RTln∏iaivi ,
где ai – активности реагирующих веществ и продуктов реакций при заданных условиях.
Пример:
2Fe3++ HAsO2 + 2H2O = 2Fe2+ + H3AsO4+ 2H+
ей соответствует реакция восстановления:
2Fe3+ +2e = 2Fe2+
И реакция окисления:
HAsO2 + 2H2O – 2e = H3AsO4 + 2H+
Обе полуреакции могут быть реализованы на ОВ электродах: железном и мышьяковом, пригодным для моделирования анализируемой реакции, может иметь следующий вид:
(-) (Pt) |HAsO2, H3AsO4, H+ || Fe3+, Fe2+ | (Pt) (+)
Учтено, что в гальваническом элементе используются 2 раствора, которые должны бытьь пространственно разделены. Поэтому элемент содержит солевой мостик, обеспечивающий электрический контакт, но исключающий перемешивание растворов HAsO2, H3AsO4 , H+ и Fe3+, Fe2+.
Приготавливаются растворы с единичной активностью, измеряется стандартная ЭДС Е0 и рассчитывается ∆G0r :
∆G0r= -zFe0.
Определение константы равновесия.
Уравнение
Е0=
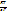 lnK
lnK
Где К- константа равновесия реакции.
Е0- стандартная ЭДС
R- универсальная газовая постоянная(8,314 Дж/моль*К)
Т-температура по Кельвину
Позволяет на основе экспериментальных данных рассчитать константу равновесия реакции, реализованной в гальваническом элементе:
K= exp (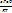 ).
).
Билет 1
Удельная электропроводность, факторы
Классификация шкал, стеклянный электрод, схема, уравнение
4. Удельная электропроводность растворов сильных и слабых электролитов.
Удельная электрическая проводимость рассчитывается по формуле :
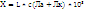
Удельная электрическая проводимость есть сила тока, создаваемая ионами, находящимися в 1 м3 раствора через площадку в м2 при напряжении в 1 вольт
В целом удельная электрическая проводимость зависит от природы электролита, природы растворителя, температуры и концентрации ионов в растворе.
16. Ионнообменные электроды. Стеклянный электрод. Схема записи электрода. Электродный процесс на стеклянном электроде. Уравнение Нернста для стеклянного электрода. Применение стеклянного электрода в лабораторной практике: преимущества и недостатки.
Особенность данных электродов состоит в том, что они включают такую (обычно твердую) фазу, которая избирательно высвобождает в раствор или сорбирует из него те или иные ионы. Это приводит к созданию разности потенциалов
Наиболее известным и важным является стеклянный электрод, используемый в рН-метрах. Он представляет собой хлорсеребряный электрод, заключенный в стеклянную оболочку из специального токопроводящего стекла, заканчивающуюся тонкостенным шариком. Ag| AgCl| HCl
Принцип действия основан на том,что стеклянный электрод долго находится в воде. При этом в поверхностном слое стекла происходит гидролиз силиката Na:
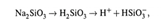
Ионы водорода частично переходят в раствор, что создает разность потенциалов (∆Ψ) между поверхностью и жидкой средой. величина ∆Ψ зависит от концентрации ионов H + в растворе.
Причем, в данном случае у нас — две поверхности: - внутренняя, где скачок потенциала (∆Ψin) постоянен и определяется раствором НСl внутри стеклянного электрода; - внешняя, где скачок потенциала (∆Ψex) зависит от рН исследуемого раствора. Следовательно, зависит от рН и разность потенциалов, измеряемая в элементе между внутренней и внешней средами.


Билет 2
Релакс. и фор.эффекты
Классификация,схема записи и описание хлорсеребрянного проводника.
6. электрофоретический и релаксационный эффекты.
Релаксационный эффект объясняется тем, что перемещение иона в электрическом поле сопровождается разрушением ионной атмосферы в одном положении иона и образованием ее в другом. Этот процесс происходит не мгновенно, в течение некоторого времени, называемого временем релаксации. В результате ионная атмосфера теряет центральную симметрию и позади движущегося иона возникает избыток заряда противоположного знака. Действующая при этом сила электростатического притяжения тормозит движение иона.
Электрофоретический эффект торможения возникает за счет того, что сольватированная ионная атмосфера, обладая зарядом, противоположным по знаку заряда центрального иона, движется в противоположном направлении. Таким образом, сольватированный центральный ион под действием электрического напряжения не в неподвижной среде, а в среде, перемещающейся ему на встречу, что приводит к снижению его скорости движения.
Силы релаксационного и электрофоретического торможения зависят от ионной силы раствора, природы растворителя и температуры.
14. Электроды II рода. Хлорсеребряный электрод. Электродная реакция, протекающая при работе этого электрода. Схематическая запись и формула Нернста для потенциала хлорсеребряного электрода.
Электродная
реакция, протекающая при работе этого электрода. Схематическая запись и формула
Нернста для потенциала хлорсеребряного электрода.
Электродами второго рода называют сложные
многофазные электроды, формально обратимые как относительно катионов, так и
относительно анионов.
Состоят из металла, труднорастворимой соли этого
металла и второго соединения, хорошо растворимого и содержащего тот же анион,
что и труднорастворимая соль.
Хлорсеребрянный электрод имеет обозначение Ag |
AgCl | KCl. Он представляет собой серебряную проволоку, покрытую слоем AgCl,
опущенную в насыщенный раствор KCl.
ОВ процессом на этом электроде является реакция:
Ag+ +e = Ag0
Ей соответствует электродный потенциал:
EAgCl/Ag = E°Ag+/Ag +
RT/nF·ln aAg+ = E°Ag+/Ag +
RT/nF·ln ПР(AgCl)/aCl- =
E°AgCl/Ag - RT/nF·ln aCl-
Серебряная проволока в электроде контактирует с
пастой, представляющей собой перетёртую смесь малорастворимого соединения AgCl
c жидким KCl.В пасте хлорид серебра диссоциирует на ионы и образует насыщенный
раствор:
AgCl= Ag+ + Cl-
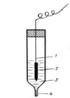
Схема хлорсеребряного электрода:
1. Серебряная проволока
2. Слой AgCl
3. Раствор KCl
4. Микрощель
Билет 3
Молярная электропроводность и факторы, влияющие на неё
Классификация шкал, водородный потенциал
Молярная электропроводность раствора λ есть величина, обратная сопротивлению раствора, содержащего 1 моль растворенного вещества и помещенного между электродами, расположенными на расстоянии 1 см друг от друга. С удельной электропроводностью κ и молярной концентрацией раствора Смолярная электропроводность связана следующим соотношением:
λ = 1000к/С ,Ом-1см2моль-1
Молярная электропроводность как сильных, так и слабых электролитов увеличивается с уменьшением концентрации (т.е. увеличением разведения раствора V = 1/С), достигая некоторого предельного значения λo, называемого молярной электропроводностью при бесконечном разведении

Для слабого электролита такая зависимость молярной электропроводности от концентрации обусловлена в основном увеличением степени диссоциации с разбавлением раствора. В случае сильного электролита с уменьшением концентрации ослабляется взаимодействие ионов между собой, что увеличивает скорость их движения и, следовательно, молярную электропроводность раствора. Последнюю связывает с абсолютными скоростями движения катионов и анионов U+ и U– уравнение Аррениуса:
λ = αF (U+ + U-)
λ = α (λК + λА) [λ] = [см*м2/моль]
2.
Электродами первого рода называют электроды с активной твёрдой или газообразной формой, обратимые либо относительно катионов, либо только относительно анионов.
К ним относятся: металлические электроды, обратимые относительно катионов, металлоидные электроды, обратимые относительно анионов, и газовые электроды, обратимые или по отношению к анионам, или к катионам.
Стандартный водородный электрод — электрод, использующийся в качестве электрода сравнения при различных электрохимических измерениях и в гальванических элементах.
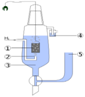 1.
Платиновый электрод.
1.
Платиновый электрод.
2. Подводимый газообразный водород.
3. Раствор кислоты (обычно HCl), в котором концентрация H+ = 1 моль/л.
4. Водяной затвор, препятствующий попаданию кислорода воздуха.
5. Электролитический мост (состоящий из концентрированного р-ра KCl), позволяющий присоединить вторую половину гальванического элемента.
Дописать.
Билет 4
1. Подвижность и гидротация. Скорость движения ионов. Закон Кольрауша.
2. Электроды 1ого рода. Схема записи, реакция, уравнение Нернста
9.
Закон Кóльрауша. Скорость движения и подвижность ионов. Подвижность и
гидратация ионов.
Закон Кольрауша:
В бесконечно разбавленном растворе ионы движутся
независимо один от другого.
Скорость направленного движения иона, т. е. путь,
пройденный ионом в растворе под действием электрического поля в направлении к
электроду за единицу времени, зависит от действующей на ион силы, т. е. от
напряженности электрического поля:
V = иЕ
где V — скорость движения иона, м/с;
Е - напряженность поля, В/м;
и - коэффициент пропорциональности, называемый
электрической подвижностью иона или просто подвижностью иона, м2/(В • с).
ПОДВИЖНОСТЬ ИОНА характеризует его способность
преодолевать сопротивление среды при направленном движении в электрическом поле.
Заряд и радиус иона, т. е. его природа: чем
больше заряд и чем меньше радиус иона, тем сильнее гидратируется ион, тем ниже
подвижность иона в растворе.
Природа растворителя, его диэлектрическая
проницаемость и вязкость. Чем полярнее растворитель, тем больше размеры
гидратированного иона и меньше его подвижность. Вязкость растворителя
обуславливает сопротивление среды движущемуся иону: чем больше вязкость, тем
меньше подвижность иона.
Температура раствора. При повышении температуры
уменьшаются вязкость растворителя и толщина сольватных оболочек ионов, а также
снижается межионное взаимодействие. Все это приводит к увеличению подвижности
ионов.
Ионная сила раствора. Чем больше ионная сила
раствора, тем сильнее межионное электростатическое взаимодействие и создаваемые
им тормозящие эффекты.
Концентрация ионов. Чем больше концентрация
ионов в растворе, тем сильнее электростатическое взаимодействие ионов,
снижающее их подвижность. Концентрация ионов зависит от силы электролита и его
количества в растворе. При разбавлении растворов сильных электролитов
подвижность соответствующих ионов растет, поскольку уменьшается их
концентрация, а следовательно, снижается межионное взаимодействие в растворе. В
растворах слабых электролитов (обычно а < 0,03) подвижность ионов
практически не зависит от разбавления, так как концентрация ионов в этих
растворах всегда невелика.
Сольватация (гидратация) иона увеличивает его
размер и снижает его подвижность.Чем выше диэлектрическая проницаемость
(полярность) растворителя, тем сильнее сольватируется ион; при этом
увеличиваются его размеры и понижается подвижность.
Предельная подвижность ионов зависит его
природы, от природы растворителя и температуры, но не зависит от природы
другого иона в данном электролите.
2.------------------
Электродами первого рода называют электроды с активной твёрдой или газообразной формой, обратимые либо относительно катионов, либо только относительно анионов.
К ним относятся: металлические электроды, обратимые относительно катионов, металлоидные электроды, обратимые относительно анионов, и газовые электроды, обратимые или по отношению к анионам, или к катионам.
(обратимость относительно тех или иных ионов означает зависимость его потенциала от концентрации данных ионов)
( переписать стандартный водородный электрод)
Билет 5
1.Кондуктометрия.Кондуктометрическое титрование
2.Электроды.Электроды 2 рода.Схема записи,процесс происходящий на
электроде.Формула Нернста.
Кондуктометрия - это метод анализа, основанный на измерении электропроводности анализируемого раствора.
Для подобных измерений созданы специальные приборы — кондуктометры.
В основе их — схема из четырех сопротивлений — мост Уитстона (рис. 13.6).
Кондуктометрическое титрование.
а) А этот метод применяется для определения концентрации веществ. Принцип основан на том, что в т.н. критических точках титрования (КТТ) резко меняется зависимость проводимости раствора от количества титранта. Три примера кривых титрования приведены на рис. 13.8.

б) Чтобы
объяснить первую кривую, обратимся к реакции
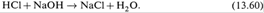
I. При добавлении в ячейку NaOH подвижные ионы H+ связываются с
гидроксил–ионами b заменяются на менее подвижные ионы Na+. Поэтому
электропроводность ячейки снижается и в критической точке титрования (VKTT) она
минимальна.
II.
Но затем, по мере добавления избыточных количеств ионов Na+ и OH-, которые уже
ни с чем не связываются и ничего не замещают, а просто накапливаются в ячейке,
электропроводность, очевидно, опять повышается.
в) При
титровании слабого электролита (рис. 13.8,б) небольшой подъем χ
наблюдается за-долго до VKTT — из-за того, что увеличивается степень
диссоциации электролита. Но после VKTT проводимость начинает возрастать гораздо
быстрей.
2.
Электродом,
называют электронопроводящую фазу (металлы или полупроводники), контактирующую
с ионным проводником (электролитом).
Электродами второго рода называют сложные
многофазные электроды, формально обратимые как относительно катионов, так и
относительно анионов.
Состоят из металла, труднорастворимой соли этого
металла и второго соединения, хорошо растворимого и содержащего тот же анион,
что и труднорастворимая соль.
Хлорсеребрянный электрод имеет обозначение Ag |
AgCl | KCl. Он представляет собой серебряную проволоку, покрытую слоем AgCl,
опущенную в насыщенный раствор KCl.
ОВ процессом на этом электроде является реакция:
Ag+ +e = Ag0
Ей соответствует электродный потенциал:
EAgCl/Ag = E°Ag+/Ag +
RT/nF·ln aAg+ = E°Ag+/Ag +
RT/nF·ln ПР(AgCl)/aCl- =
E°AgCl/Ag - RT/nF·ln aCl-
Серебряная проволока в электроде контактирует с
пастой, представляющей собой перетёртую смесь малорастворимого соединения AgCl
c жидким KCl.В пасте хлорид серебра диссоциирует на ионы и образует насыщенный
раствор:
AgCl= Ag+ + Cl-
6 билет
1. Потенциометрия. Потенциометрическое титрование.
2. Подвижность ионов и гидратация. Скорость движения ионов. Закон Кольрауша.
Измерение ЭДС гальванических элементов в целях физико-химического анализа. Данный подход обозначается как потенциометрия.
Подробней остановимся на потенциометрическом титровании.
а) Это метод, используемый для определения концентрации какого-либо вещества (электролита). – Составляют гальванический элемент; в полуэлемент с исследуемым раствором последовательно добавляют титрант и измеряют каждый раз ЭДС элемента.
б) В критической точке титрования происходит резкое изменение ЭДС.
3. Пример: титрование раствора FeCl3 раствором SnCl2.
определить в растворе концентрацию соли FeCl3. Составим гальванический эле-мент -один электрод водородный, другой — редокс-электрод с изучаемым раствором FeCl3.
до титрования в левом полуэлементе ОВ-пары ещѐ нет, так как имеется только один ее компонент — ионы Fe3+.
в) Начнем добавлять к раствору FeCl3 в данном полуэлементе раствор соли SnCl2 .
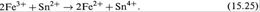
Будет происходить реакция:
Поскольку появятся ионы Fe2+, то образуется пара Fe3+/Fe2+, и измеряемая ЭДС будет определяться соотношением еѐ компонентов:
ΔΨ = Ψ (Fe3+/Fe2+) = Ψ0Fe3+/Fe2+)
+ 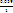 ∙
lg
∙
lg
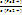 . (15.26,а-б)
. (15.26,а-б)
г) А. По мере добавления SnCl2 отношение c(Fe3+)/c(Fe2+) и, следовательно, ЭДС будет снижаться (ветвь I на рис. 15.7).

Б. В критической точке титрования (КТТ) будет оттитровано всѐ количество Fe3+, так что в растворе останутся только про-дукты реак-ции – ионы Fe2+ и Sn4+, т.е. ОВ-пары в растворе вновь больше нет. Но определить прохождение системой КТТ можно лишь после дальнейшего титрования.
д) А. Действительно, при добавлении очередных порций раствора SnCl2 в системе возник-нет новая ОВ пара – Sn4+/Sn2+, и теперь ЭДС определяется ею (ветвь II на рис. 15.7):
ΔΨ
= Ψ (Sn4+/Sn2+) = Ψ0 (Sn4+/Sn2+) +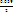 ∙ lg
∙ lg 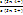 . (15.27,а-б)
. (15.27,а-б)
Б. По мере добавления SnCl2 соотношение c(Fe3+)/c(Fe2+) тоже падает, так что ΔΨ про-должает снижаться.
е) Но теперь критический объѐм титрования (VКТТ) легко определить по точке перегиба кривой – от ветви I к ветви II. Тогда, зная количество соли в этом объѐме, можно найти и количе-ство исчезнувшей соли FeCl3 (оно в 2 раза больше), а значит и концентрацию FeCl3 в исходном растворе.
Заметим, что самомỳ критическому объѐму (VКТТ ) соответствует такое ΔΨ, которое равно среднему арифметическому значению Ψ0 (Fe3+/Fe2+) и Ψ0 (Sn4+/Sn2+).
9.
Закон Кóльрауша. Скорость движения и подвижность ионов. Подвижность и
гидратация ионов.
Закон Кольрауша:
В бесконечно разбавленном растворе ионы движутся
независимо один от другого.
Скорость направленного движения иона, т. е.
путь, пройденный ионом в растворе под действием электрического поля в
направлении к электроду за единицу времени, зависит от действующей на ион силы,
т. е. от напряженности электрического поля:
V = иЕ
где V — скорость движения иона, м/с;
Е - напряженность поля, В/м;
и - коэффициент пропорциональности, называемый
электрической подвижностью иона или просто подвижностью иона, м2/(В • с).
ПОДВИЖНОСТЬ ИОНА характеризует его способность
преодолевать сопротивление среды при направленном движении в электрическом
поле.
Заряд и радиус иона, т. е. его природа: чем
больше заряд и чем меньше радиус иона, тем сильнее гидратируется ион, тем ниже
подвижность иона в растворе.
Природа растворителя, его диэлектрическая
проницаемость и вязкость. Чем полярнее растворитель, тем больше размеры
гидратированного иона и меньше его подвижность. Вязкость растворителя
обуславливает сопротивление среды движущемуся иону: чем больше вязкость, тем
меньше подвижность иона.
Температура раствора. При повышении температуры
уменьшаются вязкость растворителя и толщина сольватных оболочек ионов, а также
снижается межионное взаимодействие. Все это приводит к увеличению подвижности
ионов.
Ионная сила раствора. Чем больше ионная сила
раствора, тем сильнее межионное электростатическое взаимодействие и создаваемые
им тормозящие эффекты.
Концентрация ионов. Чем больше концентрация
ионов в растворе, тем сильнее электростатическое взаимодействие ионов,
снижающее их подвижность. Концентрация ионов зависит от силы электролита и его
количества в растворе. При разбавлении растворов сильных электролитов
подвижность соответствующих ионов растет, поскольку уменьшается их
концентрация, а следовательно, снижается межионное взаимодействие в растворе. В
растворах слабых электролитов (обычно а < 0,03) подвижность ионов
практически не зависит от разбавления, так как концентрация ионов в этих
растворах всегда невелика.
Сольватация (гидратация) иона увеличивает его
размер и снижает его подвижность.Чем выше диэлектрическая проницаемость
(полярность) растворителя, тем сильнее сольватируется ион; при этом
увеличиваются его размеры и понижается подвижность.
Предельная подвижность ионов зависит его
природы, от природы растворителя и температуры, но не зависит от природы
другого иона в данном электролите.














 (zip - application/zip)
(zip - application/zip)










