ФЕДЕРАЛЬНОЕ АГЕНТСТВО ПО РЫБОЛОВСТВУ
Федеральное государственное БЮДЖЕТНОЕ образовательное учреждение
высшего профессионального образования
«МУРМАНСКИЙ ГОСУДАРСТВЕННЫЙ ТЕХНИЧЕСКИЙ УНИВЕРСИТЕТ»
(ФГБОУ ВПО «МГТУ»)
Кафедра химии
КУРСОВАЯ РАБОТА
ПО ДИСЦИПЛИНЕ «ОРГАНИЧЕСКАЯ ХИМИЯ»
СИНТЕЗ И ИДЕНТИФИКАЦИЯ
йодбензола
Выполнил: студент группы Х-2
Федотова Е.В.
Руководитель: к.т.н., доцент
Берестова Г.И.
Мурманск
2016
Оглавление
Введение. 3
Глава I. Обзор литературы.. 4
Йодбензол. Физические свойства. 4
Йодбензол. Химические свойства. 4
Методики синтеза йодбензола. 6
Идентификация йодбензола. 11
Глава II. Экспериментальная часть. 12
Синтез йодбензола. 12
Заключение. 16
Список литературы.. 17
Введение
Йодбензол – органическое вещество, имеющее формулу С6Н5I. Применяется в органическом синтезе. Обладает местным раздражающим действием.
Цель курсовой работы: синтезировать и идентифицировать йодбензол.
Задачи:
1. Изучить все возможные методы синтеза йодбензола.
2. Выбрать наиболее простой способ синтеза йодбензола.
3. Синтезировать йодбензол.
4. Идентифицировать вещество.
Объект изучения: йодбензол.
Предмет изучения: органическая химия.
Курсовая работа состоит из введения, двух глав, заключения и списка литературы.
Глава I. Обзор литературы
Йодбензол. Физические свойства
Йодбензол — бесцветная жидкость со своеобразным эфирным запахом. Нерастворим в воде, хорошо растворим в спирте, эфире, хлороформе. Тпл = 31°С, Ткип = 188,5 °С, показатель преломления 1,8383. Молекулярная масса 204 г/моль, плотность 1,8307 г/см3.
Йодбензол. Химические свойства
1. Электрофильное замещение в йодбензоле происходит с образованием пара- и орто-производных.
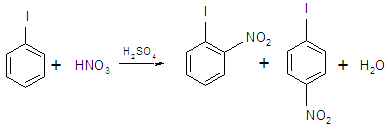
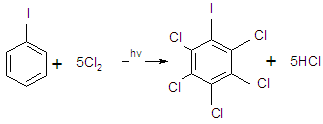
2. При действии на йодбензол жидкого Сl2 на солнечном свету образуются производные от n-хлориодбензола до пентахлориодбензола.
3. Нагревание с I2 в ледяной уксусной кислоте при одновременной обработке SO2 и дымящей HNO3 или NaNO2 и дымящей H2SO4 при 200 °С приводит к n-дииодбензолу.
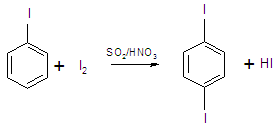
4. При взаимодействии с хлорсульфоновой кислотой при 0 °С - n,n"-дииод дифенилсульфон

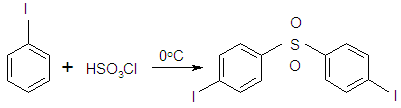
5. Йодбензол - арилирующий агент;
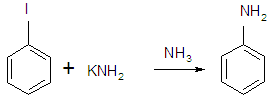
а) реагирует с KNH2 в жидком NH3 с образованием анилина
б) с водяным паром в присутствии активированной H2SiO3 (380 °С) образует фенол
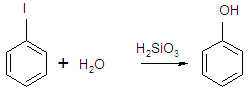
в) с KCN - бензонитрил

6. Легко окисляется
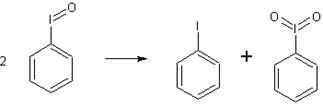
а) Н2О2 или надсерной кислотой до иодозобензола
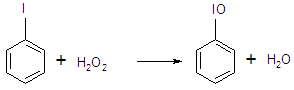
б) озоном до иодилбензола
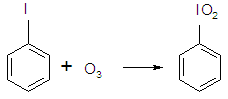
в) При действии хлора в безводной среде образуется С6Н5IСl2.
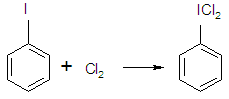
7. Восстанавливается электролитически в спиртовом р-ре NaOH при 70°С в бензол.
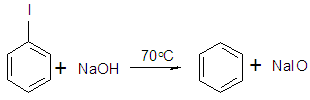
Методики синтеза йодбензола
1. Йодбензол с хорошим выходом получают обработкой кислого раствора соли фенилдиазония йодистым калием:
[C6H5N≡N]+Cl- + KI → C6H5I + KCl + N2
2. Для получения йодбензола прямым путем надо нагревать в запаянной трубке смесь бензола, йода и йодноватой кислоты: йодноватая кислота окисляет йодистый водород до свободного йода.
3. 22 г перхлората серебра и 10 г карбоната кальция смешивают со 100 мл бензола и к суспензии при охлаждении и перемешивании в течение 15 мин добавляют 25 г иода. Смесь фильтруют, трижды промывают водой, высушивают хлористым кальцием и перегоняют.
Выход иодбензола составляет 16 г (80%), т.кип. 184 С.
4. К раствору 5 г анилина в смеси 25 конц. НСl с 75 см3 Н2О постепенно приливают раствор 4 г NaNO2 в 20 см3 Н2О, пока не посинеет иодокрахмальная бумажка. Проба производится спустя пять минут после приливания NaNO2. К смеси приливают раствор 12,5 г KJ в 25 см3 Н2О, 2—3 часа держат в холодной воде и затем нагревают на водяной бане до прекращения выделения азота. После этого прибавляют избыток NaOH и отгоняют C6H5J с водяным паром (трубка, приводящая пар, должна касаться дна колбы). Нижний слой дестиллата отделяют, сушат на СаСl2 и перегоняют с термометром. Т. кип. 189—190°. Выход — 10 г.
В 1-литровую трехгорлую колбу, снабженную механической мешалкой, обратным холодильником и делительной воронкой, помещают 381 г (1,5 мол.) иода и 400 г (455 мл; 5,1 мол.) бензола. Смесь нагревают примерно до 50° на водяной бане, после чего к ней медленно при перемешивании прибавляют через делительную воронку 275 мл (6,15 мол.) азотной кислоты уд. веса 1,50 в течение приблизительно 1 часа 15 минут. При этом происходит обильное выделение окислов азота; их отводят в открытое окно или в вытяжной шкаф при помощи трубки, соединенной с верхним концом холодильника, или же поглощают с помощью специальной ловушки. Реакция идет ровно, и температура медленно повышается без наружного нагревания до тех пор, пока смесь не закипит спокойно. По прибавлении всего количества азотной кислоты смесь кипятят с обратным холодильником в продолжение 15 мин. Если реакционная масса все еще содержит иод, то к теплой смеси следует медленно прибавить еще некоторое количество азотной кислоты до исчезновения пурпурной окраски, обусловленной иодом; жидкость принимает при этом коричневато-красную окраску.
Нижний красноватый маслянистый слой отделяют и смешивают с равным объемом 10%-ного раствора едкого натра; полученную смесь подвергают перегонке с водяным паром из 2-литровой колбы до тех пор, пока не перестанет переходить масло. К концу перегонки в приемнике появляется желтое твердое вещество; оно представляет собою смесь нитросоединений; эту смесь удаляют, энергично взбалтывая дестиллат около 3 час. с 20 мл концентрированной соляной кислоты, 300 мл воды и 200 г железных опилок в 2-литровой колбе, соединенной с обратным холодильником.
Смеси дают охладиться, после чего ее фильтруют. Фильтрат подкисляют соляной кислотой до отчетливо кислой реакции на конго и снова подвергают перегонке с водяным паром. Полученное масло отделяют и перегоняют при атмосферном давлении с дефлегматором. Фракцию, кипящую при 180—190°, перегоняют вторично, собирая чистый йодбензол при 184—186°. Выход: 523— 531 г
5. В 5-литровой колбе приготовляют жидкую пасту из 110 г (0,5 моля) иодозобензола и воды; эту смесь быстро перегоняют с водяным паром до тех пор, пока не отгонится почти весь йодбензол
При этом отгоняется чистый йодбензол, около 46 г, выход 90%. Перегонку не рекомендуется продолжать дольше, чем это необходимо; содержимое колбы следует сразу же охладить. Белое твердое вещество выпадающее в колбе - йодоксибензол.
6. Известны йодирование бензола в среде ССl4 системой I2-C6H5I-(OCOCF3)2 при 20°С (выход йодбензола 72%), йодом в присутствии SbCl5 или тетрафторбората нитрония, а также через таллийорганические соединения (выход 96%):
PhH + Tl(OCOCF3) → PhTl(OCOCF3)2
PhTl(OCOCF3)2 + KI → PhI
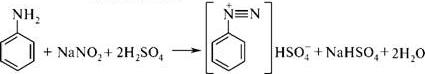
7. В стакан, снабженный термометром и капельной воронкой, помещают 9,9 мл анилина и предварительно приготовленный раствор 11 мл концентрированной серной кислоты в 65 мл воды. Смесь охлаждают до 0 °С в кристаллизаторе со льдом и из капельной воронки, конец которой погружен на 1—2 см в жидкость, постепенно добавляют предварительно приготовленный раствор 7,7 г натрия нитрита в 45 мл воды. Диазотирование проводят при температуре не выше +5 °С. После введения раствора натрия нитрита капельную воронку заменяют механической мешалкой и реакционную смесь перемешивают в течение 1 ч. Избыток азотистой кислоты удаляют добавлением ~2 г мочевины (до прекращения выделения газа).
К раствору соли диазония осторожно приливают предварительно приготовленный раствор 29 г калия йодида в 35 мл воды и смесь выдерживают в течение 1 ч (избыток калия йодида препятствует образованию побочного продукта — фенола). Затем содержимое стакана переносят в круглодонную колбу с обратным шариковым холодильником и нагревают на водяной бане до прекращения выделения азота. Для связывания фенола в виде натрия фенолята (натрия фенолят в отличие от фенола не перегоняется с водяным паром) смесь подщелачивают 10 %-ным раствором натрия гидроксида до сильнощелочной среды по универсальной индикаторной бумаге. Йодбензол отгоняют из этой же колбы с водяным паром до тех пор, пока из холодильника не перестанут стекать маслянистые капли. Дистиллят переносят в делительную воронку и отделяют нижний слой йодбензола от воды в коническую колбу.
Выделение продукта. Сырой йодбензол имеет светло-желтую окраску. Если полученный раствор бурого цвета (наличие свободного йода), то его встряхивают в делительной воронке с небольшим количеством раствора натрия сульфита до осветления и вновь отделяют нижний слой, сушат кальция хлоридом безводным, фильтруют в колбу Вюрца через складчатый фильтр и перегоняют, собирая фракцию с Т = 189—190 °С.
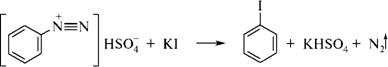
Побочные реакции:
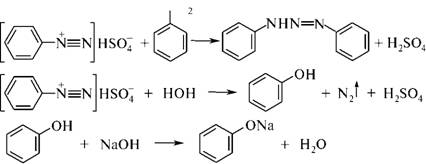
Практический выход: ~21,5 г (98 %).
Идентификация йодбензола
Йодбензол можно идентифицировать по температуре кипения – 188,5°С.
Глава II. Экспериментальная часть.
Синтез йодбензола
Для синтеза йодбензола выбрана четвертая методика, так как она отличается простотой выполнения эксперимента.
Необходимое оборудование: круглодонная колба на 250 мл, стакан на 100 мл – 3 шт., холодильник Либиха, шпатели – 3 шт., мерный цилиндр на 100 мл, стеклянная палочка – 1 шт., термометр на 200°С, весы технохимические, кристаллизатор со льдом, капельная воронка – 2 шт., механическая мешалка, водяная баня, обратный шариковый холодильник, универсальная индикаторная бумага, парообразователь, штатив с лапкой, алонж – 2 шт., колба коническая на 50 мл, колба Вюрца на 50 мл, воронка стеклянная – 1 шт., плитка электрическая, фильтровальная бумага – 1 шт.
Необходимые реактивы: анилин - 9,9 мл, соляная кислота (d = 1,19) - 6,8 мл, нитрит натрия – 7,7 г, йодистый калий - 29 г, серная кислота концентрированная – 11 мл, мочевина – 2 г, вода дистиллированная, гидроксид натрия 10%-ный, сульфит натрия, кальция хлорид.
Механизм реакции:
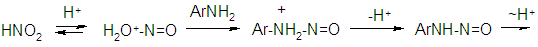
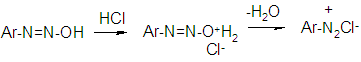
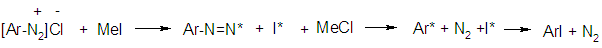
Количественные расчеты
Расчет теоретической массы йодбензола:

 m(С6H5I) - ?
m(С6H5I) - ?
m(NaNO2) = 7,7 г
V(C6H5NH2) = 9,9 мл
Решение
M(NaNO2) = 69 г/моль
M(C6H5NH2) = 93 г/моль
М(С6H5I) = 204 г/моль
р(C6H5NH2) = 1,02 г/см3
m(C6H5NH2) = p ∙ V = 1,02∙9,9 = 10,098 г
n(C6H5NH2) = 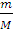 =
=  = 0,11 моль
= 0,11 моль
n(NaNO2) = 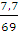 = 0,11 моль
= 0,11 моль
n(C6H5N2) = 0,11 моль
n(C6H5I) = 0,11 моль
m(C6H5I) = n ∙ M = 0,11∙204 = 22,44 г
Теоретическая масса йодбензола – 22,44 г.
Ход работы
Приготовили растворы серной кислоты (11 мл концентрированной серной кислоты в 65 мл воды), йодида калия (29 г калия йодида в 35 мл воды) и нитрита натрия (7,7 г натрия нитрита в 45 мл воды) стакан, снабженный термометром и капельной воронкой, поместили 9,9 мл анилина и раствор серной кислоты. Выпал белый осадок. Смесь охладили до 0 °С в кристаллизаторе со льдом и из капельной воронки, конец которой погрузили на 1—2 см в жидкость, постепенно добавляли раствор нитрита натрия. Реакция протекала очень быстро и бурно, в результате осадок растворился и получился раствор оранжевого цвета. Диазотирование проводили при температуре не выше +5 °С. После введения раствора натрия нитрита, капельную воронку заменили механической мешалкой и реакционную смесь перемешивали в течение 1 ч. Избыток азотистой кислоты удалили добавлением ~2 г мочевины (до прекращения выделения газа).
К раствору соли диазония прилили предварительно раствор йодида калия и смесь выдерживали в течение 1 ч (избыток калия йодида препятствует образованию побочного продукта — фенола). Выделялся газ. Раствор стал маслянистым. Затем содержимое стакана перенесли в круглодонную колбу с обратным шариковым холодильником и нагревают на водяной бане до прекращения выделения азота. Раствор стал розовым. Для связывания фенола в виде натрия фенолята (натрия фенолят в отличие от фенола не перегоняется с водяным паром) смесь подщелачили 10 %-ным раствором натрия гидроксида до сильнощелочной среды по универсальной индикаторной бумаге. Раствор стал коричневым. Йодбензол отгоняли с водяным паром до тех пор, пока из холодильника не перестали стекать маслянистые желтые капли. Дистиллят перенесли в делительную воронку и отделили нижний слой йодбензола от воды в коническую колбу. Высушили хлоридом кальция.
Расчет выхода продукта:
φ = 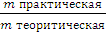
|
Выход от теоретического значения |
Выход от значения, указанного в методике |
|
φ = |
φ = |
Потери вещества объясняются выплескиванием реакционной смеси на начальном этапе синтеза. Также вещество осталось на стенках посуды.
Техника безопасности при выполнении работы
1. Работа строго в вытяжном шкафу
2. Работа с растворами веществ
3. Работа с концентрированной кислотой.
Заключение
1. В ходе курсовой работы были изучены методы получения йодбензола. Существуют семь методов, с помощью которых можно осуществить этот синтез.
2. Был выполнен синтез органического соединения C6H5I с выходом продукта φ = 30%.
Список литературы
1. Хлорная кислота и ее соединения в органическом синтезе / Н.В. Дорофеенко, Ю.А. Жданов, В.И. Дуленко, С.В. Кривун - Издательство Ростовского Университета, 1965 .- 256 с.
2. Практикум по органической химии: Органический синтез / С.С. Гитис, А.И. Глаз, А.В. Иванов. - М.: Высшая школа, 1991 .- 326 с.
3. Реформатский С.Н. Начальный курс органической химии / С.Н. Реформатский. - М.-Л.: ГИ, 1930 .- 453 с.
4. Синтезы органических препаратов. - Ч. 1. - М., 1949 стр. 220-222
5. Синтезы органических препаратов. - Ч. 3. - М., 1952 стр. 261-262
6. Органическая химия в 4 томах. Для студентов вузов по направлению и специализации / А.П. Реутов, К.П. Курц, К.П. Бутин., М.: Бином, 2004 .- 645с.
7. Химический энциклопедический словарь. - М.: 1983. Т. 5.
8. Органическая химия / А.А. Петров, Х.В. Бальян, К.Г. Трощенко .- СПб.: Иван Федоров, 2005 .- 565с.














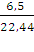 = 0,29
= 0,29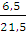 = 0,30
= 0,30 (zip - application/zip)
(zip - application/zip)










