Федеральное государственное образовательное учреждение
высшего профессионального образования
«Казанский Национальный Исследовательский Технологический Университет»
Кафедра «Физическая и коллоидная химия»
Тема реферата:
«Золь-гель метод, получение дисперсных оксидов, гидроксидов и нанокомпозитов».
Выполнила: ст. гр.512-М2,
Заскокина Л.О.
Проверила: к.х.н., доц. ФКХ
Эбель А.О.
Казань, 2012 г.
Содержание:
Введение................................................................................
..............................стр.2
Золь-гель технология
Гидролиз и конденсация…………………………………………………...стр.3
Гелеобразование……………………………………………………………стр.5
Старение…………………………………………………………………….стр.6
Сушка………………………………………………………………………..стр.6
Спекание…………………………………………………………………….стр.6
Разнообразие материалов, полученных по золь-гель технологии…….стр.7
Вывод………………………………………………………………………….стр.14
Список литературы………………………………………………………….стр.15
Введение
Широкое распространение получили методы синтеза неорганических
материалов из специально приготовленных коллоидных растворов на основе оксидов или реже – сульфидов металлов. Впервые этот метод был использован Эбелманом еще в 1846 г для получения силикагеля, и с тех пор находит все более широкое применение для получения как простых, так и сложных оксидов [1].
Золь – двухфазная система, состоящая из коллоидных частиц, распределенных в жидкости.
Гель - взаимосвязанная твердая трехмерная сетка с порами субмикронного размера, заполненными жидкостью (гидрогель) или газом(ксе-рогель).Если жидкость в порах представляет собой воду, то используют термин аквагель, а в случае заполнения спиртом - алкогель. Общий термин гель часто применяется к различным типам гелеобразных ультрапористых структур, а полученный путем гиперкритической сушки низкоплотный гель называют аэрогелем. геле. Например, углекислый газ при очень мягких условиях можно перевести в жидкое состояние, в котором он замещает в структуре геля воду, а после перевода CO2 в сверхкритическое состояние (опять-таки, при гораздо более мягких условиях по сравнению с критической точкой воды) происходит его удаление из объема геля. При этом практически сохраняется объем и форма исходного «мокрого» геля, и поэтому такой материал (аэрогель) является рекордсменом среди самых легких материалов. Его плотность достигает всего 0.3-0.03 г/см3 , он во много раз легче пуха и при этом характеризуется вполне приличнымип рочностными характеристиками . Гель считается сухим, когда физически адсорбированная вода полностью удалена из его тела. Это происходит при температурах от 100 до 180 °С.
Золь-гель технология – технология получения пористых или монолитных химических продуктов, в частности, на основе микроаморфных кремнеземов (стекол, ксерогелей, порошков, пленок или волокон).
Золь-гель технология
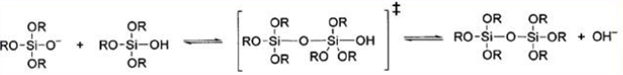
Гидролиз и конденсация
Реакция гидролиза может протекать при кислотном (НСL, HNO3, CH3 COOH), либо основном (NH4 OH) катализе, причем в результате получаются разные продукты. Катализатор влияет не только на скорость гидролиза [2], но и на структуру продукта поликонденсации: в кислой среде образуются линейные полимеры, в основной - разветвленные кластеры [3].Наиболее простой системой является трехкомпонентная система ТЭОС -вода - этанол, характеризующаяся областью несмешиваемости. Это определяет выбор концентраций компонентов для получения гомогенного раствора.
Гидролиз в кислой среде: 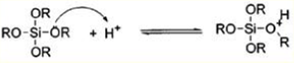
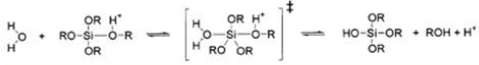
Гидролиз в щелочной среде:
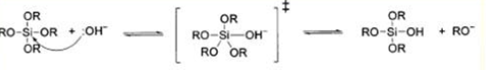
Поликонденсация в кислой среде:
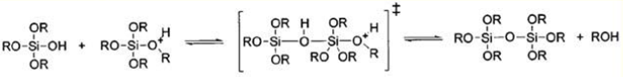
Поликонденсация в щелочной среде:

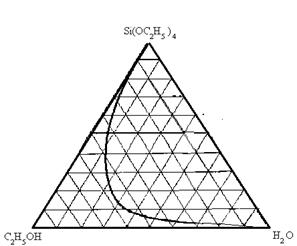
Основным условием распределения компонентов друг в друге на молекулярном уровне является взаимная растворимость всех реагентов, промежуточных соединений и продуктов реакции. При этом следует иметь в виду нерастворимость тетраэтилортосиликата в воде и ограниченную его растворимость в тройной системе ТЭОС – этанол – вода (рис.1). Поэтому для успешного протекания процессов гидролиза и поликонденсации необходимо в систему вводить определенное количество этанола, обеспечивающего взаимную растворимость ТЭОСа и воды. Установлено, что оптимальными соотношениями [ТЭОС] / [C2H5OH] при получении монолитных ксерогелей и стекол являются 1:1 и 1:2 [4]. Однако необходимо заметить, что добавление этилового спирта в больших количествах приводит к нежелательным эффектам при сушке гелей, а именно – увеличивает вероятность растрескивания за счет бурного выделения паров спирта из пористой структуры и уменьшает общую концентрацию твердых частиц в теле геля, что приводит к большим усадкам и растрескиванию гелей.
|
|
| Рис.1. Диаграмма растворимости системы ТЭОС-этанол-вода. |
Вопрос о механизме перехода “золь-гель”, о происходящих при этом процессах и структурных перестройках принадлежит к числу наиболее сложных и малоизученных. Этот переход завершается, когда однофазная жидкость превращается в двухфазный гель, состоящий из твердой и жидкой фаз, который может быть превращен в двухфазный ксерогель [5]. Переход необратим и протекает без изменения объема, он проявляется в росте вязкости. Полагают, что при росте полимеров в растворе в результате реакции конденсации они соединяются в кластеры все большего размера, пока весь раствор не превращается в один кластер. Считают, что при росте полимеров в растворе в результате реакции конденсации они соединяются в кластеры все большего размера, пока весь раствор не превратиться в один кластер.
Гелеобразование
На данной стадии происходит формирование пространственной сетки геля. При этом наблюдается резкое увеличение вязкости раствора.
В кислой среде гидролиз протекает быстрее, чем поликонденсация. Поэтому на начальных стадиях преимущественно образуются цепи, затем происходит разветвление цепей и их поперечное связывание. В щелочной среде образуются крупные сферические частицы.
Были оптимизированы важные параметры [6]:
| Параметр | Вынужденное изменение | Диапазон | Оптимальное условие |
| pH | Изменение скорости реакций гидролиза и конденсации | pH 1 - 7 | 2 – 3 Если значение рН слишком высокое (> рН 3.5), при добавлении воды начальный раствор мутный, а время гелеобразования - быстрое |
| Температура золя | Гидролиз и конденсация протекают быстрее | 18-100 °C | 50 °C Образцы загущаются быстрее (несколько дней) |
| Время старения | При длительном времени старения, меньше шансов растрескивания | 1 - 20 дней | 2 дня Процесс старения может помочь, но время и температура сушки являются более важными |
| Объем образца | При большом объеме – время сушки дольше, а толщина слоя - длиннее | 0.25-20 мл | 4 мл Этот объем необходим для сохранения малого времени сушки, но в то же время толщина слоя должна быть длиннее |
| Температура сушки | Образцы сохнут быстрее | 18-100 °C | 18 ° C Все образцы, которые сушили при повышенных температурах, потрескавшиеся |
| Время сушки | При медленной сушке образуется меньше трещин | 1 час-6 мес. | > 45 дней для 4 мл золя Необходимо длительное время сушки. |
Старение геля
Происходит уплотнение структуры геля сжимание сетки и выделение из геля растворителя. Данная стадия может протекать несколько суток.
Сначала в системе образуются отдельные частицы оксида кремния. Затем протекает их коалесценция с образованием больших пористых структур. Первоначально в материале образуется малое количество пор с большим диаметром. По мере протекания синерезиса геля количество пор возрастает при этом поры становятся более тонкими [7].
Сушка
Сушка геля, которая может проводиться как при комнатной температуре, так и при нагревании, приводит к удалению из него воды, спирта, органических остатков, что проявляется в уменьшении массы и объема (усадке) геля и в изменении его плотности (рис.2). [8]
|
|
| Рис.2. Структуры, образующиеся при сушке геля. |
Определение сухого геля, затруднено, поскольку гели не остаются инертными после сушки. Так, они обнаруживают обратное поглощение влаги при нагреве до 150оС и увеличение удельной поверхности до максимума около 300оС [9]. Испарение жидкости приводит к образованию пор, в которых возникают капиллярные напряжения, растущие с уменьшением размера пор и при наличии пор различного диаметра. Эти напряжения приводят к растрескиванию геля, уменьшающемуся с повышением прочности его структурной сетки [10].
В процессе сушки гелей можно выделить следующие этапы:
1. удаление легколетучих растворителей и продуктов реакции гидролиза;
2. удаление свободной воды;
3. формирование системы взаимосвязанных пор.
Спекание
Распределение пор по размерам показывает, что поры в высушенных образцах гелей имеют в основном переходный характер в интервале от 5 до 25 нм .
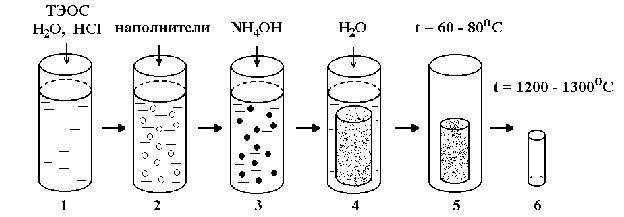
Разнообразие материалов, полученных по золь-гель технологии
Для получения волокон и нанопленок используют полимерный гель. Если необходимо получить волокна, то его (гель) продавливают через фильеры и одновременно сушат, в результате чего удаляется растворитель. Для получения покрытий (пленок) полимерный гель наносят на поверхность твердого носителя и сушат. Если полимерный гель просто высушивать при комнатной температуре, то удаление растворителя приведет к возникновению и преобладанию сил капиллярного давления, что, в свою очередь, станет причиной деформации трехмерной структуры геля в результате возникновения в ней напряжений. В результате может образоваться стеклообразный, пористый или компактный продукт. Если растворитель из геля удалять при температуре и давлении выше критических
(в автоклаве), то капиллярное давление минимизировано; в этом случае образуется аэрогель – аморфное вещество, проявляющее некоторые уникальные свойства, такие как высокая площадь внутренней поверхности, высокая пористость, низкая плотность и низкая электропроводность [11].
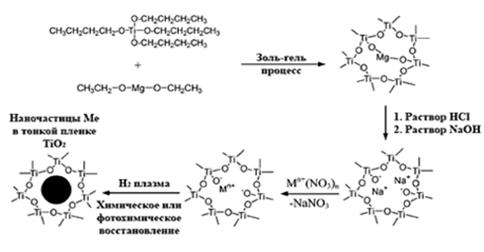
При использовании золь гель метода можно синтезировать различные типы нанокомпозитов. Например, схема процесса синтеза нанокомпозита типа неорганика-неорганика показана на рис.3.
|
|
| Рис.3.Схема синтеза нанокомпозита неорганика-неорганика золь гель методом. |
«Застывший воздух». Микрофотографии (рис.4-5) образца аэрогелей TiO2 (анатаза), синтезированных золь-гель методом с последующей сверхкритической сушкой. (a)- сразу после получения, без отжига; (б) – после отжига при 550 С на воздухе (сканирующая электронная микроскопия).
|
|
| Рис.4. (a)- сразу после получения, без отжига; (б) – после отжига при 550 С на воздухе (сканирующая электронная микроскопия). |
|
| Рис.5. Слева - микрофотография композитного аэрогеля 5%ZnO/TiO2(просвечивающая электронная микроскопия), на вставке представлено дифракционное изображение, полученное расчетным методом. Справа – изображение просвечивающей электронной микроскопии высокого разрешения вдоль плоскостей |
«Винчестер 22 века». Нанокомпозит «мезопористый диоксид кремния – железо». Ферромагнитные нанонити образуются внутри пор при пропитке матрицы карбонилом железа с последующей фотохимической, а затем и термической обработкой в атмосфере водорода (рис.6).
|
|
| Рис.6.Вид с «торцов» пор мезопористой матрицы SiO2 - слева, вид вдоль продольного сечения мезопор - справа (просвечивающая электронная микроскопия). |
Был получен мезопористый диоксид кремния с квазиупорядоченной гексагональной решеткой пор варьируемого диаметра от 3 до 7 нм. В таком ансамбле одномерных нанореакторов достигнута высокая степень заполнения пор анизотропными наночастицами железа c температурой блокировки выше комнатной, то есть фактически ферромагнитной нанопроволокой. Систематический контроль условий получения привел к рекордным для данного класса материалов значениям коэрцитивной силы и намагниченности насыщения, делающих полученные образцы носителем информации нового поколения со сверхвысокой плотностью записи.
«Морской наноёж». Каталитически активный нанокомпозит «алюмосиликат – серебро». Мезопористые алюмосиликаты, имеющие аналогичную мезопористую структуру, можно получить, если часть атомов кремния в аморфном SiO2, из которого состоят стенки пор, заместить на атомы алюминия. Получающаяся при этом матрица будет обладать отрицательным зарядом, скомпенсированным протонами, находящимися в порах, и аналогично цеолитам проявлять ионообменные свойства. Благодаря этому протоны можно заменить на катионы какого-либо металла, а затем после восстановления получить наночастицы этого металла. В чистой силикатной матрице и при низком содержании алюминия в матрице происходит формирование нитевидных частиц серебра в порах; при росте же соотношения Si:Al наночастицы серебра образуются на поверхности алюмосиликата, по-видимому, из-за увеличения количества кислотных центров и миграции атомов серебра по ним (рис.7).
|
|
| Рис.7. Микрофотография нанокомпозита «алюмосиликат-серебро»(просвечивающая электронная микроскопия). |
Особый интерес вызывают проблемы синтеза нанокомпозитных материалов, полученных золь-гель методом, из-за значительного влияния примесей РЗЭ, их кластеров и агломератов наночастиц на оптические, спектрально люминесцентные и технические характеристики. Разработана технологическая схема золь-гель синтеза оптически прозрачных пористых и монолитных кремнеземных матриц, содержащих фосфатно-лантаноидные комплексы (рис.8).
|
|
| Рис.8. Схема золь-гель синтеза люминесцирующих материалов |
Для создания гомогенных силикатных матриц с оптимальными параметрами (формирование цельных гельных заготовок, получение заданной пористости ксерогеля, оптическое качество стекла и т.п.) определяющую роль играет тип и количество вводимого твердого наполнителя – порошка SiO2 (аэросила) со средним размером зерна в водной суспензии порядка 5–15 нм [12]. Основная отличительная черта аэросилов – высокая удельная поверхность. Экспериментально определено оптимальное мольное отношение Н2О/аэросил. Оно составляет порядка 20. При отношении Н2О/аэросил ? 15 мольное отношение аэросил/вода в золе составляло порядка 1/30.
Фосфатно-лантаноидные комплексы вводятся в коллоидную систему на стадии 2 – перед УЗ активацией с механическим перемешиванием с помощью фторопластовой мешалки. После этапа центрифугирования плотность всех золей находилась в пределах 1,04–1,05 г/см . Время хранения золей в холодильнике (Т = + 30 С) до перехода в состояние геля (твердой фазы, получающейся в результате полимеризации продуктов гидролиза ТЭОС) составляло около 18–21 дня.
Термическая обработка прекурсоров сопровождается выгоранием органических частей молекул и к образованию кластеров фосфатов редкоземельных элементов, гомогенно распределенных в матрице кварцевого стекла . Размер этих кластеров можно оценить исходя из данных по малоугловому рассеянию рентгеновского излучения на синтезированных стеклах. Средний размер обнаруживаемых неоднородностей равен 2–4 нм.
В случае кремнеземных стекол, синтезированных путем простого введения солей лантаноидов в золь-гель систему, размер неоднородностей увеличивается до 5–7 нм.
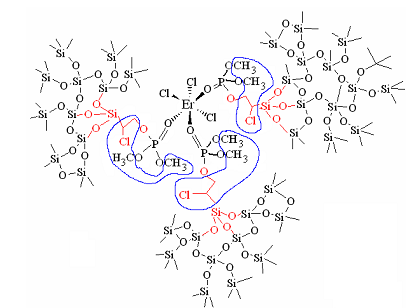
Для рассматриваемой системы может быть применима модель пространственного гибрида, построенного на принципах взаимопроникающих структур, органическая сетка которых образована молекулами, связанными системой сопряженных кратных связей [13] (рис.9).
|
|
| Рис.9. Органо-неорганический гибрид в системе трис(триалкилфосфатный) комплекс эрбия – кремнезем |
Полученные разработанным способом введения в золь-гель систему золей оксидов РЗЭ позволили получить экспериментальные образцы нанокомпозитных стекол, допированных эрбием и иттербием, которые обладают интенсивной люминесценцией в инфракрасной области спектра (λизл =1,5 мкм) в широком интервале концентраций лантаноидов (0,1–1 мас. %).
Вывод
Метод довольно прост и не требует сложного оборудования, при этом он позволяет получить нанопорошки как простых, так и сложных оксидов с размером зерен в единицы, а также пленки, волокна нанометровой толщины, высокопористые твердые вещества.
Список литературы
1. Yu.V. Kolen’ko, A.V. Garshev, B.R. Churagulov, S. Boujday, P. Portes, C. Colbeau-Justin. Photocatalytic activity of sol-gel derived titania converted into nanocrystalline powders by supercritical drying. J.Photochem.Photobiol. A: Chemistry, 2005, V. 172, P. 19-26.
2. Гусев А.И. Нанометриалы, наноструктуры, нанотехнологии. – М:ФИЗМТЛИТ, 2005. – 416 с.
3. Труды комплексной экспедиции по изучению водоемов Полесья / Под ред. Г.Г. Винберга. – Минск: БГУ, 1956. – С.
4. Радзимовський Д.О., Полiщук В.В. Планктон рiчкi Прип,ять. – Киiв, 1970. – 211 с.
5. Рассашко И.Ф., Савицкий Б.П. Зоопланктон водоемов и водотоков Белорусского Полесья (банк данных за 1888-1985 гг.)/Деп. в ВИНИТИ 22.02.89, №1178-В89.– Гомель, 1989. – 125 с.
6. Коловратки (Rotifera) в водных экосистемах Беларуси. Каталог / Г.А. Галковская и др. – Мн.: БГУ, 2001. – 184 с.
7. Driesen, K., Binnemans, K. and Gorller-Walrand, C., "Spectroscopic properties of monolithic sol-gel glasses doped with lanthanide bipyridyl complexes", Materials Science and Engineering C, 18 (2001)
8. Шабанова Н.А., Саркисов П.Д. Основы золь-гель технологии нанодисперсного кремнезема. М.: ИКЦ «Академкнига», 2004, 208 с.
9. Мониторинг, использование и управление водными ресурсами бассейна р. Припять / С.А. Афанасьев, Г.М. Тищиков. – Минск, 2003. – С. 191-209.
10. Рассашко И.Ф., Ковалева О.В. Планктонные сообщества, использование показателей их структурной организации при биоиндикации (на примере реки Сож – крупного притока Днера). – Гомель, 2004. – 312 с.
11. Состояние природной среды Беларуси: Экологический бюллетень 2002 г. – Минск, 2003. – 248 с.
12. Химич Н.Н. и др. Золь-гель синтез оптического кварцевого стекла, активированного РЗЭ // Физ. и хим. стекла. – 2007. – Т. 33, № 2. – С. 210–215.
13. Химич Н.Н. и др. Синтез и оптические свойства наногибридов в системе кремнезем – триамидофосфатные комплексы лантаноидов // ЖПХ. – 2006. – Т. 79, № 11. – С. 1789–1794.



















 (zip - application/zip)
(zip - application/zip)










