Содержание:
Энтропия:
Определение
Энтропия в термодинамике
Энтропия в неравновесной термодинамике
Второе начало термодинамики
Формулировки
Используемая литература
Энтропи́я(от др.-греч. ἐντροπία - поворот, превращение) — в естественных науках мера беспорядка системы, состоящей из многихэлементов. В частности, в статистической физике — мера вероятности осуществления какого-либо макроскопического состояния; втеории информации — мера неопределённости какого-либо опыта (испытания), который может иметь разные исходы, а значит, и количество информации; в исторической науке, для экспликации феномена альтернативности истории (инвариантности ивариативности исторического процесса).
Энтропия в информатике — степень неполноты, неопределённости знаний.
Понятие энтропии впервые было введено Клаузиусом в термодинамике в 1865 году для определения меры необратимого рассеивания энергии, меры отклонения реального процесса от идеального. Определённая как сумма приведённых теплот, она является функцией состояния и остаётся постоянной при обратимых процессах, тогда как в необратимых — её изменение всегда положительно.
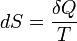 ,
,
где 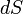 — приращение энтропии;
— приращение энтропии; 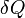 — минимальная теплота, подведенная к системе; T — абсолютная температура процесса;
— минимальная теплота, подведенная к системе; T — абсолютная температура процесса;
Энтропия в термодинамике была введена Р. Клаузиусом (R. Clausius, 1865) на основе второго начала термодинамики, к-рое можно сформулировать математически в виде Клаузиуса неравенства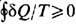 . Интеграл берётся по замкнутому циклич. процессу, при к-ром система получает (или у неё отбирают) малые количества теплоты dQ при соответствующих значениях абс. темп-ры Т. Знак равенства относится к обратимым процессам (р а в е н с т в о К л а у з и у с а). Из равенства Клаузиуса следует, что для обратимого процесса
. Интеграл берётся по замкнутому циклич. процессу, при к-ром система получает (или у неё отбирают) малые количества теплоты dQ при соответствующих значениях абс. темп-ры Т. Знак равенства относится к обратимым процессам (р а в е н с т в о К л а у з и у с а). Из равенства Клаузиуса следует, что для обратимого процесса

есть полный дифференциал ф-ции состояния S, называемый Э. (дифференциальное определение Э.). Разность Э. системы в двух произвольных состояниях А и В (заданных, напр., значениями темп-р и объёмов) равна

(интегральное определение Э.). Интегрирование здесь ведётся вдоль пути любого квазистатич. обратимого процесса, связывающего состояния А и В. Т. о., из второго начала термодинамики следует, что существует однозначная ф-ция состояния S,к-рая при обратимых адиабатич. процессах (dQ =0) остаётся постоянной. Из неравенства Клаузиуса вытекает, что при необратимых процессах

поэтому в адиабатически изолированных системах (см. Термодинамическая система )при необратимых процессах Э. может только возрастать (закон возрастания Э.).
Согласно первому началу термодинамики,
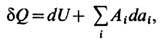
т. е. сообщаемое системе кол-во теплоты равно сумме приращения внутренней энергии dU и совершаемой системой элементарной работы, где а i - внеш. параметры состояния, Ai - сопряжённые им внутр. параметры. Когда единственным внеш. параметром является объём системы V, элементарная работа равна pdV, где р- давление. С учётом первого начала термодинамики дифференциальное определение Э. принимает вид
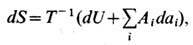
откуда следует, что Э. представляет собой потенциал термодинамический при выборе в качестве независимых переменных внутр. энергии U и внеш. параметров а i . Частные производные Э.

определяют уравнения состояния системы. Уравнение (3) определяет абсолютную температурную шкалу.
Ф-ла (2) определяет Э. лишь с точностью до аддитивной постоянной (т. е. оставляет начало отсчёта Э. произвольным). Абс. значение Э. можно установить с помощью третьего начала термодинамики, согласно к-рому принимается S= 0 при Т=0.
Энтропия в неравновесной термодинамике может быть определена для таких неравновесных состояний, когда можно ввести представление о локальном равновесии термодинамическом в отд. подсистемах (напр., в малых, но мак-роскопич. объёмах). По определению, Э. неравновесной системы равна сумме Э. её частей, находящихся в локальном равновесии. Термодинамика неравновесных процессов позволяет более детально исследовать процесс возрастания Э. и вычислить кол-во Э., образующееся в единице объёма в единицу времени вследствие отклонения от тер-модинамич. равновесия - производство энтропии. Для пространственно неоднородных неравновесных систем второе начало термодинамики может быть записано в виде у р а в н е н и я б а л а н с а д л я п л о т н о с т и
э н т р о п и и S(x, t), где х - радиус-вектор физически бесконечно малого элемента среды:
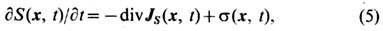
JS(x, t) - вектор потока Э.; s(x,t)>=0-л о к а л ь н о е п р ои з в о д с т в о э н т р о п и и. Полное производство Э. равно интегралу от s( х, t )по объёму системы. Если т е р м о д ин а м и ч. с и л ы Xi(x, t )(градиенты темп-ры, хим. потенциалов компонентов, массовой скорости и т. д.) создают в системе сопряжённые им потоки Ji (x, t )(теплоты, вещества, импульса и др.), то в такой системе  . Если величины Xi , Ji - векторы или тензоры, то в выражении для s подразумевается их полная свёртка. Потоки Ji связаны с термодинамич. силами Xk линейными соотношениями
. Если величины Xi , Ji - векторы или тензоры, то в выражении для s подразумевается их полная свёртка. Потоки Ji связаны с термодинамич. силами Xk линейными соотношениями 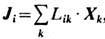 , где Lik- онсагеровские кинетические коэффициенты. Следовательно, локальное производство Э.
, где Lik- онсагеровские кинетические коэффициенты. Следовательно, локальное производство Э. 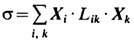 выражается квадратичной формой от
выражается квадратичной формой от
термодинамич. сил.
В 1877 году Людвиг Больцман установил связь энтропии с вероятностью данного состояния. Позднее эту связь представил в виде формулы Макс Планк:
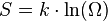
где константа 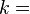 1,38·10−23 Дж/К названа Планком постоянной Больцмана, а
1,38·10−23 Дж/К названа Планком постоянной Больцмана, а  — статистический вес состояния, является числом возможных микросостояний (способов) с помощью которых можно перейти в данное макроскопическое состояние. Этот постулат, названный Альбертом Эйнштейном принципом Больцмана, положил начало статистической механике, которая описывает термодинамические системы, используя статистическое поведение составляющих их компонентов. Принцип Больцмана связывает микроскопические свойства системы (
— статистический вес состояния, является числом возможных микросостояний (способов) с помощью которых можно перейти в данное макроскопическое состояние. Этот постулат, названный Альбертом Эйнштейном принципом Больцмана, положил начало статистической механике, которая описывает термодинамические системы, используя статистическое поведение составляющих их компонентов. Принцип Больцмана связывает микроскопические свойства системы ( ) с одним из её термодинамических свойств (
) с одним из её термодинамических свойств (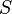 ).
).
Рассмотрим, например, идеальный газ в сосуде. Микросостояние определено как позиции и импульсы (моменты движения) каждого составляющего систему атома. Связность предъявляет к нам требования рассматривать только те микросостояния, для которых: (I) месторасположения всех частей расположены в рамках сосуда, (II) для получения общей энергии газа кинетические энергии атомов суммируются.
Согласно определению, энтропия является функцией состояния, то есть не зависит от способа достижения этого состояния, а определяется параметрами этого состояния. Так как  может быть только натуральным числом (1, 2, 3, …), то энтропия Больцмана должна быть неотрицательной — исходя из свойств логарифма.
может быть только натуральным числом (1, 2, 3, …), то энтропия Больцмана должна быть неотрицательной — исходя из свойств логарифма.
Второе начало термодинамики — физический принцип, накладывающий ограничение на направление процессов передачи тепла между телами.
Второе начало термодинамики запрещает так называемые вечные двигатели второго рода, показывая, что коэффициент полезного действия не может равняться единице, поскольку для кругового процесса температура холодильника не может равняться абсолютному нулю.
Второе начало термодинамики является постулатом, не доказываемым в рамках термодинамики. Оно было создано на основе обобщения опытных фактов и получило многочисленные экспериментальные подтверждения.
Формулировки
Существуют несколько эквивалентных формулировок второго начала термодинамики:
Постулат Клаузиуса: «Невозможен процесс, единственным результатом которого являлась бы передача тепла от более холодного тела к более горячему»[1] (такой процесс называется процессом Клаузиуса).
Постулат Томсона (Кельвина): «Невозможен круговой процесс, единственным результатом которого было бы производство работы за счет охлаждения теплового резервуара» (такой процесс называется процессом Томсона).
Эквивалентность этих формулировок легко показать. В самом деле, допустим, что постулат Клаузиуса неверен, то есть существует процесс, единственным результатом которого была бы передача тепла от более холодного тела к более горячему. Тогда возьмем два тела с различной температурой (нагреватель и холодильник) и проведем несколько циклов тепловой машины, забрав тепло 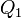 у нагревателя, отдав
у нагревателя, отдав 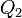 холодильнику и совершив при этом работу
холодильнику и совершив при этом работу 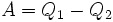 . После этого воспользуемся процессом Клаузиуса и вернем тепло
. После этого воспользуемся процессом Клаузиуса и вернем тепло 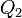 от холодильника нагревателю. В результате получается, что мы совершили работу только за счет отъёма теплоты от нагревателя, то есть постулат Томсона тоже неверен.
от холодильника нагревателю. В результате получается, что мы совершили работу только за счет отъёма теплоты от нагревателя, то есть постулат Томсона тоже неверен.
С другой стороны, предположим, что неверен постулат Томсона. Тогда можно отнять часть тепла у более холодного тела и превратить в механическую работу. Эту работу можно превратить в тепло, например, с помощью трения, нагрев более горячее тело. Значит, из неверности постулата Томсона следует неверность постулата Клаузиуса.
Таким образом, постулаты Клаузиуса и Томсона эквивалентны.
Другая формулировка второго начала термодинамики основывается на понятии энтропии:
«Энтропия изолированной системы не может уменьшаться» (закон неубывания энтропии).
Такая формулировка основывается на представлении об энтропии как о функции состояния системы, что также должно быть постулировано.
Второе начало термодинамики в аксиоматической формулировке Рудольфа Юлиуса Клаузиуса (R. J. Clausius, 1865) имеет следующий вид[2]:
Для любой квазиравновесной термодинамической системы существует однозначная функция термодинамического состояния 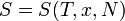 , называемая энтропией, такая, что ее полный дифференциал
, называемая энтропией, такая, что ее полный дифференциал 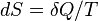 .
.
В состоянии с максимальной энтропией макроскопические необратимые процессы (а процесс передачи тепла всегда является необратимым из-за постулата Клаузиуса) невозможны.
Используемая литература:
· Осипов А.И., Уваров А.В. Энтропия и ее роль в науке // Сетевой образовательный журнал. — 2004. — Т. 8. — № 1. — С. 70-79.
· Thermodynamics, Prentice Hall (1937). — Русский перевод: Ферми, Энрико, Термодинамика, Харьков: Изд-во Харьковского ун-та, 1969. — 140 с.
· Reif, F., Fundamentals of statistical and thermal physics, McGraw-Hill (1965)
· Шамбадаль П. Развитие и приложение понятия энтропии. — М.: Наука, 1967. — 280 с.
· Волькенштейн М. В. Энтропия и информация. — М.: Наука, 1986. — 192 с.














 (zip - application/zip)
(zip - application/zip)










