Министерство здравоохранения Луганской Народной Республики
ГУ «Луганский государственный медицинский университет»
Кафедра фтизиатрии, клинической иммунологии,
аллергологии и медицинской генетики
Зав. кафедрой: д.мед.н., проф. Пустовой Ю. Г
Преподаватель: к.мед.н., асс. Лоскутов А. Л
Реферат
на тему " Вторичные иммунодефициты "
Выполнил:
студент 3 курса
Лечебного факультета
16 группы
Левкович В.В.
Луганск
- 2016
Содержание
Введение.
1. Определение ВИД
2. Отличие от первичных ИД.
3. Классификация ВИД
4. Клинические проявления, позволяющие предполагать наличие ВИД.
5. Механизмы развития ВИД.
5.1. Гибель клеток иммунной системы
5.2. Нарушение функции иммуноцитов
5.3. Несбалансированное преобладание активности регуляторных
клеток и супрессорных факторов.
6. Проявление ВИД в различных звеньях иммунитета.
6.1. гуморального
6.2. клеточного
6.3. комбинированный
6.4. система фагоцитов
7.Лабораторные признаки ВИД
8. Принципы лечения ВИД.
Выводы.
Список используемой литературы.
Введение
Иммунная система — система органов, существующая у позвоночных животных и объединяющая органы и ткани, которые защищают организм от заболеваний, идентифицируя и уничтожая опухолевые клетки,патогены. Иммунная система распознает множество разнообразных возбудителей — от вирусов до паразитических червей — и отличает их от собственных клеток на молекулярном уровне. Распознавание возбудителей усложняется их адаптацией и эволюционным развитием новых методов успешного инфицирования организма-хозяина.
Конечной целью иммунной системы является уничтожение чужеродного агента, которым может оказаться болезнетворный микроорганизм, инородное тело, ядовитое вещество или переродившаяся клетка самого организма. Этим достигается биологическая индивидуальность организма.
В результате генетических нарушений либо повреждающего действия экзогенных факторов иммунная система может давать сбой, Это может протекать в трех разных формах:
Иммунодефициты Иммунодефициты— это нарушения иммунологической реактивности, которые обусловлены выпадением одного или нескольких компонентов иммунного аппарата или тесно взаимодействующих с ним неспецифических факторов.
Аутоиммунные процессыАутоиммунные процессы — это в значительной степени хронические явления, которые приводят к долговременному повреждению тканей. Это связано в первую очередь с тем, что аутоиммунная реакция постоянно поддерживается тканевыми антигенами.
Гиперчувствительность. Гиперчувствительность — это термин, используемый для обозначения иммунного ответа, который протекает в аггравированной и неадекватной форме, в результате чего происходит повреждение тканей.
Далее будут рассмотрены более подробно вторичные иммунодефициты (ВИД)
Определение ВИД
Вторичные иммунодефицитные состояния — это нарушения иммунной защиты организма вследствие действия ненаследственных индукторных факторов. Они не являются самостоятельными нозологическими формами, а лишь сопутствуют заболеваниям или действию иммунотоксических факторов. В большей или меньшей степени нарушения иммунитета сопутствуют большинству заболеваний, и это существенно осложняет определение места вторичных иммунодефицитов в развитии патологии. В соответствии с МКБ-10 под вторичными иммунодефицитами понимают нарушения иммунитета, возникающие в результате соматических и других болезней, а также прочих факторов. Необходимо отметить, что вторичный иммунодефицит — это не диагноз и не нозологическая единица, а патологическое состояние, развивающееся на фоне нормально функционировавшей иммунной системы и характеризующееся устойчивым выраженным снижением количественных и функциональных показателей, характеризующих различные звенья иммунной системы. Часто бывает трудно дифференцировать вклад в развитие нарушений иммунитета наследственных факторов и индукторных воздействий. Во всяком случае, реакция на иммунотоксические агенты зависит от наследственных факторов. Примером сложностей в интерпретации основ нарушений иммунитета могут служить заболевания, отнесенные к группе «часто болеющие дети». Основа чувствительности к инфекции, в частности, респираторной вирусной, — генетически (полигенно) детерминированная иммунологическая конституция, хотя в качестве этиологических факторов выступают конкретные возбудители. Однако на тип иммунологической конституции оказывают влияние факторы внешней среды и ранее перенесенные заболевания. Практическая значимость точного вычленения наследственно обусловленного и приобретенного компонентов патогенеза иммунологической недостаточности будет возрастать по мере разработки методов дифференцированного терапевтического
воздействия на эти формы иммунодефицитов, в том числе методов адаптивной клеточной терапии и генотерапии.
Отличие от первичных ИД
Отличия ПИД от ВИД представлены в таблице:
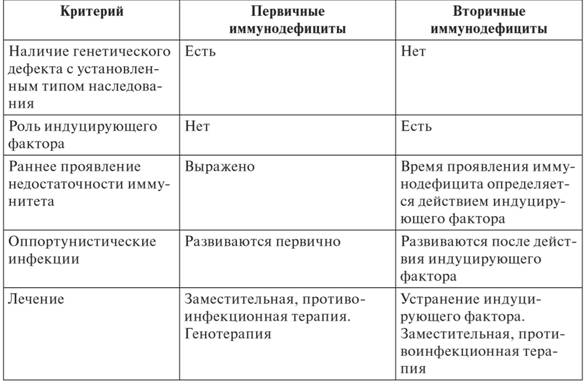
Классификация ВИД
Можно выделить несколько классификаций вторичных иммунодефицитов:
По темпам развития:
Острый (обусловлен острым инфекционным заболеванием, травмой, интоксикацией и т. Д.);
Хронический (развивается на фоне хронических гнойно-воспалительных заболеваний.
По уровню дефекта:
Нарушение клеточного (Т-лимфоцитарного) звена
Нарушение гуморального (В-лимфоцитарного) звена
Нарушение фагоцитарного звена
Нарушение системы комплемента
По распространенности
Местный
Системный
По форме
Индуцированная форма вторичного иммунодефицита возникает в результате конкретных причин, вызвавших ее появление: рентгеновское излучение, цитостатическая терапия, применение кортикостероидов, травмы и хирургические вмешательства, а так же нарушения иммунитета, развивающиеся вторично по отношению к основному заболеванию .
Спонтанная форма вторичного иммунодефицита характеризуется отсутствием явной причины, вызвавшей нарушение иммунной реактивности.
Приобретенная форма (ВИЧ - СПИД)
По тяжести
Компенсированный (часто возникающие инфекционные заболевания.)
Субкомпенсированный (развитие хронического воспалительного процесса)
Декомпенсированный (генерализация инфекционного процесса)
Клинические проявления, позволяющие предполагать наличие ВИД
Заподозрить у больного вторичный иммунодефицит можно при помощи таких проявлениям и патологических состояний:
1.хронические, часто повторяющиеся бронхиты с пневмониями в анамнезе,
сочетающиеся с заболеваниями ЛОР-органов (гнойными синуситами,
отитами, лимфаденитами);
2.часто повторяющиеся пневмонии, бронхоплевропневмонии;
3.бронхоэктатическая болезнь;
4.бактериальные поражения кожи и подкожной клетчатки (пиодермия,
5.фурункулёз, абсцессы, флегмоны, септические гранулёмы,
рецидивирующий парапроктит у взрослых);
6.грибковые поражения кожи и слизистых оболочек, кандидоз,
паразитарные заболевания;
7.афтозные стоматиты в сочетании с повышенной заболеваемостью
острыми респираторными вирусными инфекциями;
8.рецидивирующая герпесвирусная инфекция различной локализации;
9.гастроэнтеропатия с хронической диареей неясной этиологии,
дисбактериозом;
10.длительный субфебрилитет, лихорадка неясной этиологии;
10.генерализованные инфекции (сепсис, гнойные менингиты).
11.лимфаденопатия, повторные лимфадениты.
Основные причины
ВИД:
1. Дефект питания.
2. Инфекции.
3. Гельминтозы.
4. Протеинурия в связи с болезнями почек.
5. Хроническая почечная недостаточность
(уремия).
6. Диарейный синдром.
7. Стресс-синдром.
8. Оперативное вмешательство (наркоз + стресс +
травма).
9. Эндокринопатии (сахарный диабет, гипотиреоз и
др.).
10. Лекарства (глюкокортикостероиды,
антибиотики, цитостатики и другие иммунодепрессанты).
11. Низкая масса тела при рождении.
Механизмы развития ВИД
Механизмом развития иммунодефицитов, не вызванных генетическими дефектами, может служить:
1.гибель клеток иммунной системы — тотальная или избирательная;
2.нарушение функции иммуноцитов;
3.несбалансированное преобладание активности регуляторных клеток и
супрессорных факторов.
Иммунодефицитные состояния, обусловленные гибелью иммуноцитов
Классические примеры таких иммунодефицитов — нарушения иммунитета, вызванные действием ионизирующей радиации и цитотоксических лекарственных средств. Лимфоциты относят к немногочисленным клеткам, реагирующим на действие ряда факторов, в частности повреждающих ДНК, развитием апоптоза. Этот эффект проявляется при действии ионизирующей радиации и многих цитостатиков, используемых в лечении злокачественных опухолей (например, цисплатина, внедряющегося в двойную спираль ДНК). Причина развития апоптоза в этих случаях — накопление нерепарированных разрывов, регистрируемых клеткой с участием киназы АТМ, от которой сигнал поступает по нескольким направлениям, в том числе к белку р53. Этот белок отвечает за запуск апоптоза, биологический смысл которого состоит в защите многоклеточного организма ценой гибели единичных клеток, которые несут генетические нарушения, чреватые риском малигнизации клетки. В большинстве других клеток (как правило, покоящихся) срабатыванию этого механизма противодействует защита от апоптоза, обусловленная повышенной экспрессией белков Bcl-2 и Bcl-XL. Радиационные иммунодефициты Уже в первое десятилетие после открытия ионизирующих излучений была обнаружена их способность ослаблять резистентность к инфекционным заболеваниям и избирательно снижать содержание лимфоцитов в крови и лимфоидных органах. Радиационный иммунодефицит развивается сразу после облучения организма. Действие радиации обусловлено преимущественно двумя эффектами: нарушением естественных барьеров, прежде всего слизистых оболочек, что приводит к усилению доступа в организм патогенов; избирательным повреждением лимфоцитов, а также всех делящихся клеток, включая предшественники клеток иммунной системы и клетки, вовлекаемые в иммунный ответ. Предметом изучения радиационной иммунологии является, главным образом, второй эффект. Радиационная гибель клеток реализуется по двум механизмам — митотическому и интерфазному. Причина митотической гибели — нерепарируемые повреждения ДНК и хромосомного аппарата, препятствующие осуществлению митозов. Интерфазная гибель затрагивает покоящиеся клетки. Ее причиной служит развитие апоптоза по р53/АТМзависимому механизму Если чувствительность всех типов клеток к митозу примерно одинакова (D0 — около 1 Гр), то по чувствительности к интерфазной гибели лимфоциты значительно превосходят все остальные клетки: большинство их погибает при облучении в дозах 1–3 Гр, тогда как клетки других типов погибают при дозах, превышающих 10 Гр. Высокая радиочувствительность лимфоцитов обусловлена, как уже сказано, низким уровнем экспрессии антиапоптотических факторов Bcl-2 и Bcl-XL. Различные популяции и субпопуляции лимфоцитов несущественно различаются по чувствительности к апоптозу (В-клетки несколько чувствительнее Т-лимфоцитов; D0 для них составляет соответственно 1,7–2,2 и 2,5–3,0 Гр). В процессе лимфопоэза чувствительность к цитотоксическим воздействиям изменяется в соответствии с уровнем экспрессии в клетках антиапоптотических факторов: она наиболее высока в периоды селекции клеток (для Т-лифмоцитов — стадия кортикальных CD4+ CD8+ тимоцитов, D0 — 0,5–1,0 Гр). Радиочувствительность высока у покоящихся клеток, она дополнительно возрастает на начальных этапах активации, а затем резко снижается. Высокой радиочувствительностью характеризуется процесс пролиферативной экспансии лимфоцитов, причем при вступлении в пролиферацию могут погибнуть клетки, подвергшиеся действию излучения ранее и несущие нерепарированные разрывы ДНК. Сформировавшиеся эффекторные клетки, особенно плазматические, устойчивы к действию радиации (D0 — десятки Гр). В то же время клетки памяти радиочувствительны примерно в той же степени, что и наивные лимфоциты. Клетки врожденного иммунитета радиорезистентны. Радиочувствительны только периоды их пролиферации во время развития. Исключение составляют NK-клетки, а также дендритные клетки (погибают при дозах 6–7 Гр), которые по радиочувствительности занимают промежуточное положение между другими лимфоидными и миелоидными клетками. Хотя зрелые миелоидные клетки и опосредуемые ими реакции радиорезистентны, в ранние сроки после облучения максимально проявляется именно недостаточность миелоидных клеток, в первую очередь нейтрофилов, вызванная радиационным нарушением гемопоэза. Его последствия раньше и тяжелее всего сказываются на нейтрофильных гранулоцитах как популяции клеток с наиболее быстрым обменом пула зрелых клеток. Это обусловливает резкое ослабление первой линии защиты, нагрузка на которую именно в этот период значительно возрастает в связи с нарушением барьеров и бесконтрольным поступлением в организм патогенов и других чужеродных агентов. Ослабление этого звена иммунитета служит главной причиной радиационной гибели в ранние сроки после облучения. В более поздние сроки последствия поражения факторов врожденного иммунитета сказываются значительно слабее. Функциональные проявления врожденного иммунитета сами по себе устойчивы к действию ионизирующих излучений. Через 3–4 сут после облучения в дозах 4–6 Гр у мышей погибает более 90% лимфоидных клеток и происходит опустошение лимфоидных органов. Функциональная активность выживших клеток снижается. Резко нарушается хоминг лимфоцитов — их способность мигрировать в процессе рециркуляции во вторичные лимфоидные органы. Реакции адаптивного иммунитета при действии этих доз ослабляются в соответствии со степенью радиочувствительности клеток, которые опосредуют эти реакции. В наибольшей степени от действия радиации страдают те формы иммунного ответа, развитие которых нуждается во взаимодействиях радиочувствительных клеток. Поэтому клеточный иммунный ответ более радиорезистентен, чем гуморальный, а тимуснезависимое антителообразование более радиорезистентно, чем тимусзависимый гуморальный ответ. Дозы радиации в интервале 0,1–0,5 Гр не вызывают повреждения периферических лимфоцитов и нередко оказывают стимулирующее действие на иммунный ответ, обусловленный прямой способностью квантов излучения, генерирующих активные формы кислорода, активировать в лимфоцитах сигнальные пути. Иммуностимулирующее действие радиации, особенно в отношении IgE-ответа, закономерно проявляется при облучении после иммунизации. Полагают, что в этом случае стимулирующий эффект обусловлен относительно более высокой радиочувствительностью регуляторных Т-клеток, контролирующих эту форму иммунного ответа, по сравнению с эффекторными клетками. Стимулирующее действие радиации на клетки врожденного иммунитета проявляется даже при действии высоких доз, особенно в отношении способности клеток продуцировать цитокины (IL-1, TNF α и др.). Помимо прямого стимулирующего действия радиации на клетки, проявлению усиливающего эффекта способствует стимуляция этих клеток продуктами патогенов, поступающих в организм через поврежденные барьеры. Однако повышение активности клеток врожденного иммунитета под действием ионизирующей радиации не является адаптивным и не обеспечивает адекватной защиты. В связи с этим превалирует отрицательное действие облучения, проявляющееся в подавлении (при дозах, превышающих 1 Гр) адаптивного антигенспецифичекого иммунного ответа (рис. 4.50). Уже в период развивающегося опустошения лимфоидной ткани включаются восстановительные процессы. Восстановление происходит двумя основными путями. С одной стороны, активизируются процессы лимфопоэза за счет дифференцировки всех разновидностей лимфоцитов из кроветворных стволовых клеток. В случае Т-лимфопоэза к этому добавляется развитие Т-лимфоцитов из внутритимусных предшественников. При этом в определенной степени повторяется последовательность событий, свойственных Т-лимфопоэзу в эмбриональном периоде: сначала образуются γδТ-клетки, затем— αβТ-клетки. Процессу восстановления предшествует омоложение эпителиальных клеток тимуса, сопровождающееся повышением выработки ими пептидных гормонов. Численность тимоцитов быстро возрастает, достигая максимума к 15-м суткам, после чего происходит вторичная атрофия органа вследствие исчерпания популяции внутритимусных клеток-предшественников. Эта атрофия мало сказывается на численности периферических Т-лимфоцитов, поскольку к этому времени включается второй источник восстановления популяции лимфоцитов.
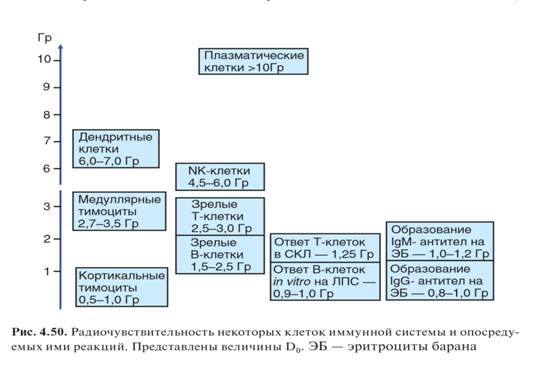
Этот источник — гомеостатическая пролиферация выживших зрелых лимфоцитов. Стимул к реализации этого механизма регенерации лимфоидных клеток — выработка IL-7, IL-15 и BAFF, служащих гомеостатическими цитокинами соответственно для Т-, NK- и В-клеток. Восстановление Т-лимфоцитов происходит наиболее медленно, поскольку для реализации гомеостатической пролиферации необходим контакт Т-лимфоцитов с дендритными клетками, экспресирующими молекулы MHC. Численность дендритных клеток и экспрессия на них молекул MHC (особенно класса II) после облучения снижены. Эти изменения можно трактовать как индуцированные радиацией изменениия микроокружения лимфоцитов — лимфоцитарных ниш. С этим связана задержка восстановления пула лимфоидных клеток, особенно существенная для CD4+ Т-клеток, которая реализуется в неполном объеме. Т-клетки, формирующиеся в процессе гомеостатической пролиферации, имеют фенотипические признаки клеток. Для них характерны пути рециркуляции, свойственные этим клеткам (миграция в барьерные ткани и нелимфоидные органы, ослабление миграции в Т-зоны вторичных лимфоидных органов). Именно поэтому численность Т-лимфоцитов в лимфоузлах практически не восстанавливается до нормы, в то время как в селезенке она восстанавливается полностью. Иммунный ответ, развивающийся в лимфатических узлах, также не достигает нормального уровня при его полной нормализации в селезенке. Таким образом, под влиянием ионизирующей радиации изменяется пространственная организация иммунной системы. Другое следствие конверсии фенотипа Т-лимфоцитов в процессе гомеостатической пролиферации — учащение аутоиммунных процессов вследствие повышения вероятности распознавания аутоантигенов при миграции в нелимфоидные органы, облегчения активации Т-клеток памяти и отставания регенерации регуляторных Т-клеток по сравнению с остальными субпопуляциями. Многие изменения в иммунной системе, индуцированные радиацией, напоминают следствия обычного старения; особенно наглядно это проявляется в тимусе, возрастное снижение активности которого ускоряется облучением. Варьирование дозы облучения, его мощности, применение фракционированного, местного, внутреннего облучения (инкорпорированных радионуклидов) придает определенную специфику иммунологическим нарушениям в пострадиационном периоде. Однако принципиальные основы радиационного поражения и пострадиационного восстановления во всех этих случаях не отличаются от рассмотренных выше. Особую практическую значимость действие умеренных и малых доз радиации приобрело в связи с радиационными катастрофами, особенно в Чернобыле. Сложно точно оценить эффекты малых доз радиации и дифференцировать влияние радиации от роли привходящих факторов (особенно таких, как стресс). В этом случае могут проявляться уже упоминавшееся стимулирующее действие радиации как часть эффекта гормезиса. Радиационную иммуностимуляцию нельзя рассматривать как положительное явление, поскольку оно, во-первых, не адаптивно, во-вторых сопряжено с разбалансировкой иммунных процессов. Пока затруднительно объективно оценить влияние на иммунную систему человека того незначительного повышения естественного фона радиации, которое наблюдается в местностях, прилегающих к зонам катастроф или связанных с особенностями производственной деятельности. В подобных случаях радиация становится одним из неблагоприятных факторов среды и ситуацию следует анализировать в контексте экологической медицины.
Иммунодефицитные состояния, вызываемые нерадиационной гибелью лимфоцитов
Массовая гибель лимфоцитов составляет основу иммунодефицитов, развивающихся при ряде инфекционных заболеваний как бактериальной, так и вирусной природы, особенно при участии суперантигенов. Суперантигены — субстанции, способные активировать CD4+ Т-лимфоциты с участием АПК и их молекул MHC-II. Действие суперантигенов отличается от эффекта обычной презентации антигенов. Суперантиген не расщепляется до пептидов и встраивается не в антигенсвязывающую щель, а подсоединяется к «боковой поверхности» β-цепи молекулы MHC-II. Суперантиген распознается Т-клеткой по их сродству не к антигенсвязывающему центру TCR, а к так называемому 4-му гипервариабельному участку — последовательности 65–85, локализованной на боковой поверхности β-цепей TCR, относящихся к определенным семействам. Таким образом, распознавание суперантигена не является клональным, а обусловлено принадлежностью TCR к тем или иным β-семействам. В результате суперантигены вовлекают в ответ значительное количество CD4+ Т-лимфоцитов (до 20–30%). Так, в ответе на стафилококковый экзотоксин SEB участвуют CD4+ Т-клетки мышей, экспрессирующих TCR, относящиеся к семействам Vβ7 и Vβ8. После периода активации и пролиферации, сопровождающихся гиперпродукцией цитокинов, эти клетки подвергаются апоптозу, что обусловливает значительную степень лимфопении, а поскольку гибнут только CD4+ Т-клетки, то нарушается также баланс субпопуляций лимфоцитов. Этот механизм лежит в основе Т-клеточного иммунодефицита, развивающегося на фоне некоторых вирусных и бактериальных инфекций.
Вторичные иммунодефициты, обусловленные функциональными нарушениями лимфоцитов
Вероятно, именно эта группа вторичных иммунодефицитов является преобладающей. Однако в настоящее время практически отсутствуют сколько-нибудь точные данные о механизмах снижения функции лимфоцитов при различных соматических заболеваниях и воздействии вредных факторов. Только в единичных случаях удается установить точные механизмы, лежащие в основе функциональных иммунодефицитов, однако и они пока не складываются в единую систему. Один из наиболее значимых в практическом отношении — локальный иммунодефицит, формирующийся в зоне роста опухоли. Большинство Т-клеток, инфильтрирующих опухоль, функционально инертны. Это обусловлено формированием опухолью иммунодепрессивного микроокружения. Одним из его проявлений является нарушение экспрессии полипептидных цепей, входящих в состав рецепторного комплекса TCR–CD3–ζ2. Чаще всего нарушается экспрессия ζ-цепей, выполняющих основную сигнальную функцию в данном комплексе. Утрата экспрессии этих цепей сопряжена с потерей способности рецептора Т-клеток передавать сигнал о связывании антигена и, следовательно, активироваться в ответ на презентацию антигена. Этот дефект устраняется при культивировании в присутствии IL-2 и других цитокинов. По-видимому, одним из основных эндогенных факторов, обусловливащих ингибирование иммунных процессов, служит индолил 2,3-диоксигеназа (IDO). Достаточно хорошо обоснована роль этого фермента в локальном подавлении иммунитета и формировании иммунологически привилегированных зон — при развитии плода, росте опухоли, некоторых аутоиммунных процессах (ревматоидный артрит и др.). Его роль в формировании системного иммунодефицита пока оценить трудно. Активность индолил 2,3-диоксигеназы индуцируется вирусами, бактериальным ЛПС (через TLR), а также IFNγ преимущественно в стромальных и дендритных клетках. Физиологическая роль этого фермента состоит, как полагают, в ограничении чрезмерно выраженного ответа на патогены, реализуемом по принципу петли отрицательной обратной связи: сильная реакция Т-клеток приводит к интенсивной выработке индолил 2,3-диоксигеназы, которая сдерживает реакцию Т-клеток. Механизм действия индолил 2,3-диоксигеназы состоит в превращении триптофана в кинуренин. Дефицит триптофана (аминокислоты в наибольшей степени лимитирующей синтез белков) и накопление кинуренина обусловливают блок клеточного цикла (нарушается переход из G1- в S-фазу). Посредниками в реализации этого эффекта выступают стрессорная киназа GCN2, индуцирующая экспрессию фактора инициации eIF2α, который способствует экспрессии LIF — ингибиторной изоформы транскрипционного фактора NF-IL-6. Индукцию индолил 2,3-диоксигеназы в плазмоцитоидных дендритных клетках рассматривают как возможный механизм реализации активности действия естественных регуляторных Т-клеток. Полагают, что сигнал к индукции индолил 2,3-диоксигеназы поступает в дендритную клетку при взаимодействии супрессорной молекулы CTLA-4 с молекулами В7 (CD80/CD86) дендритной клетки. Особо пристальное внимание к индолил 2,3-диоксигеназе привлечено в связи с ее ролью в локальном подавлении иммунных процессов в зоне роста опухоли. Делают попытки решить задачу отмены иммуносупрессорного действия индолил 2,3-диоксигеназы с помощью ее низкомолекулярного ингибитора — 1-метилтриптофана, испытываемого в качестве иммуномодулирующего средства. Функциональную неполноценность, выражающуюся на системном уровне в ослаблении выработки IL-2 и интенсивности пролиферативного ответа на митогены, наблюдают в условиях дефицита гормонов тимуса, особенно тимулина. При этом число Т-клеток и соотношение субпопуляций, как правило, не изменяется. Этот дефект, в частности, проявляется при нормальном старении и корригируется назначением пептидных препаратов тимусного происхождения. Вероятно, этот вариант функционального нарушения Т-клеток вносит вклад в формирование иммунологической недостаточности, развивающейся при дефиците Zn2+ (тимулин активен только в комплексе с ионами Zn2+). Можно предположить, что клеточный иммунодефицит, обусловленный недостаточностью тимусных гормонов, служит частой причиной ослабления иммунитета на фоне различных заболеваний. К сожалению, несмотря на то, что пептидные гормоны тимуса известны давно, точные сведения об их физиологии и патологии ограничены. Тем не менее известно, что один из механизмов действия гормонов тимуса связан с их влиянием на циклические нуклеотиды. Повышение внутриклеточного уровня цАМФ в Т-лимфоцитах сопряжено с ослаблением их функций, во многом аналогичным наблюдаемому при дефиците гормонов тимуса. Поскольку на уровень цАМФ влияет (через воздействие на их синтез и разрушение) большое число гормонов (глюкокортикоиды и др.), метаболитов (аденозин и др.), лекарственных средств (аминофиллин и др.), можно допустить, что одним из путей, ведущих к развитию функциональных нарушений лимфоцитов, особенно Т-клеток, является избыточные воздействия эндогенных и экзогенных факторов на систему циклических нуклеотидов, особенно на цАМФ. Эти отрывочные данные свидетельствуют о существовании обширной области иммунопатологии, обусловленной функциональными нарушениями лимфоцитов, которые пока практически не затронуты исследованиями. Однако, возможно, именно такие нарушения лежат в основе чрезвычайно высокой «отзывчивости» лимфоидных клеток на воздействия внешних и внутренних факторов, которая в настоящее время находится фактически вне сферы научного анализа.
Несбалансированное преобладание активности регуляторных
клеток и супрессорных факторов.
Физиологические иммунодефициты
Изменение иммунитета при стрессе
Стресс представляет стандартную адаптационную реакцию на необычные ситуации, потенциально угрожающие организму. В основе реакции лежит повышенная выработка АКТГ и индуцированная ею гиперпродукция стероидных гормонов коры надпочечников, а также катехоламинов. К основным мишеням этих гормонов, особенно глюкокортикоидов, относят лимфоциты (см. раздел 3.6.6.2), что и определяет реакцию иммунной системы при стрессе. Реакция лимфоцитов зависит от концентрации глюкокортикоидов, а следовательно, от интенсивности стресса. Воздействия умеренной интенсивности вызывают преимущественно перераспределение лимфоцитов. Незрелые кортикальные тимоциты эмигрируют из тимуса и поступают в основном в костный мозг. Сюда же мигрирует часть зрелых Т-клеток. При слабом стрессе массовая гибель лимфоцитов отсутствует. Функциональная активность лимфоцитов изменяется незначительно, отчасти в связи их пространственным перераспределением. Уровень иммунного ответа, особенно гуморального, при этом снижается, хотя тоже незначительно. В целом же действие малых и умеренных доз гормонов надпочечников, оказывающих слабое и преходящее влияние на иммунную систему, нельзя рассматривать как причину развития иммунодефицитного состояния. Иная ситуация создается при интенсивных и длительных или повторяющихся стрессорных воздействиях. При этом концентрация глюкокортикоидов может превысить пороговые уровни для индукции апоптоза лимфоцитов. Соотношение чувствительности различных разновидностей лимфоцитов к действию глюкокортикоидов такова же, как к действию радиации, что обусловлено одинаковой причиной гибели — развитием апоптоза при условии низкой экспрессии внутриклеточных антиапоптотических факторов (Bcl-2 и др.). Долгое время чувствительность к действию глюкортикоидов рассматривалась как главный показатель степени зрелости тимоцитов: кортизончувствительность свойствена незрелым кортикальным, а кортизонрезистентность — зрелым медуллярным тимоцитам. Макрофаги под влиянием глюкокортикоидов не погибают, но их функция ослабляется— в основном вследствие повышения внутриклеточной концентрации цАМФ. В результате интенсивный стресс может вызвать подавление всех форм иммунного ответа, особенно гуморального. Течение уже развившегося иммунного ответа при этом не изменяется. Обычно последствия стресса, даже сильного, быстро ликвидируются. Однако при длительном и повторном действии стресс может выступать в качестве кофактора формирования иммунодефицита, а также ускоренного старения иммунной системы. Этому способствуют изменения, индуцируемые стрессом в микроокружении лимфоцитов, например, в эпителиальных клетках тимуса.
Проявление ВИД в различных звеньях иммунитета.
Недостаточность гуморального звена иммунной системы
Характерными признаками ослабления в
функционировании гуморального звена иммунной системы является неспособность организма
вырабатывать антитела обладающие способностью: а) инактивировать бактерии и
токсины в жидких средах организма - IgM и IgG, б) препятствовать проникновению
возбудителей через слизистые оболочки дыхательного и пищеварительного трактов -
IgA. Следствием этого, пациенты с данной формой иммунодефицита являются
восприимчивыми к пиогенным инфекциям, вызванным инкапсулированными
микроорганизмами (Streptococcus pneumoniae, Haemophilus influenzae,
Staphylococcus aureus и
различными типами Pseudomonas). В то же время, недостаточность гуморального звена
иммунной системы не оказывает существенного влияния на восприимчивость к
заболеваниям, вызванным простейшими, грибами внутриклеточными бактериальными
патогенами (Mycobacteria) и вирусами. Исключение из этого правила составляют
заболевания, вызываемые энтеровирусами.
Механизм повышенной восприимчивости к
пиогенным инфекциям у лиц с нарушениями гуморального звена иммунной системы
обусловлен тем, что пиогенные бактерии, имеющие липополисахаридную оболочку, не
могут быть рецептор-опосредованно распознаны нейтрофилами и макрофагами. Именно
поэтому данный тип возбудителей уклоняется от клеточных факторов естественной
резистентности. Эффективная элиминация из организма данного типа патогенов целиком
зависит от их предварительной опсонизации (антитела, белки системы
комплемента), обеспечивающей их последующий фагоцитоз. Недостаточность
выработки антител в слизистых оболочках (IgA) снижает вероятность нейтрализации
вирусов, что делает лиц с нарушенным гуморальным иммунным ответом восприимчивыми
к энтеровирусным инфекциям.
Вторичные иммунодефициты гуморального звена
Снижение уровня иммуноглобулинов различных классов может
быть обусловлено их потерями через желудочно-кишечный и/или уро-генитальный
тракты. Например, у лиц с нефротическим синдромом вследствие повышенной
фильтрации в моче обнаруживается значительное повышение уровня IgA и IgG.
Содержание IgM в сыворотке не изменено, из-за его больших размеров,
препятствующих прохождению IgM клубочковую мембрану.
Недостаточности клеточного звена иммунной системы
Как правило, недостаточность клеточного звена иммунной системы имеет более тяжелые последствия по сравнению с неполноценностью функционирования гуморального звена. Большинство генетически-обусловленных нарушений клеточного звена иммунной системы имеют плохой прогноз. Лица с нарушениями клеточного звена иммунной системы восприимчивы к заболеваниям, вызываемым внутриклеточными патогенами (бактерии, вирусы), простейшими и грибами. Часто встречаются оппортунистические инфекции. У лиц с данной патологией практически никогда не наблюдаются гиперергические реакции, большинство кожных проб с аллергенами, в том числе с грибами Candida, а также туберкулиновый тест отрицательны, вследствие выраженной анергии T-лимфоцитов.
Вторичные иммунодефициты клеточного звена могут возникать в результате
воздействия следующих причин:
1.Вирусные инфекции(вирусы кори, герпеса, иммунодефицита человека, цитамегаловирус
и др.). Дефицит клеточного
звена иммунной системы обусловлен как цитопатогенным эффектом вирусов, так и
гиперактивацией клеток, приводящей к их гибели по механизму апоптоза
(характерно для ВИЧ-инфекции).
2.Микобактериальные и протозойные инфекции приводят к иммунодефициту
клеточного звена в результате поражения клеток иммунной системы микробами и
токсинами, что обуславливает анергию и гибель Т-клеток, а также активацию супрессорных
факторов макрофагов.
3. Супрессия клеточного звена иммунной системы
при уремии обусловлена присутствием
токсических метаболитов и развивающимся ацидозом, что вызывает лимфопению,
посредством активации супрессорных эффекты по отношению к созреванию и
дифференцировки различных популяций Лф.
4. Супрессия клеточного звена иммунной системы
при ожоговой болезни обусловлена токсическими факторами и
образованием аутоантител, что способствует подавлению фагоцитоза, дефициту и
подавлению функций CD4+ T-Лф и гиперактивацией В-Лф.
5. Опухоли вызывают иммунодефицит клеточного
звена также посредством токсических и иммуносупрессорных факторов, приводящих к
гипофункции Т-Лф, развития блокирующих эффектов антител и активации
супрессорного звена иммунной системы.
Иммунодефициты вследствие комбинированных дефектов клеточного и гуморального звеньев иммунной системы
1. Хронические
неспецифические болезни легких способны
вызвать комбинированный иммунодефицит (главным образом гуморальный) вследствие
поликлональной активации иммунокомпетентных клеток и усиления супрессорных
факторов в результате продолжительного действия факторов воспаления и токсинов.
2.Дефицит микроэлементов вызывает комбинированный иммунодефицит (главным
образом, клеточный) вследствие нарушения сигнальных путей, участвующих в
реанжировке генов, активации белков и способствующих формированию различных
популяций Лф. Например, дефицит Zn может привести к дефектам развития Т-клеток,
снижению активности Т и NK-клеток, нейтрофилов. Дефицит Cu – гипофункция
Т-клеток, дефектам фагоцитоза.
3. Голодание приводит к тотальному (главным образом, клеточному)
иммунодефициту из-за лимфопении и гипофункции иммунокомпетентных клеток в результате
дефицита белков и расстройств энергообеспечения клеток.
4.Химиотерапия и
облучение приводят
к комбинированному иммунодефициту вследствие цитотоксического действия на
иммунокомпетентные клетки, индукции их апоптоза или некроза, и подавления
лимфо- и миелопоэза.
Иммунодефициты связанные с дефицитом фагоцитарной функции
Дефекты фагоцитарной функции могут быть также результатом воздействия различных факторов (химиотерапия, иммуносупрессанты, глюкокортикоиды, опухоли и др.), действие которых было рассмотрено в предыдущих разделах.
Лабораторные признаки ВИД
По степени иммунной недостаточности выделяют ВИД преимущественно с функциональными изменениями; со «структурными» и функциональными изменениями
О ВИД с функциональными изменениями говорят, когда количественные показатели системы иммунитета практически не отличаются от показателей здоровых лиц или находятся на нижней границе нормы (что само по себе уже не норма при наличии антигенной стимуляции в связи с инфекционным процессом). Только при углубленном обследовании можно обнаружить недостаточность продукции тех или иных цитокинов, интерферонов, повышение апоптоза лимфоцитов и другие изменения.
При ВИД со «структурными» и функциональными изменениями показатели иммунитета уже заметно количественно отличаются от нормальных пределов, может выявляться существенный дисбаланс между содержанием Т–хелперов 1 и 2 типа, между Т–хелперами и цитотоксическими лимфоцитами, дефицит активированных Т–лимфоцитов (возможна чрезмерная активация одних клеток и супрессия других, актуальных при данной патологии клеток), дефицит выработки иммуноглобулинов, дисиммуноглобулинемия, нарушения в системе интерферона, цитокиновой сети и другие изменения.
Лабораторное иммунологическое обследование должно включать: определение состояния гуморального звена по уровню продукции иммуноглобулинов классов А, М, G, Е (при возможности с оценкой субклассов IgG, функциональной состоятельности антител), содержанию CD72+ или CD19+ лимфоцитов, циркулирующих иммунных комплексов (ЦИК); оценку Т–клеточного звена с определением основных субпопуляций лимфоцитов: CD5+, CD4+, CD8+, соотношения CD4+/CD8+ или так называемого иммунорегуляторного индекса (ИРИ), содержания CD16+ (при возможности определение активационных рецепторов лимфоцитов DR+, CD25+, CD11b+, CD 56+ и др., Fas молекулы – CD95+, p53 и других показателей, характеризующих уровень апоптоза).
Проводится исследование интерферонового статуса с определением уровня сывороточного интерферона (ИФН), спонтанной продукции ИФН, способности лейкоцитов к стимулированной продукции ИФН–a (под воздействием вируса болезни Ньюкасла), а также способности продуцировать ИФН–g под воздействием фитогемагглютинина. Кроме того, желательна оценка ответа лейкоцитов на медикаментозные стимулы – продукция ИФН под действием индукторов его синтеза (дибазол, амиксин, циклоферон и другие).
Оценивается состояние системы фагоцитов по поглотительной способности нейтрофилов, спонтанной и стимулированной люминолзависимой хемилюминесценции, НСТ–тесту.
При возможности – контроль за уровнем основных провоспалительных цитокинов (ИЛ–1, ФНО, ИЛ–4, ИЛ–6, и др.).
У больных ВИД желательно также определение маркеров аутоагрессии (анти–ДНК, РФ, антитела к тиреоглобулину, тиреоидной пероксидазе и др.) и онкомаркеров.
Принципы лечения ВИД
Механизмы подавления иммунитета при вторичных ИДС различны, и, как прав
ило, имеется сочетаниенескольких механизмов, нарушения иммунной системы выражены в меньшей степени, чем при первичных.Как правило, вторичные иммунодефициты носят приходящий характер. В связи с этим лечение вторичныхиммунодефицитов гораздо проще и эффективнее по сравнению с лечением первичных нарушенийфункции иммунной системы. Обычно лечение вторичного иммунодефицита начинают с определения иустранения причины его возникновения. Например, лечение иммунодефицита на фоне хроническихинфекций начинают с санации очагов хронического воспаления. Иммунодефицит на фоне витаминноминеральной недостаточности начинают лечить при помощи комплексоввитаминов и минералов.Восстановительные способности иммунной системы велики, поэтому устранение причиныиммунодефицита, как правило, приводит к восстановлению иммунной системы. Для ускорениявыздоровления и стимуляции иммунитета проводят курс лечения иммуностимулирующимипрепаратами. Внастоящее время известно большое число иммуностимулирующих препаратов, с различнымимеханизмами действия.
Выводы
Иммунодефициты— это нарушения иммунологической реактивности, которые обусловлены выпадением одного или нескольких компонентов иммунного аппарата или тесно взаимодействующих с ним неспецифических факторов.
Иммунодефициты подразделяются на первичные и вторичные.
Вторичные иммунодефицитные состояния — это нарушения иммунной защиты организма вследствие действия ненаследственных индукторных факторов. Они не являются самостоятельными нозологическими формами, а лишь сопутствуют заболеваниям или действию иммунотоксических факторов. В большей или меньшей степени нарушения иммунитета сопутствуют большинству заболеваний, и это существенно осложняет определение места вторичных иммунодефицитов в развитии патологии.
При ВИД могут нарушаться различные звенья иммунитета, которые проявляются соответствующим образом.
Обычно лечение вторичного иммунодефицита начинают с определения устранения причины его возникновения.
Список используемой литературы
1. А.А.Воробъёв, А.С.Быкова, А.В.Караулова. Иммуннология и аллергология.-М.: Практическая медицина,2006.
2. А.А. Ярилин. Основы иммунологии.-М.: Медицина, 2009.
3. В.В. Климов и соавт. Клиническая иммунология и аллергология. – Т.: Изд-во «Печатная мануфактура», 2008
4. Р.М. Хаитов. Иммунология.-М.: «ГЭОТАР-Медиа», 2006
5. Ю.В. Шигина. Клиническая иммунология: Учеб. Пособие. – М.: Издательство РИОР, 2006 .













 (zip - application/zip)
(zip - application/zip)










