Министерство Российской Федерации
по делам гражданской обороны, чрезвычайным ситуациям
и ликвидации последствий стихийных бедствий
ФГБОУ ВО Ивановская пожарно-спасательная академия государственной противопожарной службы
Кафедра химии, теории горения и взрыва
Курсовая работа
Химия
Тема: «Термохимические свойства фталевого ангидрида»
Выполнил: курсант
11 курса 114 учебной группы
факультета пожарной безопасности
Сучков А.Е.
Руководитель: научный сотрудник
НИО УНК «Государственный надзор»
майор внутренней службы
Баринова Е.В.
Дата защиты: _______________Оценка: ___________________
__________________________
(подпись руководителя)
ИВАНОВО 2015
СОДЕРЖАНИЕ:
Введение………………………………………………………………….…..3-5Задание №1…………………………………………………………..…… .6-10
Задание №2…………………………………………………………...………10
Задание №3…………………………………………………………..…... 11-12
Задание №4…………………………………………………………..…... 12-13
Задание №5…………………………………………………………….……...13
Задание №6………………………………………………………………...13-14
Задание №7…………………………………………………………….…..14-15
Задание №8…………………………………………………………….…..15-16
Задание №9……………………………………………………………….…...16
Задание №10…………………………………………………………….…16-17Задание №11………………………………………………………………..…17
Задание №12…………………………………………………………………..18
Задание №13……………………………………………………………….….19
Задание №14……………………………………………………………….….19
Задание №15………………………………………………………………..…20
Задание №16…………………………………………………………….…20-21
Заключение……………………………………………………………...…21-22
Литература……………………………………………………………………23
Введение
В Советском Союзе в соответствии с ГОСТ 7119—54 вырабатывают
три сорта товарного фталевого ангидрида, отличающихся друг от друга главным образом содержанием основного
вещества. По ГОСТ 7119—54
дистиллированный продукт должен содержать не менее 99,7% фталевого ангидрида для первого сорта и не менее 99,2% — для второго. Это основные виды товарной продукции. В продукте сорта технический содержание фталевого ангидрида составляет не менее 99%. Его, как
правило, получают непосредственно из конденсаторов без последующей
дистилляции. Кроме того, вырабатывается реактивный фталевый ангидрид (ГОСТ 5869—51) двух марок чистый для анализа и чистый. Марки
различаются содержанием фталевого
ангидрида и примесей.
Во фталевом ангидриде - реактиве регламентируется содержание хлоридов и сульфатов тяжелых металлов сероводородной группы (металлы IV и V групп периодической системы элементов). Технические условия на фталевый ангидрид по ГОСТ 7119—54 и ГОСТ 5869—51.
Фталевый ангидрид катализатор представляющий собой модификацию контакта, применяемого для получения ангидрида фталевой кислоты. Однако условия окисления очень отличаются от условий окисления нафталина, так как бензол значительно устойчивее против окисления.
Вследствие жестких условий процесса снижается выход малеинового ангидрида, составляющий 50—60% от теоретического, тогда как выход фталевого ангидрида достигает 86—88%.
Производство фталевого ангидрида из о-ксилола требует в качестве первой ступени концентрирования о-ксилола в сырье путем выделения его из смеси других ароматических углеводородов, содержащих в молекуле восемь
атомов
углерода. Это может быть достигнуто путем фракционной перегонки ароматической
фракции 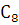 , получаемой с таких установок для ароматизации, как гидроформинг
или платоформинг . Например,
на одном из предприятий в производстве фталевого
ангидрида в скрубберах на
установке очистки хвостовых газов насадка быстро забивалась содержащимися в
них нафтохинонами. Скрубберы останавливали на очистку, а в это
время хвостовые газы без очистки сбрасывались в атмосферу .
, получаемой с таких установок для ароматизации, как гидроформинг
или платоформинг . Например,
на одном из предприятий в производстве фталевого
ангидрида в скрубберах на
установке очистки хвостовых газов насадка быстро забивалась содержащимися в
них нафтохинонами. Скрубберы останавливали на очистку, а в это
время хвостовые газы без очистки сбрасывались в атмосферу .
Также известно, что бензол окисляется в малеиновый ангидрид при условиях, сходных с условиями, применяемыми при производстве фталевого ангидрида . Таким образом, частичный разрыв кольца почти неизбежен, но, по-видимому, после того как уже образовался фталевый ангидрид, кольцо менее чувствительно к атаке, чем ранее. Высказано предположение, что каталитическое окисление толуола происходит при помощи атомарного кислорода, выделяемого катализатором в результате прохождения через ряд стадий гидроксилирования на поверхности катализатора. В условиях, применяемых для получения фталевого ангидрида, бензиловый спирт не был обнаружен в продуктах окисления, но его можно выделить при более высоких давления. Сырой фталевый ангидрид можно выделить из потока, выходящего из реактора, различными путями, включая конденсацию в виде твердого осадка в больших сосудах, охлаждаемых воздухом, или при промывании водой содержащих фталевый ангидрид газов, выходящих из реактора. В последнем случае ангидрид гидратируется в кислоту, которая осаждается из раствора, образуя водную суспензию. Фталевый ангидрид очень высокой степени чистоты получается при помощи стандартных методов перегонки. Очищенное вещество кристаллизуется в виде бесцветных игл. В продаже он обычно появляется в виде чешуек, которые получаются при обычном осаждении из расплавленного дистиллята.
Очень важное направление в применении головных погонов заключается в том, что их каталитически восстанавливают в спирты, которые переводят в нейтральные эфиры фталевой кислоты обработкой фталевым ангидридом. Последние являются важными растворителями и смягчителями для промышленности пластмасс, обладающими высокой устойчивость к холоду (например, Е. В. 242 и Е. О. 356 завода фирмы Дойче Гидрирверке в Родлебене)
Главным направлением использования фталевого ангидрида является применение его сложных эфиров в качестве пластификаторов и в виде алкидных смол для поверхностных покрытий. Новым направлением, обещающим быстрое развитие, является использование его в виде полиэфиров для высокопрочных пластмасс. Производство фталевого ангидрида в США возросло с менее чем 3200 тп в 1930 г. до более 90 700 тп в 1950 г. Проектируемая производительность на 1954 г. устанавливается 170 097тп.
Масштабы производства требуют обеспечения соответствующих больших и устойчивых источников сырья, т. е. нафталина или о-ксилола. В прежние годы более 90% фталевого ангидрида производилось из нафталина, но поставки последнего во время второй мировой войны были совершенно недостаточными, а возможность получать его в дальнейшем в количествах, достаточных для удовлетворения проектируемого производства фталевого ангидрида, неясна. Здесь сказываются многие экономические, политические и технологические факторы, которые рассматриваются в других работах и выходят за рамки настоящего труда. Хотя все сказанное выше справедливо и применительно к о-ксилолу, но это сырье можно получать в больших количествах из нефти при помощи различных процессов ароматизации. Вследствие низких антидетонационных свойств он не применяется для авиационного бензина, поэтому возможности использования о-ксилола для производства фталевого ангидрида будут, по-видимому, весьма велики даже в периоды наибольшего напряжения национальной, экономики.
Основная часть1.Проанализируйте строение молекулы фталевого ангидрида, есть в его составе функциональная группа? Какие свойства она придает? К какому классу соединения относится вещество? Приведите его ближайшие изомеры и гомологи.
Фталевый ангидрид (ангидрид 1,2-бензолдикарбоно-вой к-ты),
Молекулярная масса М=148,12;
Фталевый
ангидрид : бесцветные орто-ромбичные кристаллы; легко возгоняется, т. пл.
130,8 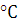 ,
т. кип. 294,5
,
т. кип. 294,5 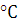 ;
плохо растворимы в этаноле и ди-этиловом эфире.
;
плохо растворимы в этаноле и ди-этиловом эфире.
Формула:
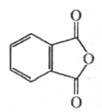
Обладает
свойствами ароматических соединений. При нагревание с моно атомными спиртами в
присутствие 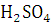 (130-140
(130-140
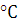 )
или органических солей Ti (200
)
или органических солей Ti (200 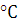 )
образует соответствующие сложные моно- и диэфиры, с многоатомными спиртами в
присутствие высоких кислот - полиэфиры (см. Алкидные смолы). Направление, на
основе фталевого ангидрида и диолов (этилен-, диэтиленгликоля, пропилен-гликоля)
получают полиэфиры; на основе фталевого ангидрида и глицерина -алкидные
(глифталевые) смолы.
)
образует соответствующие сложные моно- и диэфиры, с многоатомными спиртами в
присутствие высоких кислот - полиэфиры (см. Алкидные смолы). Направление, на
основе фталевого ангидрида и диолов (этилен-, диэтиленгликоля, пропилен-гликоля)
получают полиэфиры; на основе фталевого ангидрида и глицерина -алкидные
(глифталевые) смолы.
Фталевый
ангидрид легко реагирует с фенолами и их производными. Так, реакция с фенолом
в присутствие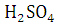 и
и
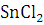 приводит
к фенолфталеину, с (этиламино) фенолом - к родамину, с резорцином к
флуоресцеину с n-хлорфенолом - к хинизарину. С мочевиной и солями Cu фталевый
ангидрид образует нерастворимые пигменты фталоцианины, применяемые в качестве
красителей. Декарбоксилирование фталевого ангидрида при 200
приводит
к фенолфталеину, с (этиламино) фенолом - к родамину, с резорцином к
флуоресцеину с n-хлорфенолом - к хинизарину. С мочевиной и солями Cu фталевый
ангидрид образует нерастворимые пигменты фталоцианины, применяемые в качестве
красителей. Декарбоксилирование фталевого ангидрида при 200 в
присутствие
в
присутствие  ,
ZnO приводит к бензойной кислоте; это один из промышленных способов ее
получения.
,
ZnO приводит к бензойной кислоте; это один из промышленных способов ее
получения.
Функциональная группа:
Карбоксил (карбоксильная группа) — одновалентная группа СООН, присутствие которой определяет принадлежность органического соединения к карбоновым кислотам.
Карбоксильная группа:
Карбоксильная группа, карбоксил,
- одновалентная группа
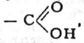
Характерная для карбоновых кислот. Состоит из карбонильной и
гидроксильной (-ОН) групп (отсюда назв.: карб + оксил)
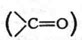
Кислотные свойства карбоновых кислот обусловлены смещением электронной плотности карбонильному кислороду и вызванной этим дополнительной (по сравнению со спиртами)поляризации связи О-Н.
В водном растворе карбоновые кислоты диссоциируют на ионы:
R-COOH = R-COO− + H+ Растворимость в воде и высокие температуры кипения кислот
обусловлены образованием межмолекулярных водородных связей.
С увеличением молекулярной массы растворимость кислот в воде уменьшается.
Строение карбоксильной группы:
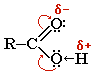
Кислотные
свойства карбоновых кислот обусловлены смещением электронной плотности к
карбонильному кислороду и вызванной этим дополнительной (по сравнению со
спиртами) поляризации связи О–Н.
В водном растворе карбоновые кислоты диссоциируют на ионы:
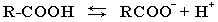
Растворимость в воде и высокие температуры кипения кислот обусловлены образованием межмолекулярных водородных связей.
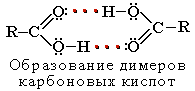
Атом водорода карбоксильной группы отделяется от нее в миллион раз легче, чем от гидроксильной группы фенола. Поэтому всякое органическое вещество, содержащее карбоксильную группу, обладает ярко выраженными кислотными свойствами. Такие вещества носят назв. Если вместо гидроксильной группы присоединить к ней просто атом водорода, то получится альдегидная группа. Альдегиды, которые могут таким путем образовываться из той или иной карбоновой кислоты, получают свое название от названия соответствующей кислоты карбоновых кислот Взгляните еще раз на формулу карбоксильной группы. Вы увидите, что у атома углерода еще остается одна свободная валентная связь, к которой может присоединиться какой-нибудь другой атом. Если это будет атом водорода, то получится муравьиная кислота.
Карбоксильная группа может быть присоединена к углеводородной цепочке любой длины. Однако почти во всех таких соединениях, встречающихся в природе, общее число атомов углерода оказывается четным. Например, в молекуле уксусной кислоты — два атома углерода. Есть карбоновые соединения с четырьмя, шестью, восемью и так далее атомами углерода, их может быть больше двадцати. А аналогичных соединений с нечетным числом атомов углерода в природе почти не бывает.
Изомеры Фталевого ангидрида:
1,5-Бензолкарбоновой кислоты
3,6- Парабензолкарбоновой кислоты
Вывод:
Проанализировав строение молекулы фталевого ангидрида я узнал: что фталевый ангидрид представляет собой бесцветные кристаллы, практически нерастворимые в воде, умеренно растворимые в органических растворителях.
Проявляет свойства ароматических соединений. Со спиртами при нагревании в присутствии серной кислоты образует сложные моно- и диэфиры, с многоатомными спиртами — полиэфиры (алкидные смолы). Фталевый ангидрид является исходным реагентом для получения различных производных фталевой кислоты: её сложных эфиров, фталимида, фталонитрила. Фталевый ангидрид является сырьём для производства глифталевых и пентафталевых красителей производных флуоресцеина, родамина и антрахинона, лекарственных средств. Фталевый ангидрид ядовит, раздражает кожу и слизистые оболочки глаз и носа, способствует заболеванию бронхиальной астмой.
2. Запишите термодинамическое уравнение реакции образования вещества из простых веществ.
Простые вещества — вещества, состоящие исключительно из атомов одного химического элемента.
Фталевый ангидрид состоит из таких простых веществ как углерод, кислород, водород.
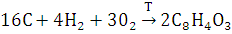
Вывод: данное термодинамическое уравнение из простых веществ возможно.
3. Рассчитайте
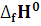 ,
,
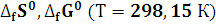 реакции
полного сгорания вещества в атмосфере кислорода. Определите, какое количество
моль вещества, выделится при сгорании 300 кг.
реакции
полного сгорания вещества в атмосфере кислорода. Определите, какое количество
моль вещества, выделится при сгорании 300 кг.
|
|
|
(Дж* |
|
|
С10Н8 Нафталин |
-29,79 |
130,70 |
360,56 |
|
Кислород |
0 |
0 |
205,138 |
|
Вода |
-285,83 |
-237,13 |
69,91 |
|
Оксид углерода |
-393,51 |
-394,36 |
213.74 |
|
Фталевый ангидрид |
-460,66 |
-330,96 |
179,49 |
Термодинамические свойства веществ. Таблица 1.
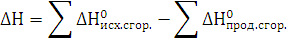
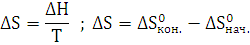
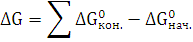
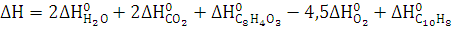

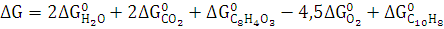
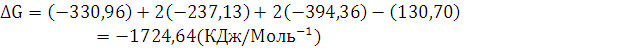
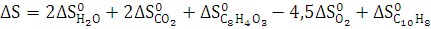
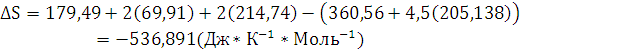
Ответ: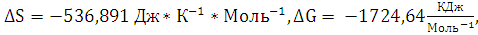
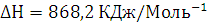
 Дано:
Решение:
Дано:
Решение:
q =22000 кДж/кг Q=q*m
 m=300
кг Q=
22000*300 = 66*
m=300
кг Q=
22000*300 = 66*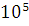 кДж
кДж
Q - ?
Ответ:
Q=66*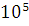 кДж.
кДж.
4.Запишите уравнения реакции горения вещества в атмосфере воздуха и кислорода. Рассчитайте количество моль вещества, вступившего в реакцию сгорания.
Горение — быстропротекающая химическая реакция соединения горючих компонентов с кислородом, сопровождающаяся интенсивным выделением теплоты и резким повышением температуры продуктов сгорания.
Решение:
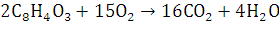
Кол-во вещества:
Для расчета количества моль 300 кг. фталевого ангидрида вступившего в реакцию горения используется формула :
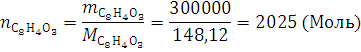
Ответ: Количество
молей вещества, вступившего в реакцию 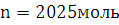 .
.
5.Определите горючесть вещества.
Решение:
Для определения горючести фталевого ангидрида требуется определить коэффициент горючести, он рассчитывается по формуле:
К =4n(C)+n(H)-2n(O)
где n-это число атомов углерода, водорода, кислорода.
В молекуле фталевого ангидрида :
n(C)=8, n(H)=4, n(O)=3;
Если К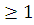 ,
то вещество является горючим.
,
то вещество является горючим.
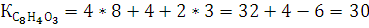
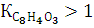 ,
следовательно вещество является горючим.
,
следовательно вещество является горючим.
6.Используя закон кратных отношений, вычислите состав вещества в массовых долях.
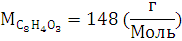
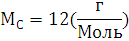
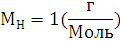
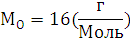
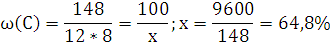
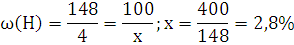
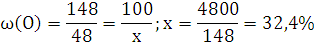
Ответ: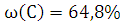 ,
,
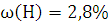 ,
,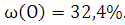
7.Определите характер свечения пламени вещества.
Характер свечения пламени при горении веществ зависит от процентного содержания элементов в веществе.
Свечение пламени связано с наличием несгоревших раскаленных твердых частиц углерода С, а также трехатомных молекул.
|
Содержание углерода в горючем веществе, w (С) % |
Содержание кислорода в горючем веществе, w (О) % |
Характер свечения пламени |
|
< 50 |
> 30 |
пламя бесцветное или голубоватое |
|
< 75 |
отсутствует или < 30 |
пламя яркое, не коптящее |
|
> 75 |
отсутствует или < 25 |
пламя яркое, коптящее |
Характер свечения пламени. Таблица 2.
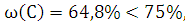
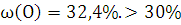
Вывод: Фталевый
ангидрид горит ярким, без копоти пламенем, свечение бесцветное или голубоватого
цвета. Если кислород в веществе отсутствует или его содержание не превышает
30%, но, в свою очередь, и массовая доля углерода не очень велика (менее 75%),
то при термическом разложении будет выделяться значительное количество частиц
углерода, но при нормальном доступе воздуха в зону горения они успевают
окислиться до 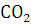 .
.
8. Определите степени окисления атомов, входящих в состав молекулы вещества.
Степень окисления - это приписываемая одному либо нескольким атомам численная величина, характеризующая количество перераспределяемых электронов и показывающая, каким образом эти электроны распределяются между атомами при реакции.
Расчет степени окисления:
Для вычисления степени окисления элемента следует учитывать следующие положения:
1. Степени окисления атомов в простых
веществах равны нулю (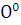 ;
;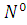 ).
).
2. Алгебраическая сумма степеней окисления всех атомов, входящих в состав молекулы, всегда равна нулю, а в сложном ионе эта сумма равна заряду иона.
3.Постоянную степень окисления имеют
атомы: щелочных металлов (+1), щелочноземельных металлов (+2), водорода (+1)
(кроме гидридов NaH, Ca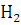 и
др., где степень окисления водорода -1), кислорода (-2) (кроме
и
др., где степень окисления водорода -1), кислорода (-2) (кроме  ;
; и пероксидов,
содержащих группу –O-O–, в которой степень окисления кислорода1).
и пероксидов,
содержащих группу –O-O–, в которой степень окисления кислорода1).
4. Для элементов положительная степень окисления не может превышать величину, равную номеру группы периодической системы.
Вывод: Учитывая, положения о расчете степени окисления проставляется степень окисления


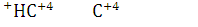

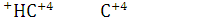


9.Определите окислитель и восстановитель в реакции сгорания вещества в атмосфере кислорода. Определите стехиометрические коэффициенты методом электронного баланса.
Окисли́тельно-восстанови́тельная реа́кция— это встречно-параллельные химические реакции, протекающие с изменением степеней окисления атомов, входящих в состав реагирующих веществ (или ионов веществ), реализующихся путём перераспределения электронов между атомом-окислителем (акцептором) и атомом-восстановителем (донором).

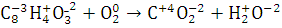
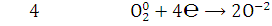 окислитель,
востановление
окислитель,
востановление
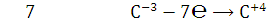 востановитель,
окисление
востановитель,
окисление
Вывод: Методом
электронного баланса уравняли реакцию сгорания фталевого ангидрида.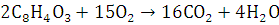
10.Определите объем занимаемый веществом для при переходе из жидкого в газообразное состояние при t=1500˚С и Р=101325 Па.
Решение:
Переводим температуру в систему СИ (Международная система единиц, СИ— система единиц физических величин, современный вариант метрической системы. СИ является наиболее широко используемой системой единиц в мире, как в повседневной жизни, так и в науке и технике. В настоящее время СИ, принята в качестве основной системы единиц
большинством стран мира и почти всегда используется в области техники, даже в тех странах, в которых в повседневной жизни используются традиционные единицы) : Т=1500+273=1773К.
Используя, уравнение
Клапейрона-Менделеева найдем количество н-амилового спирта в газообразном
состоянии: 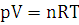
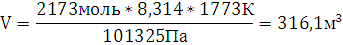
Ответ: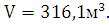
11. Определите объем воздуха, необходимый для полного сгорания вещества при t=15000С и P=101,325 кПа.
Решение:
Объем воздуха, необходимый для сгорания н-амилового спирта рассчитывается по уравнению реакции сгорания.
300 кг х1м3 х2м3 х3м3 х4м3
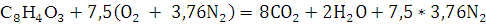
М=148 7,5*4,76*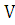
Рассчитаем объем воздуха при t=15000С и P=101,325 кПа.
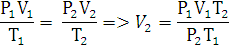
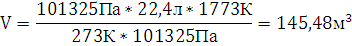
Следовательно,
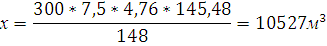
Ответ: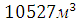 .
.
12. Определите объем продуктов сгорания вещества в атмосфере воздуха и их процентное содержание.
Решение:
300 кг х1м3 х2м3 х3м3 х4м3
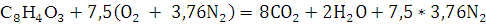
М=148 7,5*4,76*V 8*Vm 2*Vm 7,5*3,76*Vm
Рассчитаем, объем продуктов горения:
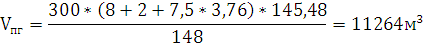
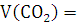 х2=
х2=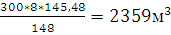
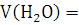 х3=
х3=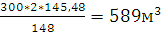
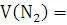 х4=
х4=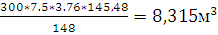
Объемная концентрация каждого компонента смеси рассчитывается следующим образом:
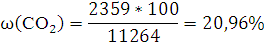
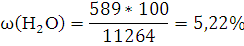
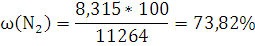
Ответ: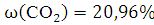 ,
, 
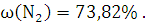
13. Рассчитайте число молекул воды и углекислого газа, которое образуется в зоне горения при полном сгорании всей массы горючего вещества.
Решение:
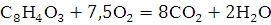
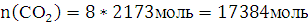
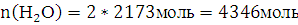
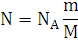
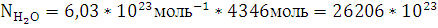
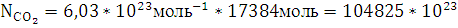
14. Воспользовавшись справочной литературой, оцените пожарную опасность н-амилового спирта. Рассчитайте давление насыщенного пара вещества, (по уравнению Антуана при 250С), сравните со справочными данными, сделайте вывод.
Решение:
Уравнение Антуана:
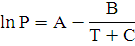
Где А, В и С-константы уравнения Антуана.
|
А |
В |
С |
|
15,9984 |
4467,01 |
-83,15 |
Значение констант для уравнения Антуана таблица 3.
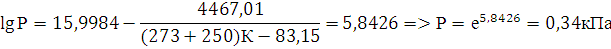
15.Опишите основные способы получения вещества и его химические свойства.
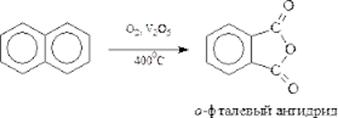
Получение фталевого ангидрида из нафталина. Для получения фталевого ангидрида используется коксохимический нафталин. Катализаторами служат ва-надийсодержащие контакты. Наиболее распространенным является ванадий-калийсульфатный катализатор на силикагеле.
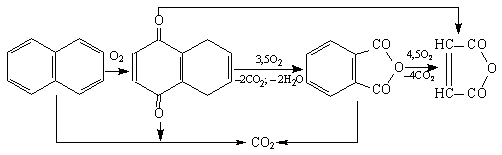
Получение фталевого ангидрида окислением нафталина
Подогретый до 100°С воздух барботируют через слой расплавленного нафталина и насыщают его парами. Смесь разбавляют дополнительным количеством воздуха и направляют в трубчатый контактный аппарат, где на неподвижном катализаторе при 370-450°С протекают реакции окисления:
16. Приведите составы и способы тушения пожаров с участием указанного вещества.
К огнетушащим веществам относятся вещества и материалы, с помощью которых прекращается горение.
Огнетушащие вещества оказывают комбинированное воздействие на процесс горения вещества. Вода может охлаждать и изолировать источник горения; пенные средства действуют изолирующее и охлаждающе; порошковые составы изолируют и тормозят реакцию горения; наиболее эффективные газовые вещества действуют одновременно как разбавители и как тормозящие реакцию горение.
Все огнетушащие вещества в зависимости от принципа прекращения горения разделяются на виды:
ü Охлаждающие зону реакции или горючие вещества (вода, водные растворы солей, твердый диоксид углерода и др.)
ü Разбавляющие вещества в зоне реакции горения (инертные газы, водяной пар, тонкораспыленная вода, газоводяные смеси и др.)
ü
ü Изолирующие вещества от зоны горения (химическая и воздушно-механическая пены, огнетушащие порошки, негорючие сыпучие вещества и др.)
ü Химически - тормозящие реакцию горения.
Любое огнетушащее вещество обладает доминирующим свойством.
Быстро ликвидировать горение можно при правильном выборе средств и способов ликвидации горения. Для этого надо знать свойства горючих веществ и их характер горения.
Вывод: анализируя свойства вещества в можно сделать вывод, что самым оптимальным средством для тушения пожара с участием этого вещества будет являться распыленная вода, воздушно-механическая пена.
ЗаключениеФталевый ангидрид - ангидрид 1,2-бензолдикарбоно-вой к-ты Представляет собой бесцветные орто-ромбичные кристаллы; легко возгоняется, плохо растворимы в этаноле и ди-этиловом эфире.Фталевый ангидрид обладает свойствами ароматических соединений. В составе фталевого ангидрида естькарбоксильная группа— одновалентная группа СООН, присутствие которой определяет принадлежность органического соединения к карбоновым кислотам в свою очередь состоящая из карбонильной -СО и гидроксильной группы - ОН.
Главным направлением использования фталевого ангидрида является
применение его сложных эфиров в качестве пластификаторов и в виде алкидных
смол для поверхностных покрытий.
Реакция полного сгорания не возможна в реальных условиях, лишь в теории. В
теории реакция будет проходить экзотермически и самопроизвольно. При полном
сгорании 300 кг выделяется Q=66*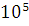 кДж
теплоты. Стехиометрический коэффициент, показывающий число молей кислорода,
необходимое для полного сгорания фталевого ангидрида в атмосфере кислорода и
воздуха β=7,5.Фталевый ангидрид является горючим веществом, легковоспламеняющимся
веществом. состоит из простых веществ, как водород, кислород и углерод. Процентное
содержание углерода в веществе составляет
кДж
теплоты. Стехиометрический коэффициент, показывающий число молей кислорода,
необходимое для полного сгорания фталевого ангидрида в атмосфере кислорода и
воздуха β=7,5.Фталевый ангидрид является горючим веществом, легковоспламеняющимся
веществом. состоит из простых веществ, как водород, кислород и углерод. Процентное
содержание углерода в веществе составляет 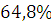 ,
водорода
,
водорода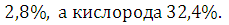 Фталевый
ангидрид горит
Фталевый
ангидрид горит 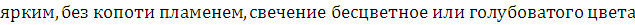
Если кислород в веществе отсутствует или
его содержание не превышает 30%, но, в свою очередь, и массовая доля углерода
не очень велика (менее 75%), то при термическом разложении будет выделяться
значительное количество частиц углерода, но при нормальном доступе воздуха в
зону горения они успевают окислиться до 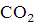 .
Объём воздуха, необходимого для полного сгорания
.
Объём воздуха, необходимого для полного сгорания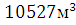 .
Объем, занимаемый при t=1500˚С
и Р=101325 Па равен
.
Объем, занимаемый при t=1500˚С
и Р=101325 Па равен 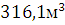 .Объем продуктов горения составляет
.Объем продуктов горения составляет 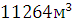 ,
процентное содержание
,
процентное содержание 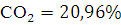 ,
,
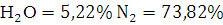 .
При полном горение вещества участвуют
.
При полном горение вещества участвуют
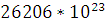 молекул
воды и
молекул
воды и 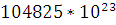 молекул
молекул
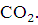 Давление
насыщенного пара фталевого ангидрида
Давление
насыщенного пара фталевого ангидрида 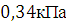 . Фталевый ангидрид получают при окислении воздухом о-ксилола или нафталина. Анализируя свойства фталевого
ангидрида можно сделать вывод, что самым оптимальным средством для тушения
пожара с участием этого вещества будет являться распыленная вода,
воздушно-механическая пена.
. Фталевый ангидрид получают при окислении воздухом о-ксилола или нафталина. Анализируя свойства фталевого
ангидрида можно сделать вывод, что самым оптимальным средством для тушения
пожара с участием этого вещества будет являться распыленная вода,
воздушно-механическая пена.
Список учебной литературы:
1. Антонов Н.С. Химическое оружие на рубеже двух столетий. - М.: "Прогресс", 1994. – 174 с.
3.http://www.chemweek.ru/spravka/catalog/el_577.htm
4. http://studopedia.org/1-33545.html
5. Бартенев Г.М., Зуев Ю.С., Прочность и разрушение высокоэластичных материалов. - М.: Химия, 1964. - 364 с.
6.Пупышев В.И. Современные представления о химической связи В: Современное естествознание: Энциклопедия в 10 т. – М.: Флинта: Наука, 1999-2000., т.1. Физическая химия. – 328 с.
7. Рабинович В. А., Хавин З. Я. Краткий химический справочник. - Л.: Химия, 1978
8. spravochnik-himika-tom-1-pocrb
9.Химия в интересах устойчивого развития (2011 г) ред.Новосибирский государственный университет под редакцией / А.Н.Михеев, В.Г.Макотченко.
10. Уравнения реакций обрыва - Справочник химика 21.
11. Киреев В.А. Краткий курс физической химии - М.: "Химия", 1970. - 640 с.














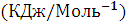

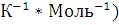
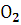
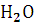
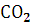
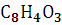
 (zip - application/zip)
(zip - application/zip)










