Государственное образовательное учреждение
высшего профессионального образования
«Санкт-Петербургский государственный университет»
Геологический факультет
Реферат
| Дисциплина: | Геохимия окружающей среды |
| Тема: | Процессы эвтрофикации, протекающие при техногенном загрязнении |
| (Наименование темы) |
| Выполнил студент | Петров. Е.А 1курс магистр каф.геохимия | ||||
| (Ф.И.О) |
Санкт-Петербург
2012 г
Содержание
Введение………………………………………………………………………..3
1.экологическая ситуация…………………………………………………………3
Тяжелые металлы………………………………………………………………4
Эвтрофикация…………………………………………………………………12
Окислительно-восстановительные процессы в водном растворе…………14
Щелочно-Кислотные условия вод…………………………………………..16
Сорбция……………………………………………………………………….17
1.Сорбционные барьеры………………………………………………………….17
2.Вторичные сорбционные ореолы рассеяния…………………………………………….18
Список литературы………………………………………………………………19
Введение
Объектом исследования данной работы является акватория Керченского пролива. Постановка задачи связана с созданием нового глубоководного порта на Таманском полуострове, интегрированного в МТК «Север-Юг» и дополняющего портовые мощности. В связи с предстоящим строительством проводится серия анализов проб вод и донных отложений с целью оценки экологической ситуации в целом, загрязнения отдельными токсикантами в настоящий момент и планирования последующего мониторинга. Особый интерес представляет прогноз возможного вторичного загрязнения воды Керченского пролива тяжелыми металлами в результате их перехода в водную фазу из донных осадков при проведении планируемых работ, в связи с чем исследуется не только поверхностный слой отложений, но и проводится опробование по скважинам.
Экологическая ситуация
Керченский пролив играет существенную роль в формировании особенностей гидролого-гидрохимического режима Азово-Черноморского бассейна и является важнейшим промысловым районом и судоходной магистралью. Формирование условий среды в проливе и их изменчивость происходит в условиях увеличения антропогенных нагрузок. Основными источниками негативного воздействия на экосистему пролива являются интенсивное судоходство, портовые и рейдовые перегрузочные комплексы, береговые источники загрязнения, расположенные в зоне Украины и Российской Федерации, дноуглубление акваторий портов и подходных каналов и дампинг изымаемых грунтов. В настоящей работе рассматриваются особенности поведения таких загрязняющих веществ, как тяжелые металлы.
Тяжелые металлы
Термин тяжелые металлы, характеризующий широкую группу токсикантов, получил значительное распространение в экологической литературе. В различных научных и прикладных работах авторы по-разному трактуют значение этого понятия. В связи с этим количество элементов, относимых к группе тяжелых металлов, изменяется в широких пределах. В качестве критериев принадлежности используются многочисленные характеристики: атомная масса, плотность, токсичность, распространенность в природной среде, степень вовлеченности в природные и техногенные циклы. В некоторых случаях под определение тяжелых металлов попадают элементы, относящиеся к металлоидам (например, мышьяк).
В химической литературе к тяжелым металлам относятся Cu, Pb, Zn, Ni, Sn; к ним примыкают так называемые малые, или младшие – Co, Sb, Bi, Hg, Cd. В (Treatise on Geochemistry, 2004) тяжелыми металлами названы Pb, Zn, Cd, Cr, Cu, Ni. В работах, посвященных проблемам загрязнения окружающей природной среды и экологического мониторинга, на сегодняшний день к тяжелым металлам относят более 40 элементов периодической системы Д.И. Менделеева с атомной массой свыше 50 атомных единиц: V, Cr, Mn, Fe, Co, Ni, Cu, Zn, Mo, Cd, Sn, Hg, Pb, Bi и др. При этом немаловажную роль в категорировании тяжелых металлов играют следующие условия: их высокая токсичность для живых организмов в относительно низких концентрациях, а также способность к биоаккумуляции. Практически все металлы, попадающие под это определение (за исключением свинца, ртути, кадмия и висмута, биологическая роль которых на настоящий момент не ясна), активно участвуют в биологических процессах, входят в состав многих ферментов. По классификации Н. Реймерса, тяжелыми следует считать металлы с плотностью более 8 г/см3.
Формально определению “тяжелые металлы” соответствует большое количество элементов. Однако, по мнению исследователей, занятых практической деятельностью, связанной с организацией наблюдений за состоянием и загрязнением окружающей среды, соединения этих элементов далеко не равнозначны как загрязняющие вещества. Поэтому во многих работах происходит сужение рамок группы тяжелых металлов, в соответствии с критериями приоритетности, обусловленными направлением и спецификой работ. Так, в работах Ю.А. Израэля в перечне химических веществ, подлежащих определению в природных средах на фоновых станциях в биосферных заповедниках, в разделе тяжелые металлы поименованы Pb, Hg, Cd, As. С другой стороны, согласно решению Целевой группы по выбросам тяжелых металлов, работающей под эгидой Европейской Экономической Комиссии ООН и занимающейся сбором и анализом информации о выбросах загрязняющих веществ в европейских странах, только Zn, As, Se и Sb были отнесены к тяжелым металлам. По определению Н. Реймерса отдельно от тяжелых металлов стоят благородные и редкие металлы; соответственно, остаются только Pb, Cu, Zn, Ni, Cd, Co, Sb, Sn, Bi, Hg. В прикладных работах к числу тяжелых металлов чаще всего добавляют Pt, Ag, W, Fe, Au, Mn. Среди тяжелых металлов, согласно данным Агентства по охране окружающей среды США (EPA), наиболее токсичны Hg, Sn, V, Mn, Mo, Pb, Zn, Cd, Cu, Cr, Ni, As. Обычно при организации мониторинга и оценке вредного воздействия загрязняющих веществ на организмы определяют содержание этих металлов. Тяжелые металлы, накапливаясь в пищевых цепях, обладают не только токсичными, но и мутагенными свойствами.
Таблица. 1. Биогеохимические свойства ряда тяжелых металлов
| Свойство | Металлы | ||||||
| Cd | Co | Cu | Hg | Ni | Pb | Zn | |
| Токсичность | В | У | У | В | У | В | У |
| Канцерогенность | - | B | - | - | B | - | - |
| Подвижность | B | H | У | В | Н | В | У |
| Тенденция к биоконцентрированию | В | В | У | В | В | В | У |
| Эффективность накопления | В | У | В | В | У | В | В |
| Комплексообразующая способность | У | Н | В | У | Н | Н | В |
| Растворимость соединений | В | Н | В | В | Н | В | В |
| Время жизни | В | В | В | Н | В | Н | В |
Примечание: В - высокая, У - умеренная, Н – низкая
1 – обнаружение повышенных содержаний каких-либо элементов по химическим анализам еще не является доказательством техногенного загрязнения объекта, поскольку это может быть всего лишь область накопления определенного минерала или минералов, т.е. ореол их рассеяния, обуславливающий естественный фон объекта;
2 – кларк многих токсичных элементов чрезвычайно мал, и поэтому даже малое количество минералов, попавших в небольшую по объему навеску для химического или физико-химического анализа, может показать высокую концентрацию определенного элемента;
3 – осадки, сложенные песками или грубообломочными породами грауваккового состава могут давать повышенные содержания некоторых элементов в зависимости от того, чем представлены обломки.
4 – богатые органическим веществом осадки могут давать высокие содержания различных элементов, в частности U, Pb, V, Se, Cu, Sr, Zn, Ni, Co, Hg, Cd, Sn, As, Mo, W, Fe, Mn, F и других, поскольку органические остатки являются мощными накопителями тяжелых металлов и токсичных элементов;
5 – если в осадках содержится значительное количество костного и раковинного детрита, то при проведении химических анализов выявится повышенное содержание фосфора, фтора, стронция, возможно, урана, мышьяка, ванадия и др. элементов;
6 – при наличии в осадках конкреций на результатах химических анализов отобразится целый спектр токсичных элементов, превышающих их ПДК.
Таким образом, для выявления геохимических особенностей поведения химических элементов большое значение имеет определение преобладающих форм их нахождения в донных осадках, так как формы нахождения элементов значительно глубже отражают сущность геохимических явлений, чем их валовое содержание.
Данные по формам нахождения химических элементов в донных отложениях позволяют наметить группы геохимических процессов, способствующих переводу этих элементов в водную фазу, например, увеличение минерализации природных вод (процессы десорбции и ионного обмена), понижение pH (растворение карбонатов), развитие анаэробной слабовосстановительной (глеевой) обстановки (разложение оксидов), деятельность микроорганизмов (разложение органических веществ и железомарганцевых оксидов), появление в водах природных и синтетических комплексообразователей, процессы взмучивания (Геохимия окружающей среды, 1990). Эти факторы в водоемах проявляются достаточно интенсивно, т.к. связаны с реально существующими природными и техногенными процессами.
На рис 1-8 представлены средние содержания тяжелых металлов и нефтеуглеводородов в зависимости от глубины отбора проб (на примере скважины).Как видно из приведенных графиков для поверхностного слоя донных осадков характерны наименьшие содержания всех исследуемых металлов и нефтеуглеводородов. Резкое увеличение их содержания наблюдается на глубине 1-2 м, а затем с глубиной оно уменьшается и возрастает на глубине >10 м. Причина выявленных закономерностей нами пока не установлена, для этого требуется более детальное изучение распределения концентраций по глубине не только для средних значений, но и для конкретных скважин, с учетом их литолого-минералогических особенностей.
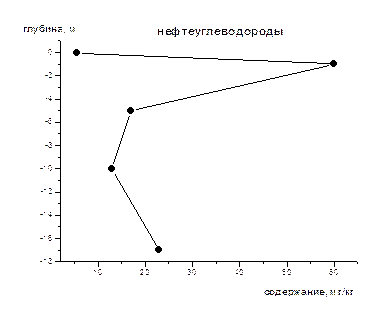
Рис.1. Изменение концентрации нефтепродуктов по глубине
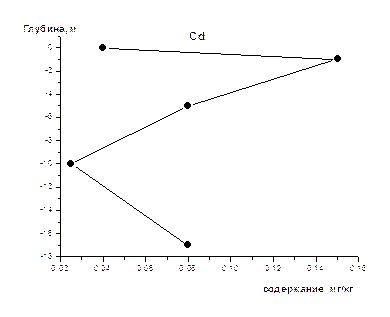
Рис. 2 Изменение концентрации Cd по глубине
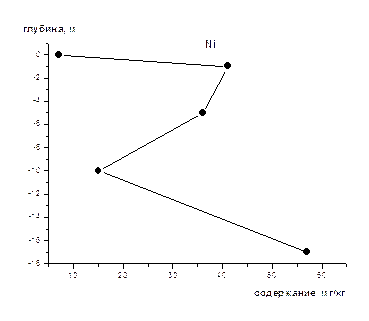
Рис. 3 Изменение концентрации Ni по глубине

Рис 4 Изменение концентрации Fe по глубине
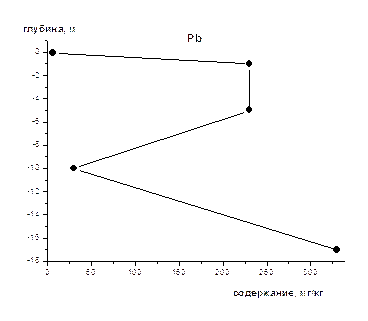
Рис . 5. Изменение концентрации Pb по глубине
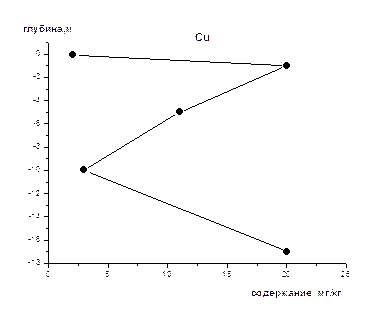
Рис. 6 Изменение концентрации Cu по глубине
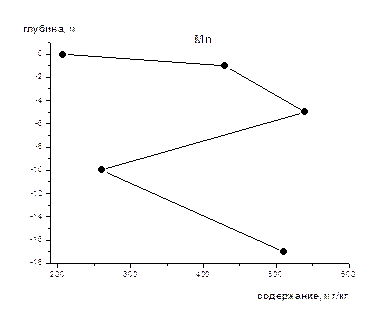
Рис 7 Изменение концентрации Mn по глубине
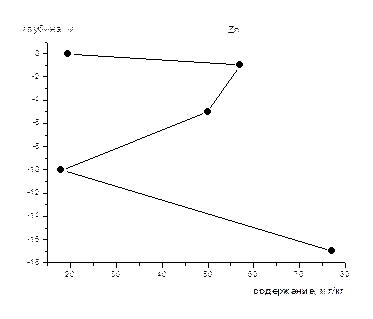
Рис 8 Изменение концентрации Zn по глубине
Эвтрофикация
Эвтрофикация — это обогащение экосистемы питательными веществами. В течение длительного периода, обычно нескольких тысяч лет, водная среда естественным образом изменяят свое состояние с олиготрофного (бедного биогенными элементами) до эвтрофного (богатого ими) или даже дистрофного, т. е. с высоким содержанием в воде не минеральных, а органических веществ. Однако в XX в. произошла ускоренная антропогенная эвтрофикация многих озер, внутренних морей (в частности, Балтийского, Средиземного, Черного) и рек по всему миру. Главной причиной этого стало усиленное применение азотных удобрений и сброс в водоемы больших количеств содержащих фосфаты бытовых сточных вод. Последнее отражает не только рост народонаселения планеты, но и современную тенденцию к увеличению его городской доли, а также совершенствование канализационных систем.
Нитраты и особенно фосфаты относятся к питательным веществам, чаще всего определяющим первичную продуктивность водных экосистем. Таким образом, добавка этих солей стимулирует быстрое размножение планктона. Консументы реагируют на рост кормовых ресурсов медленнее, поэтому увеличивается доля авто-трофов, гибнущих «естественной смертью» и непосредственно снабжающих органикой детритныс пищевые цепи. Минерализация накапливающихся остатков редуцентами требует кислорода. В результате его концентрация в воде может упасть ниже уровня, необходимого для нормального развития многих видов прежней экосистемы.
Эвтрофикация Черного моря
Морским растениям (главные из них – микроскопичеcкие одноклеточные водоросли – фитопланктон) для их роста необходимо много разных веществ, растворенных в воде, но более всего нужны азот- и фосфор-содержащие соли; диатомовым водорослям нужно еще много солей кремния, из которого они строят свои микроскопические домики. Именно концентрация азот- фосфор- и кремний- содержащих соединений обычно ограничивает рост и размножение фитопланктона в морях и океанах. Из-за их важности для жизни в море, соли азота, фосфора и кремния называют биогенными (то есть, дающими жизнь) элементами.В Черном море, особенно в его прибрежных водах, недостатка в биогенных элементах обычно нет – приносимые множеством рек, они попадают в море с частицами почвы, смываемыми с берега дождями, с городскими сточными водами, объем которых постоянно растет. Избыток биогенных элементов приводит к эвтрофикации (переудобрению) морских вод – это вредное, губительное для морской экосистемы явление.
Первая фаза процесса переудобрения:
– повышение концентрации биогенных элементов – азот- и фосфорсодержащих элементов в поверхностном слое моря способствует росту и размножению микроскопических планктонных водорослей – фитопланктона.
– рост населения в прибрежной зоне (и растущий объем сточных вод), увеличение сельскохозяйственных площадей приводит к увеличению сброса биогенных элементов в реки – и в море;
– из-за этого возникают цветения фитопланктона;
Вторая фаза процесса переудобрения:
– масса микроскопических водорослей лишает света растущие на дне многоклеточные водоросли, они начинают чахнуть.
– каждое цветение заканчивается смертью массы микроводорослей, они начинают гнить; при разложении останков водорослей расходуется весь растворенный в воде кислород – из-за этого гибнет вся местная морская флора и фауна – происходит массовый замор.
Заморы морской биоты вследствие цветений фитопланктона, вызванных переудобрением моря обычны и сейчас – в мелководных, более опресненных и эвтрофированных стоком больших рек (Дунай, Днепр, Днестр, Буг) Западной и Северо-Западной частях Черного моря, а также – в еще более мелком и переудобренном Азовском море; цветения там начались очень давно – задолго до пика черноморской эвтрофикации в конце двадцатого века. Дон, Кубань, и другие реки опресняют и удобряют воду Азовского моря еще сильнее, чем в Черном море. В результате, все теплое время года Азовское море – цветет, причем низкая соленость воды благоприятствует зеленым микроводорослям и цианобактериям (многие из которых токсичны). В июльской экспедиции по Азовскому морю в 2001 году экологи наблюдали цветение фитопланктона почти по всей его акватории, и, как результат – на каждую морскую милю пути им встречалось по одному погибшему осетру, помимо массы более мелкой погибшей рыбы.
Окислительно-восстановительные процессы в водном растворе
В гидрогеохимических системах происходят процессы обмена электронами между атомами химических элементов. Процесс потери электрона называется полуреакцией окисления, а процесс присоединения электрона к атому (иона) – полуреакцией восстановления. Величина окислительно-восстановительного потенциала(Eh) подземных вод позволяет судить о состоянии каждой окислительно-восстановительной системы в водах, а также определяет распределение и миграционные способности элементов с переменной валентностью. В подземных водах типичных окислителями являются: 1)вещества, атомы которых обладают высокими значениями электроотрицательности (элементы IVА и VIIА подгрупп) 2)ионы с дефицитом элетронов (например, простые катионы в высшей степени окисления Fe+3, Се+4 и др) 3) сложные кислородные анионы, содержащие катионы в значительной степени окисления (S+6O4, Cr+6O4, N+5O3). В общем случае окислительно-восстановительная активность компонентов возрастает при увеличении электроотрицательности. Типичными восстановителями являются: 1)элементы, атомы которых обладают наименьшей электроотрицательностью (элементы основных подгрупп I и II группы) 2)ионы, у которых степень оксиления может возрасти (S-2, Fe+2, Mn+2 др) 3)сложные анионы, в которых катион не имеет предельной степени окисления (S+4О3, NO2 др) 4)некоторые специфические вещества-атомарный водород, органические вещества. Восстановительная активность компонента тем больше, чем ниже его электроотрицательность и ионный потенциал. В любой окислительно-восстановительной системе всякое окисление сопровождается восстановлением, свободные электроны не могут накапливаться в растворе (существует принцип электронейтральности раствора), они потребляются восстанавливаемыми веществами. Окисслительно-восстановительная реакции могут протекать и с разрушением частиц, содержащие элементы переменной валентностей, например SO4+4H2+2H=H2S+4H2O
Перенос электронов от окислителя к восстановителю происходит при участии растворителя (в частности, воды) настолько быстро, что раствор сохраняет элеткронейтральность. Химические равновесия между компонентами гидрохимических систем, содержащие химические элементы в разной валентности, подчиняются закону действующих масс и описываются в понятиях термодинамики (активности, коэффициент активности), т.к электрометрические методы измерения фиксируют активности ионов, а не их концентрации в водном растворе. Для всех электронейтральных систем электрон (участник равновесия) не рассматривается в уравнениях химических реакций в качестве самостоятельно существующей частицы, поэтому необходимо совместно и одновременно рассматривать, как полуреакции окисления атомов, отдающие электроны, так и полуреакции восстановления атомов, принимающих электроны. Такой полуреакцией, дополняющей другие полураекции, принята реакция – водородный электрод. Для различных элементов и для различных растворенных частиц константы окислительно-восстановительных реакций различаются на десятки порядков (как большие, так и меньшие единицы), а стандартные потенциалы - на вольты. Поскольку вода является обязательным компонентом гидрогеохимических систем, то изменение окислительно-восстановительных свойств элементов с температурой и давлением целесообразно сравнивать при летучести Н2(г) над “чистой” водой. Величину летучести водорода Н2(г) над “чистой” водой удобно принять за нейтральную окислительно-воссстановительную среду. Некоторая избыточная летучесть H2(г) будет соответствовать восстановительной среде, а избыточная летучесть О2(г)-окислительной. Скорости реакций окисления-восстановления моноатомных частиц (Fe+2/ Fe+3 и т.д) относятся к быстрым процессам (период полуреакции-минуты-часы). Редокси-реакции деструкции органического вещества или реакции, в сопряженных парах которых учувствуют О2 или Н2О (например, восстановление SO4→S), характеризуются более медленной кинетикой (период полуреакций составляет сутки-годы). В то же время окисление сульфидной серы в щелочной среде протекает как быстрый процесс. Многие оксилительно-восстановительные процессы гидрогеохимических систем реализуются только благодаря биохимическому катализу (например, окисление N2→NO2→NO3). Скорость протекания окислительно-восстановительных реакций является камнем преткновения при решении вопроса об окислительно-восстановительных парах, реально определяющих окислительно-восстановительное состояние систем. При резкой смене восстановительных условий на окислительные возникает окислительный барьер (кислородный и .д). Он возникает и при смене резко восстановительных условий слабо восстановительными или слабоокислительных-резковосстановительными, т.е при резком повышении Eh. Для окислительных барьеров особенно характерно образование минералов гидроксидов Fe и Mn,а также самородной S. При резком понижении Eh-возникают восстановительные барьеры- сероводородные или сульфидные.
Щелочно-Кислотные условия вод
Многие катиогенные условия образуют более растворимые соединения в кислых средах и менее растворимые- в нейтральных и щелочных (Ca, Sr, Ba, Cu, Zn, Cd, Fe2, Mn, Ni, Co др). Анионогенные элементы лучше мигрируют в щелочных водах ( Cr6+, Se6+ ,Mo6+, V5+, As5 и др.). Важное геохимическое значение имеет pH начала выпадения гидроксидов металлов из разбавленных растворов их солей и произведение растворимости гидроксидов. Осаждение гидроксилов обычно заканчивается при pH на 0,5-1,5 единиц выше. Поэтому правильно говорить об интервале pH осаждения, который для Mg2+ составляет 10,5-11 Ni2+ 6,7-8 для Al3+ 4,1-6,5 и т.д. Осаждение зависит и от концентраций металлов. Например Al3+ при содержании 1г/л осаждается из раствора с pH=3,6, а при содержании 1*10-5 г/л-уже с pH=5,3. При осаждении могут возникать сравнительно устойчивые коллоидные растворы металлов, повышающие их миграционную способность. Существенные коррективы вносятся также сорбцией, образованием комплексных ионов и других явлений. Все же данные о pH осаждения во многих случаях объясняют особенности миграции элементов. Например, концентрация Fe3+ в воде при pH=4 равна, равна 2*10-6г/л, т.е очень мала. Поэтому катион Fe3+ cсуществует лишь в очень кислых водах. При повышении pH до 4Fe3+ осаждается в виде гидроксида. Al3+ также существует только в сильнокислых водах при pH =5 его концентрация понижается до 5*10-5 г/л. Ni2+, Co2+, Zn2+,Mn2+,Ag+,Cd2+ Pb2+ в значительных количествах может находиться в растворе даже при pH=8. В природных водах их содержание, как правило, много ниже и поэтому гидроксиды не осаждаются. Осаждение этих металлов связано с образованием нерастворимых сульфидов,фосфатов, арсенатов, карбонатов и др или сорбцией. Таким образом, при оценке pH как фактора миграции металлов необходимо учитывать растворимость гидроксидов и кларки элементов, их содержание в природных водах. Образование комплексных анионов сильно изменяет условия осаждения многих металлов. Для большинства металлов образование комплексных ионов повышает pH осаждения гидроксидов и вообще повышает растворимость.
Сорбция
На раздробление вещества и образование коллоидов затрачивается энергия, которая частично превращается в геохимическую энергию сорбции. Поверхность отдельной коллоидной частицы ничтожна, ничтожна и ее способность поглощать различные вещества из окружающей среды(поверхностная энергия). Однако суммарная поверхность 1г коллоидной фракции в сотни тысяч раз больше поверхности 1 г частиц, видимых простым глазом. Поэтому значительна и поверхностная энергия природных коллоидов, проявляющаяся в сорбции и теплоте смачивания. Многие металлы сорбируют тонкодисперсными частицами и мигрируют вместе с этими взвесями.
Неполярная сорбция состоит в поглощении из раствора целых молекул, например газов и паров, молекул органических веществ. В зоне гипергенеза многие глинистые минералы сорбируют из вод органические молекулы. Велика геохимическая роль и полярной сорбции-ионного обмена. Наиболее энергично поглощаются многовалентные катионы т.е энергия поглощения R3+>R2+>R+. Среди ионов с одинаковой валентностью энергия поглощения растет с ростом атомной массы и радиуса иона (Li+
Сорбционные барьеры
Они возникают на контакте Ca, K, Mg,P,S,Rb,V,Cs,Zn,Ni,Co,Cu,Pb,U,As,Mo,Hg,Ra и др элементы. Сорбционные барьеры очень характерны для морских и озерных илов, краевых зон болот, почв и кор выветривания, для контакта глин и песков в водоносных горизонтах. Существуют сорбционные барьеры и в гидротермальных системах. Существенно, что коллоиды сорбируют ионы при из концентрации в водах, не достигающей произведения растворимости. Li, Rb,Ti и др. редкие элементы как правило не образуют насыщенных растворов и для них сорбция часто является важнейщим путем перехода из раствора в твердую фазу (другой важный путь-поглощение живым веществом). За счет сорбции происходит обогащение глин, гидроксидов Mn, гумусовых веществ Cu, Ni, Co, Ba, Zn, Pb, U, Tl и другими металлами. Поэтому коллоидные минералы богаты примесями.
Вторичные сорбционные ореолы рассеяния
При фильтрации растворов с рудными элементами через суглинки, глины и д.р отложения, содержащие коллоиды, образуются вторичные сорбционные ореолы рассеяния. При этом концентрация элементов часто не сопровождается образованием рудных минералов. Состав таких ореолов во многом зависит от группы глинистых минералов. В каолинитовой группе сорбция металлов ограничена. Минералы группы монтмориллонита легко поглощают рудные элементы и в ореоле рассеяния возникают значительные их концентрации, обнаруживаемые при геохимических поисках. Важную роль в качестве сорбентов играют гидроксид Fe и Mn. На многих полиметаллических месторождениях наблюдаются безминеральные формы Pb,Zn,Cu, концентрирующиеся в гидроксидах (до 1% Pb, Cu и т.д).
Список литературы
1. Мур Дж.В., Рамамурти С. Тяжелые металлы в природных водах. - М.: "Мир", 1987.
2. Барабанов.В.Ф. Геохимия. Л.:Недра 1985г, 422с
3. Геохимия окружающей среды. Под редакцией Ю.Е. Саета. Москва: Недра, 1990. 335c.
4. А.И. Перельман Геохимия М “Высшая школа” 1989 .265 стр.














 (zip - application/zip)
(zip - application/zip)











