МИНОБРНАУКИ РОССИИ
Федеральное государственное бюджетное образовательное учреждение высшего профессионального образования
"МАТИ" – Российский государственный технологический
университет имени К.Э.Циолковского
Кафедра: "Испытание летательных аппаратов»
Реферат
по курсу: "Химия"
Тема: " Муравьиный альдегид (формальдегид)"
Студент:
Ю. С. Железнякова
Группа:
2РКК-1ДБ-249
Преводователь:
С.В. Евдокимов
Москва 2012
История открытия
Основы для понимания химической природы альдегидов были заложены работами Либиха по изучению ацетальдегида, опубликованными в 1835 г. В последующие годы были открыты другие алифатические альдегиды, которые сразу же были отнесены к этой группе химических соединений. К 1860 г. были открыты пропионовый, масляный, изовалериановый и некоторые другие альдегиды; однако формальдегид всё ещё оставался неизвестным. Та легкость, с которой метанол при окислении переходит через формальдегид в муравьиную кислоту и далее в двуокись углерода и воду, сильно затрудняла выделение формальдегида .
Впервые формальдегид был получен А. М. Бутлеровым в 1859г. при попытке синтеза метиленгликоля путем гидролиза метиленацетата, который был предварительно синтезирован путем взаимодействия иодистого метилена с уксуснокислым серебром. Бутлеров отметил характерный запах полученного раствора формальдегида, но выделить неустойчивый гликоль, разлагавшийся с выделением формальдегида и воды, ему не удалось. Бутлеров получил также твердый полимер формаоьдегида, действуя иодистым метиленом на щавелевокислое серебро. Он установил, что это соединение является полимером оксиметилена, но не показал, что оно деполимеризуется при испарении. Бутлеров получил новый полимер также и при взаимодействии иодистого метилена с окисью серебра, что послужило дополнительным подтверждением структуры полимера. Бутлеров показал, что это вещество образует с аммиаком кристаллическое соединение (гексаметилентетрамин) и даже высказал утверждение, что оно обладает такими химическими свойствами, каких можно было бы ожидать от неизвестного ещё « формальдегида ».
В 1868 г. А. Гофман получил формальдегид при пропускании смеси паров метанола с воздухом через накаленную платиновую спираль и идентифицировал его. Этот прием был положен в основу современных методов производства формальдегида.
Название вещества по номенклатуре ИЮПАК
Номенклатура ИЮПАК — это система наименований химических соединений и описания науки химии в целом. Она развивается и поддерживается в актуальном состоянии Международным союзом теоретической и прикладной химии — ИЮПАК (IUPAC).
У муравьиного альдегида существует два наименования в соответствии с правилами ИЮПАК: метаналь и формальдегид.
Алифатические альдегиды называют по самой длинной углеродной цепи (по углеродному скелету углеводородов), прибавляя к названию алифатического углеводорода окончание –аль – метаналь. И поскольку циклические соединения с альдегидной группой в боковой цепи рассматривают как замещённые алифатические альдегиды. Название производят от названия алифатического альдегида и радикала в качестве приставки (допускается тривиальное название альдегида). То есть в данном случае для альдегида данная кислота имеет тривиальное название – формальдегид.
| Формула | Название | |
| систематическое | тривиальное | |
| H2C=O | метаналь | муравьиный альдегид (формальдегид) |
Физические характеристики вещества.
Муравьиный альдегид – первый член гомологического ряда предельных альдегидов, бесцветный газ с резким, острым запахом, хорошо растворимый в воде, спиртах и полярных растворителях, ирритант (вызывает раздражительные реакции при попадании на слизистую оболочку или кожные покровы, и воздействует на дыхательные пути), токсичен.
Молярная масса – 30,03 а. е. м.
Стандартная энергия Гиббса образования, ΔG (298 К, кДж/моль) -110 кДж/моль (г)
Стандартная энтропия образования, S (298 К, кДж/моль) – 218,66 Дж/моль· K (г)
Стандартная мольная теплоёмкость, Cp (298 К, Дж/моль · K) – 35,35 Дж/моль ·K (г)
Энтальпия кипения, ΔHкип (298 К, кДж/моль) – 23,3 кДж/моль.
Стандартная энтальпия образования ΔH (298 К, кДж/моль) – 115,9 (г)
Теплота сгорания Qp – 561,1 кДж/моль.
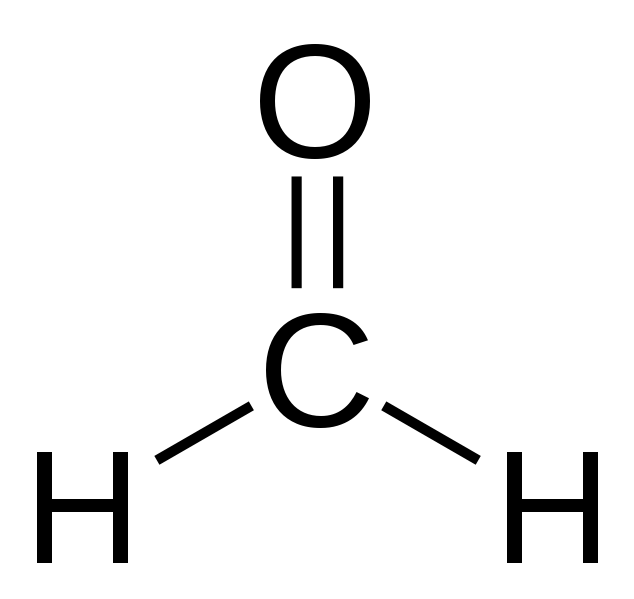
Структурная формула вещества.
Структурная формула HCOH:
Краткая характеристика класса органических соединений, к которому относится данное вещество.
Формальдегид относится к альдегидам., альдегид муравьиной кислоты (систематическое наименование: метановая кислота) — первый представитель в ряду насыщенных одноосновных карбоновых кислот. Зарегистрирована в качестве пищевой добавки под обозначением E236.
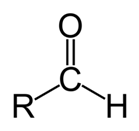 Альдегиды (от лат. alcohol dehydrogenatum — спирт, лишённый водорода) — класс органических соединений, содержащих карбонильную группу (С=О) с одним алкильным или арильным заместителем.
Альдегиды (от лат. alcohol dehydrogenatum — спирт, лишённый водорода) — класс органических соединений, содержащих карбонильную группу (С=О) с одним алкильным или арильным заместителем.
В молекулах альдегидов отсутствуют атомы водорода, способные к образованию водородных связей. Поэтому их температуры кипения ниже, чем у соответствующих спиртов Метаналь (формальдегид) - газ, альдегиды С2–C5 и кетоны С3–С4 - жидкости, высшие - твердые вещества. Низшие гомологи растворимы в воде, благодаря образованию водородных связей между атомами водорода молекул воды и карбонильными атомами кислорода. С увеличением углеводородного радикала растворимость в воде падает..
Свойства альдегидов и кетонов определяются строением карбонильной группы >C=O.
Атомы углерода и кислорода в карбонильной группе находятся в состоянии sp2-гибридизации. Углерод своими sp2-гибридными орбиталями образует 3 s-связи (одна из них - связь С–О), которые располагаются в одной плоскости под углом около 120° друг к другу. Одна из трех sp2-орбиталей кислорода участвует в s-связи С–О, две другие содержат неподеленнные электронные пары. p-Связь образована р-электронами атомов углерода и кислорода.
Связь С=О сильно полярна. Ее дипольный момент (2,6-2,8D) значительно выше, чем у связи С–О в спиртах (0,70D). Электроны кратной связи С=О, в особенности более подвижные p-электроны, смещены к электроотрицательному атому кислорода, что приводит к появлению на нем частичного отрицательного заряда. Карбонильный углерод приобретает частичный положительный заряд.
Поэтому углерод подвергается атаке нуклеофильными реагентами, а кислород - электрофильными, в том числе Н+. .
Первый член гомологического ряда предельных альдегидов НСНО - бесцветный газ, несколько последующих альдегидов - жидкости. Высшие альдегиды - твердые вещества. Карбонильная группа обуславливает высокую реакционную способность альдегидов. Температура кипения альдегидов возрастает с увеличением молекулярной массы. Кипят они при более низкой температуре, чем соответствующие спирты, например пропионовый альдегид при 48,8 оС, а пропиловый спирт - при 97,8 оС. Плотность альдегдов меньше единицы. Муравьиный и уксусный альдегиды хорошо растворяются в воде, последующие - хуже. Низшие альдегиды имеют резкий, неприятный запах, некоторые высшие - приятный запах.
Химические свойства альдегидов:
— Окисление альдегидов оксидом серебра в аммиачном растворе (реакция "серебряного зеркала")
— Окисление альдегидов гидроксидом меди (II)
— Реакции присоединения
— Реакция полимеризации и конденсации
— Окисление
— Замещение кислорода карбонильной группы
— Взаимодействие с галогенами.
Реакции получения данного вещества.
Основной промышленный метод получения формальдегида — окисление метанола:
2СН3ОН + О2 → 2НСНО + 2Н2О
Окисление метанола в формальдегид проводится с использованием серебряного катализатора при температуре 650 °C и атмосферном давлении. Это хорошо освоенный технологический процесс, и 80 % формальдегида получается именно по этому методу. Недавно разработан более перспективный способ, основанный на использовании железо-молибденовых катализаторов. При этом реакция проводится при 300 °C. В обоих процессах степень превращения составляет 99 %.
Существует также промышленный способ получения формальдегида окислением метана:
СН4 + О2 → НСНО + Н2О
Процесс проводят при температуре 450 °C и давлении 1—2 МПа, в качестве катализатора применяется фосфат алюминия AlPO4.
Формальдегид получают окислит. дегидрированием метанола в паровой фазе O2 воздуха в присутствии Ag при 680-720 0C (конверсия метанола 97-98%) либо в присутствии Ag или серебряной сетки при 600-650 0C (конверсия 77-87%) с возвращением непрореагировавшего метанола в рецикл. Процесс можно проводить в избытке воздуха в присутствии оксидов металлов (Fe-Mo-V) при 250-400 0C (конверсия 98-99%). Формальдегид может быть получен окислением метана, пропана, бутана, этилена, гидрированием СО, однако эти методы не имеют пром. значения по экономическим причинам.
Формальдегид может быть обнаружен только по запаху. В лабораторных условиях формальдегид получают дегидрированием метанола над медью.В пробирку наливают несколько капель метанола. В пламени горелки нагревают свернутый в трубочку небольшой кусочек медной сетки или спираль из медной проволоки и быстро опускают ее в метанол. При прокаливании медь окисляется и покрывается черным налетом оксида меди, в спирте она снова восстанавливается и становится красной
H3COH + CuO → HCOH + Cu + H2O
Кроме оксида меди для получения формальдегида могут быть использованы другие знакомые окислители. К слабому раствору перманганата калия в демонстрационной пробирке добавляют 0,5 мл метанола и смесь нагревают до кипения. Появляется запах формальдегида, а фиолетовая окраска перманганата исчезает.
3H3COH + 2KMnO4 → 3HCOH + 2H2O + 2MnO2 + 2КОН.
В пробирку наливают 2-3 мл насыщенного раствора бихромата калия К2Сг2О7 и такой же объем концентрированной серной кислоты. Добавляют по каплям метанол и очень осторожно подогревают смесь (отверстие пробирки направляют в сторону!). Далее реакция идет с выделением тепла. Желтая окраска хромовой смеси исчезает, и появляется зеленая окраска сульфата хрома
3H3COH + К2Сг2О7 + 4H2SO4 -> 3HCOH + 7H2O + K2SO4 + Cr2(SO4)3
Характерные для данного вещества химические реакции.
Формальдегид вступает во все реакции, характерные для алифатических альдегидов.
Из-за низкой электронной плотности на атоме углерода формальдегид легко вступает в реакции даже со слабыми нуклеофилами. Этим, в частности, объясняется тот факт, что в водных растворах формальдегид находится в гидратированной форме.

С альдегидами в присутствии сильных щелочей формальдегид вступает в так называемую перекрестную реакцию Канниццаро :
C6H5CHO + HCHO C6H5CH2OH + HCOONa
С ацетальдегидом в присутствии. Ca(OH)2 образует пентаэритрит, в паровой фазе при 285 0C - акролеин; под действием алкоголятов Al или Mg формальдегид подвергается диспропорционированию с образованием метилфомиата.
Реакция формальдегида со спиртами в присутствии сильных кислот приводит к ацеталям (формалям), с H2S - к циклич. тритиану, с HCN в присутствии щелочей - к циангидрину:
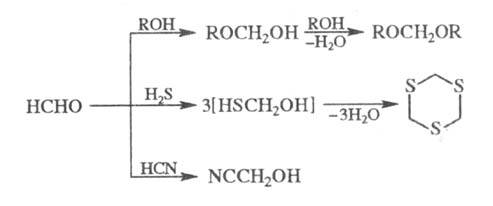
В присутствии извести формальдегид превращается в углеводы:

При взаимодействии формальдегида с NH3 образуется гексаметилентетрамин, с первичными аминами - тримеры, с вторичными - бис-(ди-алкиламино)метаны:

Соединение с подвижным атомом водорода реагируют с формальдегидом и NH3 (или аминами) по Манниха реакции. Реакция формальдегида с NH4Cl пром. способ получения метиламина:
2НСНО + NH4Cl → CH3NH2 · HCl + HCOOH
Реакция может идти дальше с образованием ди- и триметиламинов.
При действии на гексаметилентетрамин азотной кислоты образуется сильное взрывчатое вещество — гексоген.
Со спиртами в присутствии следов кислоты формальдегид легко дает соответствующие ацетали, например:
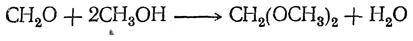
С меркаптанами и аминами формальдегид реагирует так же, как со спиртами. С гликолями, глицеринами и другими многоатомными спиртами формальдегид образует циклические метилали, например:

При действии щелочи на формалин получаются метиловый спирт и муравьиная кислота:
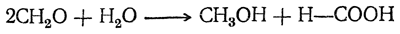
В присутствии щелочей в водном растворе может идти и другая реакция: формальдегид конденсируется, причем в числе прочих продуктов получается один из простейших сахаров, или гексоз:
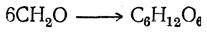
Здесь происходит конденсация шести молекул формальдегида по типу альдольной конденсации, причем она, вероятно, проходит через ряд последовательных фаз
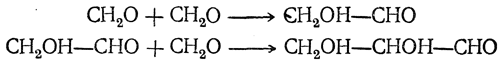
При взаимодействии формальдегида с ацетальдегидом в газовой фазе в присутствии катализаторов (окись алюминия, ацетат свинца на силикагеле и др.) образуется акролеин:
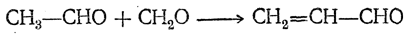
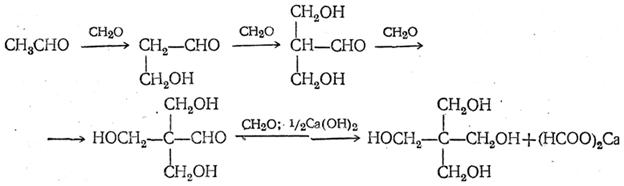
В водном растворе при большом избытке формальдегида под влиянием гидроокиси кальция конденсация с ацетальдегидом приводит к пентаэритриту:
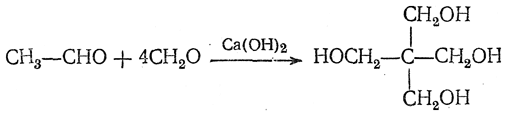
Высшие алифатические альдегиды дают в этих условиях окси-или диоксиальдегиды (в зависимости от числа α-водородных атомов)
Эти реакции проходят, по-видимому, в несколько стадий, которые для случая получения пентаэритрита могут быть изображены следующим образом:
С кетонами формальдегид реагирует аналогично, но имеются и важные отличия. Главными из них является то, что реакцию можно обрывать на промежуточных стадиях, аналогичных приведенным выше, и получать монометилолкетоны и диметилолкетоны с метилольными группами при одном и том же углеродном атоме. Другим важным отличием является образование циклических внутренних эфиров. Так, при взаимодействии с ацетоном, вместо ожидаемого гексаметилолизопропилового спирта, получается соединение

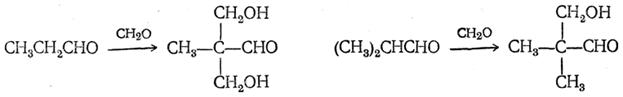
При взаимодействии формальдегида с солями жирных кислот получаются высшие альдегиды:
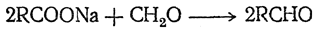
Ангидриды карбоновых кислот образуют с формальдегидом сложные эфиры метиленгликоля и диметиленгликоля, например:
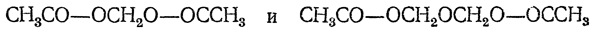
Реакция с хлорангидридами кислот напоминает реакцию с метанолом в присутствии НCl и приводит к образованию хлорметилового эфира соответствующей кислоты.
К олефинам в присутствии сильных кислот формальдегид присоединяется в виде метиленгликоля, образуя 1,3-гликоли, например:
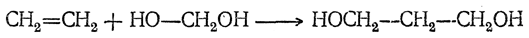
С ацетиленом реакция идет с сохранением тройной связи и приводит к пропаргиловому спирту и бутиндиолу-1,4.
Области применения.
Формальдегид является одним из важнейших исходных веществ для производства пластических масс. Особенно большое значение имеют полимеры, получаемые конденсацией формальдегида с фенолами и аминосоединениями (мочевина, меламин),изделия из них широко применяются в электротехнике, радиотехнике, машиностроении, авто- и авиапромышленности и в быту.
Формальдегид применяется также для дубления кожи, для консервирования анатомических препаратов и прочего. Такое применение основано на способности формальдегида давать с белковыми веществами эластичную массу, трудно проницаемую для воды.
Директивой 76/768 ЕЭС допускается применение формальдегида в качестве консерванта в количестве до 0,1% в составе косметических средств, предназначенных для гигиены полости рта, и до 0,2% в прочих косметических препаратах. В фармакологии препараты, содержащие до 0,5% формальдегида, применяются для снижения потливости без каких-либо ограничений, и только при применении мази, содержащей 5% этого вещества, рекомендуется не наносить ее на кожу лица. Продукция должна иметь предупреждение «содержит формальдегид», если содержание формальдегида в готовой продукции превышает 0,05%. С точки зрения спектра противомикробной активности, формальдегид проявляет активность в отношении грамположительных, грамотрицательных бактерий, дрожжеподобных и плесневых грибов. В то же время формальдегид и парабены снижают противомикробные свойства в присутствии белков. Рядом с этим установлено улучшение физико-механических свойств волоса после обработки его.
Так как формальдегид в развитых странах используется исключительно в композиции косметических препаратов, не остающихся на коже, вероятность возникновения кожной реакции была рассчитана для случаев использования шампуня, содержащего в качестве консерванта 0,1% формальдегида. Расчет показал, что нежелательная кожная реакция при применении такого шампуня возникнет только у 1 человека из 75 000. При этом в действительности эта цифра будет еще менее значимой, поскольку при проведении расчетов не учитывался ряд факторов, не поддающихся точному учету, но неопровержимо снижающих эту вероятность.
Водный 40%-ный раствор, называемый формалином, применяется в медицине как дезинфицирующее средство и консервант анатомических препаратов.
Фенолоформальдегидные смолы. Отвержденные фенолоформальдегидные смолы обладают хорошими электроизоляционными и механическими свойствами. Применяются в производстве фенопластов, клеев, лакокрасочных материалов, герметиков.
Параформ - продукт полимеризации формальдегида и содержит его не менее 95 %. Это белый, рыхлый порошок с запахом формальдегида. При нагревании легко переходит в газообразное состояние. Параформ является горючим веществом. Параформ - одно из лучших дезинфицирующих средств, пригодных для дезинфекции как при неспорообразующей, так и при споровой микрофлоре, вирусах и грибах. Для дезинфекции животноводческих помещений применяют 1-4 % растворы по формальдегиду. Растворы из порошкообразного формальдегида готовят как обычно. Для получения раствора 1 % концентрации берут 1 часть сухого параформа и 99 частей воды. Параформальдегид 4 % концентрации и выше трудно растворим в воде комнатной температуры и хорошо растворяется при нагревании воды до 50-60°С, что необходимо иметь в виду во время приготовления растворов.
Пентаэритри́т (2,2-бис(гидроксиметил)пропан-1,3-диол) C(CH2OH)4 — четырёхатомный спирт. Белый кристаллический порошок. Пентаэритрит применяется в производстве алкидных смол, пентафталевых лаков и эмалей, термостабилизаторов, взрывчатого вещества тетранитропентаэритрита
Гексаметилентетрамин ((CH2)6N4, или C6H12N4), (уротропин, гексамин, англ.: Methenamine (INN), 1,3,5,7-tetraazaadamantane, hexamethylenetetramine или hexametylenetetramine). Применяется в медицине под международным непатентованным наименованием . Впервые получен российским химиком А. М. Бутлеровым в 1859 году. Образуется при взаимодействии аммиака (3.5 моль) с формальдегидом (6 моль).
Воздействие на человеческий организм и окружающую среду.
Муравьиный альдегид (формальдегид) – раздражающий газ, обладающий общей ядовитостью. Он оказывает общетоксическое действие. Вызывает поражение ЦНС, легких, печени, почек, органов зрения. Возможно кожно-резорбтивное действие. Формальдегид обладает аллергенным, мутагенным, сенсибилизирующим, канцерогенным действием.
Предполагается, что основным путем поступления формальдегида в организм является ингаляционный. Курение – дополнительный источник. Поступление с водой – пренебрежимо мало. Опасен при попадании на кожу, слизистые, при вдыхании.
При длительном воздействии формалин оказывает аллергенное, мутогенное и канцерогенное воздействие. При постоянном воздействии высоких концентраций этого вещества могут возникнуть мутации органов. Оно влияет на почки и печень, а также на центральную нервную систему, вызывая головные боли, усталость и депрессию. Потенциально он может вызывать астму и астматические приступы. Формальдегид накапливается в организме и трудно выводится.
Симптомы отравления: бледность, упадок сил, бессознательное состояние, депрессия, затруднённое дыхание, головная боль, нередко судороги по ночам.
При остром ингаляционном отравлении: конъюнктивит, острый бронхит, вплоть до отёка лёгких. Постепенно нарастают признаки поражения центральной нервной системы (головокружение, чувство страха, шаткая походка, судороги).
При отравлении через рот: ожог слизистых оболочек пищеварительного тракта (жжение, боль в глотке, по ходу пищевода, в желудке, рвота кровавыми массами, понос), геморрагический нефрит, анурия. Возможны отёк гортани, рефлекторная остановка дыхания.
Хроническое отравление у работающих с техническим формалином проявляется похуданием, диспепсическими симптомами, поражением центральной нервной системы (психическое возбуждение, дрожание, атаксия, расстройства зрения, упорные головные боли, плохой сон). Описаны органические заболевания нервной системы (таламический синдром), расстройства потоотделения, температурная асимметрия. Отмечены случаи бронхиальной астмы.
В условиях воздействия паров формалина (например, у рабочих, занятых изготовлением искусственных смол), а также при непосредственном контакте с формалином или его растворами наблюдаются, в особенности в первые дни работы, выраженные дерматиты лица, предплечий и кистей, поражения ногтей (их ломкость, размягчение). Возможны дерматиты и экземы аллергического характера. После перенесённого отравления чувствительность к формалину повышается. Имеются сведения о неблагоприятном влиянии на специфические функции женского организма.
Формальдегид официально назван канцерогеном. Формальдегид внесён в список канцерогенных веществ ГН 1.1.725-98 в разделе «вероятно канцерогенные для человека», при этом доказана его канцерогеность для животных.
По официальным данным Международного агентства по исследованию рака, доказана связь формальдегида, применяющегося в производстве смол, пластиков, красок, текстиля, в качестве дезинфицирующего и консервирующего средства, с повышенным риском развития раковых опухолей носоглотки.
Хотя формальдегид используется в разнообразных потребительских изделиях, достаточно небольшого количества выделенного свободного формальдегида, чтобы значительно загрязнить воздух в помещении. С мебелью связаны две проблемы загрязнения жилья формальдегидом и сопутствующих жилью симптомов, которые обычно недооценивают. Только мебель для кухни или ванной потенциально может поднять уровень формальдегида в жилом помещении до 0,10 промилле и выше, особенно, когда она новая. . Проблемные изделия, среди которых основа пола из ДСП, деревянная обшивка, мебель, фанера, при производстве которых используются формальдегидные смолы. Для деревянных изделий эти смолы используются как внутренние клеи.
Формальдегидные смолы химически нестабильны. Они могут выделять как формальдегид, который не прореагировал и остался в смоле, так и формальдегид, непосредственно выделившийся при гидролитическом разложении смолы. Именно выделение непрореагировавшего формальдегида, прежде всего, является ответственным за высокие начальные уровни формальдегида в таких помещениях, как новые передвижные дома, обычные дома с основой пола из ДСП и дома, недавно изолированные с применением мочевиноформальдегидной пены.
Уровни формальдегида в жилом доме или другом здании зависят не только от мощности и количества его источников, но также и от экологических условий снаружи и внутри. Особенно существенны среди них внутренняя температура и относительная влажность. Как правило, в диапазоне 18—30 градусов Цельсия рост температуры на каждые 5 градусов приводит примерно к удвоению содержания формальдегида в воздухе. Соответственно, снижение на 5 градусов вызовет 50%-ое снижение уровня. Менее существенным, но, однако, важным эффектом обладает влажность. При увеличении относительной влажности от 30 до 70% можно ожидать приблизительно 40%-ого увеличения уровня формальдегида.
Низкая относительная влажность в течение зимнего периода во многих домах на севере — одна из главных причин значительно меньших уровней формальдегида, регистрируемых в жилых помещениях зимой. Эффект низкой влажности особенно существенен в домах с мочевиноформальдегидной пено изоляцией.
В дополнение к низкой влажности, более низкие зимние уровни формальдегида вызваны увеличением вентиляции, которая естественно понижает содержание формальдегида в воздухе помещений. Увеличение вентиляции связано с большей разницей температуры внутри и снаружи и более сильными токами воздуха. Чем больше разница температур между внутренней и внешней частью здания, тем ниже уровень формальдегида.














 (zip - application/zip)
(zip - application/zip)










