Государственное образовательное учреждение
среднего профессионального образования
«Читинский медицинский колледж»
Реферат
Тема: «Методы получения материала для цитологических исследований»
Выполнил студент
группы ЛБД 14-01
Подойницына Е.А.
Проверил преподаватель:
Никулина О.П.
Чита – 2016
Содержание:
1. Правила получения биологического материала ………………………….3
2. Виды исследуемых материалов ……………………………………………3
3. Способы получения материала для цитологического исследования ….…3
4. Правила приготовления препаратов (мазков) из биологического
материала для цитологического исследования ………………….…………7
5. Фиксация и окрашивание препаратов ………………………………………7
6. Методика окрашивания по Паппенгейму ………………………………….7
7. Методика окрашивания по Лейшману …………………………………….8
8. Правила доставки материала в лабораторию ……………………………..8
9. Иллюстрации … ……………………………………………………………..9
10. Список литературы………………………………………………………….12
11.
Правила получения биологического материала для цитологического
исследования:
Взятие материала для цитологических исследований проводит врач (с
помощью медицинской сестры): врачи-клиницисты разного профиля (гинекологи,
хирурги, онкологи, эндокринологи, врачи -эндоскописты).
Время взятия материала и условия подготовки пациентов зависят от
вида материала и способа его получения.
1. 1. Виды исследуемых материалов:
Эксфолиативный
материал:
- отделяемое различных органов (молочная железа, влагалище, мочевой
пузырь и др.); соскобы и отделяемое с поверхности эрозий, ран, язв, свищей;
соскобы с шейки матки и цервикального канала, аспираты из полости матки;
секреты желез, экскреты, мокрота, транссудаты, экссудаты, промывные воды и т.д.
Пункционный материал:
- пунктаты, полученные тонкой иглой (тонкоигольная биопсия) из опухолей, предопухолевых и опухолеподобных образований и уплотнений различной локализации (кожа, молочная железа, лёгкие, средостение, печень, почки, забрюшинные образования, щитовидная железа, предстательная железа, яичко, яичники, лимфатические узлы, миндалины, слюнные железы, мягкие ткани, кости и др.).
Биопсийный и операционный материал:
- материал, полученный при проведении хирургических
вмешательств (мазки-отпечатки, соскобы со свежего разреза удаленной ткани,
жидкость);
- материал, полученный при проведении эндоскопического
исследования (ларин-госкопии, бронхоскопии, эзофагоскопии, гастроскопии,
дуоденоскопии, лапароскопии, колоноскопии и т. д.).
Эндоскопический материал:
материал, полученный при бронхоскопии, катетеризации бронхов, эзофаго-, гастро-, дуодено-, лаборо-, ректоромано-, колоно-, цистоскопии и других видов эндоскопического обследования при любой локализации патологического процесса.
1. 2. Способы получения материала для цитологического исследования:
1.2. 1. Общие положения:
- клеточный материал наносят сухим инструментом тонким
слоем в продольном направлении (или готовят отпечатки с ткани) на чистые,
обезжиренные, сухие предметные стёкла (одноразовые).
- ёмкости для доставки материала: пробирки, чашки Петри и т. д.
должны быть одноразовыми и чистыми. Подсушивание цитологических мазков проводят
при комнатной температуре на воздухе.
- если методика окрашивания (Папаниколау и др.) требует влажной
фиксации мазка, то сразу после получения материала мазок обрабатывают аэрозолем
для фиксации или капельным фиксатором или помещают на 10 минут в 96 % спирт,
после чего препарат высушивают на воздухе.
- цитологические препараты с тканевого кусочка (отпечатки) готовят
до его обработки формалином.
- направляемый на цитологическое исследование материал нельзя
делить на части и рассылать в разные лаборатории, т.к. характерные изменения
могут быть в одной части материала и не быть в другой.
1. 2. 2. Получение эксфолиативного материала:
- мазки из отделяемого для цитологического исследования
готовятся из клеточных элементов, которые легко слущиваются с поверхности
слизистых и серозных оболочек и/или спонтанно попадают в различные выделения
(выпоты, секреты, мокроту, патологические выделения из молочной железы,
плевральный экссудат, мочу).
- для приготовления препарата капля отделяемого (из молочной железы,
свищей и др.) наносится на стекло и готовится мазок.
- мазки - отпечатки: к месту поражения прикладывается предметное
стекло, на котором остаётся некоторое количество клеточных элементов и
слизистого отделяемого:
- с места выделения (сосок молочной железы, выходное отверстие
свища):
- со слизистой оболочки, изъязвлённой поверхности слизистых и кожных
покровов;
- материал с поражённого участка можно брать также с помощью ватного
тампона и наносить на предметное стекло в виде отпечатков.
- мазки-отпечатки из соскоба готовятся с помощью шпателя, края
предметного стекла, скальпеля: соскобы делаются осторожно с легко доступных
очагов поражения, обилие слизи и некротических масс в биологическом материале
препятствуют правильному приготовлению мазка, поэтому гнойные корки и
некротические массы должны быть удалены.
- цитологические препараты из осадка доставленной в лаборатории
жидкости серозных полостей и содержимого кист получают путём пункции
плевральной, перикардиальной, брюшной полости и кист:
- в жидкость добавляют консервант, чтобы предотвратить свёртывание (1
г лимоннокислого натрия на 1 л жидкости), тщательно перемешивают.
- в лабораторию доставляют всю полученную жидкость для исследования.
- если количество жидкости слишком велико (несколько литров), то
жидкость отстаивают (около часа), сливают верхний слой, а отстоявшийся нижний
(в пределах 1л) доставляют в лабораторию; специальный контейнер для таких
количеств жидкости можно запросить в лаборатории.
1.2. 3. Получение пункционного материала:
- пункцию проводит врач, как правило, под контролем
ультразвукового исследования, реже под контролем
рентгеновского исследования.
- для получения полноценного материала для цитологического
исследования при проведении диагностической пункции необходимо соблюдать ряд
правил:
ü пункцию проводят с соблюдением правил асептики и антисептики;
ü нельзя пунктировать опухоль при подозрении на меланому; рекомендуется предварительно провести исследование крови на Белок S-100
ü перед проведением пункции опухоль тщательно пальпируют, определяют её подвижность, связь с окружающими тканями и возможность оптимальной фиксации;
ü игла и шприц для пункции должны быть абсолютно СУХИМИ;
ü не следует проводить обследуемому анестезию пунктируемого образования (сама пункция не более болезненна, чем прокол иглой для анестезии, кроме того, применение новокаина может вызвать изменение клеточных элементов);
ü мандреном, как правило, не пользуются, так как используемые для диагностических пункций иглы имеют очень маленький диаметр и косой срез на конце, игла легко продвигается через ткани, расположенные над опухолью (кожу, подкожную клетчатку, мышцы), расслаивая их, закупорка иглы происходит очень редко. Однако при пункции богато васкуляризированных образований (щитовидная железа, сосудистые опухоли, кости и др.) необходимо использовать иглу с мандреном, последний извлекается после введения иглы в исследуемое образование;
ü ПУНКЦИЮ различных образований, в том числе опухолей производят тонкой иглой (наружный диаметр 0, 6-0, 7 мм), которая присоединяется к шприцу 20 мл.
Методика проведения пункции тонкой иглой
Опухоль фиксируют пальцами левой руки. Иглу без шприца
(или с присоединённым шприцем с опущенным поршнем) вводят перпендикулярно через
кожу в исследуемое образование. По достижении очага поражения осторожно
пальпируют ткань вокруг введённой иглы, определяя правильность прокола; при
небольшом подкожном узле можно несколько наклонить иглу, при этом опухоль на
игле сместится, что ощущается пальцами и подтверждает правильное положение
иглы.
Не рекомендуется производить вращательные движения иглой, так как
это наносит лишнюю травму и не приводит к получению более полноценного
материала. После этого присоединяют шприц с опущенным поршнем (если он не был
присоединен сразу) и делают 2-3 резких насасывающих движения, снимая шприц с
иглы после каждого подъёма поршня. По окончании взятия шприц необходимо снять,
иглу извлекают без шприца, что позволяет сохранить материал; для
цитологического исследования достаточно материала попавшего в просвет иглы.
Содержимое шприца выдувается на предметное стекло при помощи шприца, который
наполняется воздухом и вновь соединяется с иглой. Содержимое размазывается по
стеклу другим стеклом или ребром иглы. Если при проколе опухоли появляется
жидкость, то под иглу подставляют пробирку и собирают жидкость. Если жидкость
не стекает, можно использовать шприц, осторожно оттягивая поршень и, набирая
жидкость в шприц, после чего шприц снимают и жидкость сливают в пробирку. После
удаления жидкости иглу вводят в более плотную ткань пунктируемого образования и
получают пунктат в просвете иглы.
1.2. 4. Получение биопсийного и операционного материала:
- цитологические препараты (отпечатки и соскобы) можно делать из материала, полученного при биопсии или хирургической операции:
Ø отпечатки выполняются путём прикладывания стекла к биопсированному кусочку или разрезу удалённой опухоли;
Ø разрез опухоли или лимфатического узла необходимо проводить сухим скальпелем, чтобы избежать разрушения клеток водой;
Ø если консистенция ткани плотная (костная, хрящевая) и не позволяет сделать отпечатки, производят соскоб с поверхности свежего разреза опухоли (путём лёгкого соскабливания предметным стеклом или скальпелем)
1.2 5.Получение эндоскопического материала:
В современных эндоскопических приборах имеются специальные приспособления для взятия материала на морфологическое исследование. При эндоскопии могут быть получены в частности;
· мазки щеточкой,
· промывные воды,
· мазки тампоном,
· мазки - отпечатки щипковых биопсий.
Выбор способа взятия материала определяется характером поражения, локализацией, возможностью проведения инструментальных исследований.
а) бронхоскопия — мазки щеточкой, трансбронхиальные пунктаты, мазки из материала щипковых биопсий, промывные воды,
б) гастроскопия — мазки щеточкой, отпечатки с щипковых биопсий,
в) колоноскопия, ректоскопия — мазки с ватного тампона, щеточные мазки, отпечатки с биопсий,
г) цистоскопия — нативная моча, спиртовый смыв, отпечатки, с биопсийных кусочков.
д) ларингоскопия — мазки с участков поражения и отпечатки с кусочков,
е) кожа и слизистые оболочки — мазки соскобов с участков поражения, при опухоли — пункция тонкой иглой.
Мягкие ткани, молочная железа, лимфатические узлы, щитовидная железа — пункция тонкой иглой.
Пункция под контролем ультразвука (щитовидная железа, опухоли шеи, печень, селезенка, почка, матки, яичники, предстательная железа, забрюшинные опухоли).
Цитологическому исследованию обязательно должны подвергаться пунктаты серозных полостей, кист, отделяемое из соскоба молочной железы и др.
Правила приготовления препаратов (мазков) из биологического материала для цитологического исследования:
Необходимой предпосылкой для точной оценки морфологических
особенностей клеток в мазке является правильно сделанный, качественно
фиксированный, хорошо окрашенный и методологически корректно изученный мазок,
поступающий в лабораторию в сопровождении необходимых клинико-инструментальных
и анамнестических данных.
Невыполнение этих условий ведёт к неправильному распределению клеток ткани,
неполному выявлению их морфологических особенностей, «пропуску» важной
диагностической информации на предметном стекле или отсутствию корригирующей
клинической информации и, тем самым, к ошибочной оценке цитологической картины,
а значит к неполноценному или ошибочному диагнозу.
Если мазки были приготовлены вне лаборатории, то в соответствии с теми же
требованиями оценивается их макроскопический вид.
Правильно приготовленный мазок из нормальной или патологически измененной ткани
должен отвечать следующим условиям:
1. Мазок должен начинаться на расстоянии 1см от узкого края предметного
стекла и заканчиваться примерно в 1,5 см от другого края предметного стекла.
Мазок не должен достигать длинного края стекла. Между мазком и длинным краем
предметного стекла должно оставаться расстояние примерно 0.3 см.
2. Хороший мазок должен быть максимально тонким (максимально
приближающимся к однослойному), равномерной толщины (не волнообразным) на всём
протяжении.
3. Мазок из осадка жидкого материала (жидкость из серозной полости,
смыв из различных органов, содержимое кистозной полости и т.п.) должен
заканчиваться у одного из узких краёв предметного стекла в виде следа,
оставленного как бы тонкой щёткой.
4. Клетки в мазке должны быть равномерно распределены. Все участки
мазка должны хорошо просматриваться; не должно быть «толстых участков»,
содержащих непросматриваемые (плохо просматриваемые) скопления или комплексы
клеток.
Фиксация и окрашивание препаратов:
Мазки можно окрашивать любым из красителей, используемых в цитологической диагностике, однако наилучшие результаты получаются при использовании различных модификаций метода Романовского (по Паппенгейму, Лейшману и др.). После приготовления мазков предварительной их фиксации не требуется, они высушиваются на воздухе.
Методика окрашивания по Паппенгейму (модификация):
1.Высушить мазок на воздухе.
2.Опустить в фиксатор-краситель Мая-Грюнвальда на 3 минуты.
3.Промыть водопроводной водой.
4.Стряхнуть избыток воды.
5Докрашивание азур-эозином: 2 части 0,1% раствора азура, 1 часть 0,1% раствора водно-растворимого эозина и 3 части дистиллированной воды pH 6,8-7,2, окрашивание 20 минут. Смесь красителей готовят перед работой (ех tempore). Мазки окрашиваются от 20 до 30 минут. (Время необходимо устанавливать опытным путем в зависимости от свойств красителей, температуры воздуха, характера материала и других факторов.)
6.Промыть водопроводной водой.
7.Высушить на воздухе.
Методика окрашивания по Лейшману:
1.Высушить мазок на воздухе.
2.Опустить в фиксатор-краситель Лейшмана на 3 минуты.
3.Промыть водопроводной водой.
4.Стряхнуть избыток воды.
5.Опустить в краску (или залить краской) 40 мл 0,1% красителя азур II, 30 мл 0,1% воднорастворимого эозина, 70 мл дистиллированной воды. Смесь красителей готовят перед работой. Мазки окрашиваются от 20 до 40 минут.
Правила доставки биологического материала в лабораторию.
1.
Флаконы с материалом и стекла-мазки должны иметь идентификацию
(маркировку):
на них должны быть чётко нанесены код или фамилия больного, идентичные коду и
фамилии в бланке направления материала для цитологического исследования.
Для приготовления цитологических препаратов предпочтительнее использовать
предметные стёкла со шлифованным краем, которые легко маркируются.
2. Цитологический материал доставляют в лабораторию в ближайшие сроки
после его взятия. Особенно это относится к жидкостям, мокроте, содержимому кист
и любому кровянистому материалу.
3. Полученный материал доставляют в лабораторию с бланком-направлением,
в котором должны быть представлены данные обследуемого пациента, диагноз,
проведённая терапия, точно должно быть указано место участка, откуда был взят
материал, и способ его получения.
4. Сотрудник внутри лаборатории, который принимает материал, должен
проверить маркировку препаратов, пробирок и т.д., оформление направления,
отметить характер и количество биоматериала, число присланных мазков.
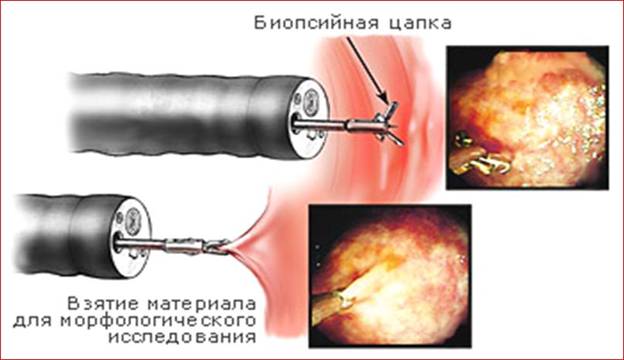
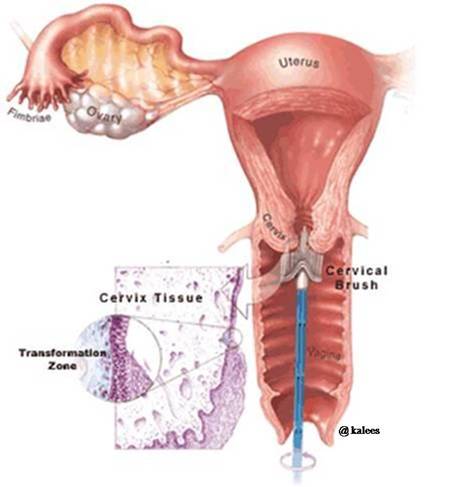
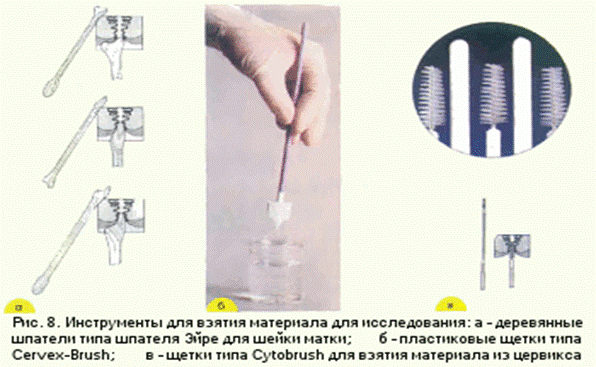
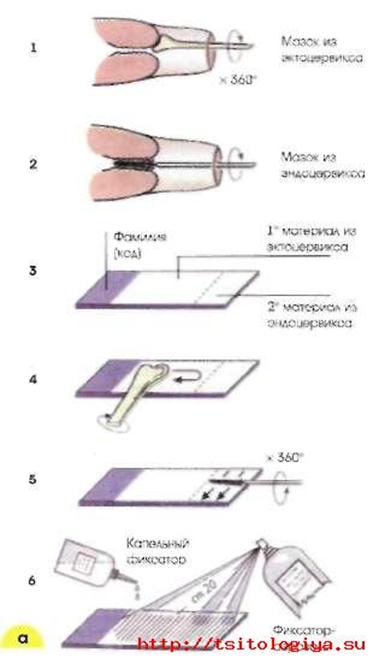
Получение материала из шейки матки и приготовление мазков: а - с помощью шпателя (1, 4), щетки (2, 5), фиксация мазков; б - с помощью щетки типа Cervex-Brush
Список литературы:
1.И.П. Шабалова, Т.В.Джангирова, Н.Н.Волченко, К.К.Пугачев. Цитологический атлас: Диагностика заболеваний молочной железы.- М.-Тверь: ООО "Издательство "Триада", 2005
2.Большая медицинская энциклопедия 1979 г.
3.Основы клинической цитологической диагностики Издатель ГЭОТАР-Медиа Шабалова И.П., Полонская Н.Ю. 2009














 (zip - application/zip)
(zip - application/zip)










