Академия Гражданской Авиации

На тему: Химические источники тока
(Электрический аккумулятор)
Выполнил: Кали Е.А. гр.-Ат(АВ)-13.2
Проверил(а): Тоймухамбетова Ф.Б.
Алматы 2016
Содержание
I. Введение
-Хими́ческий исто́чник то́ка
1.Принцип действия
2.Классификация
II.Электрический аккумулятор
1. Принцип деиствия
2. Характеристики
3. Назначение аккумуляторов в авиации
-Свинцово-кислотные аккумуляторные батареи
IV. Заключение
V. Литература
I.Введение
Хими́ческий исто́чник то́ка (аббр. ХИТ) — источник ЭДС, в котором энергия протекающих в нём химических реакций непосредственно превращается в электрическую энергию.
Химические источники электрического тока представляют устройства, в которых происходит непосредственное преобразование химической энергии в электрическую. Они подразделяются на гальванические элементы, топливные элементы и аккумуляторы.
1.Принцип действия
Основу химических источников тока составляют два электрода (отрицательно заряженный анод, содержащий восстановитель, и положительно заряженный катод, содержащий окислитель), контактирующие с электролитом. Между электродами устанавливается разность потенциалов — электродвижущая сила, соответствующая свободной энергии окислительно-восстановительной реакции. Действие химических источников тока основано на протекании при замкнутой внешней цепи пространственно-разделённых процессов: на отрицательном аноде восстановитель окисляется, образующиеся свободные электроны переходят по внешней цепи к положительному катоду, создавая разрядный ток, где они участвуют в реакции восстановления окислителя. Таким образом, поток отрицательно заряженных электронов по внешней цепи идет от анода к катоду, то есть от отрицательного электрода (отрицательного полюса химического источника тока) к положительному. Это соответствует протеканию электрического тока в направлении от положительного полюса к отрицательному, так как направление тока совпадает с направлением движения положительных зарядов в проводнике.
В современных химических источниках тока используются:
· в качестве восстановителя (материал анода) — свинец Pb, кадмий Cd, цинк Zn и другие металлы;
· в качестве окислителя (материал катода) — оксид свинца(IV) PbO2,
гидроксооксид никеля NiOOH, оксид марганца(IV) MnO2 и другие;
· в качестве электролита — растворы щелочей, кислот или солей
2.Классификация
По возможности или невозможности повторного использования химические источники тока делятся на:
· гальванические элементы (первичные ХИТ), которые из-за необратимости протекающих в них реакций невозможно перезарядить;
· электрические аккумуляторы (вторичные ХИТ) — перезаряжаемые гальванические элементы, которые с помощью внешнего источника тока (зарядного устройства) можно перезарядить;
· топливные элементы (электрохимические генераторы) — устройства, подобные гальваническому элементу, но отличающееся от него тем, что вещества для электрохимической реакции подаются в него извне, а продукты реакций удаляются из него, что позволяет ему функционировать непрерывно.
Следует заметить, что деление элементов на гальванические и аккумуляторы до некоторой степени условное, так как некоторые гальванические элементы, например щелочные батарейки, поддаются подзарядке, но эффективность этого процесса крайне низка.
По типу используемого электролита химические источники тока делятся на кислотные (например свинцово-кислотный аккумулятор, свинцово-плавиковый элемент), щелочные (например ртутно-цинковый элемент, ртутно-кадмиевый элемент, никель-цинковый аккумулятор, никель-кадмиевый аккумулятор) и солевые (например, марганцево-магниевый элемент, цинк-хлорный аккумулятор).
II. Электрический аккумулятор
Электрический аккумулятор — химический источник тока многоразового действия (то есть в отличие от гальванического элемента химические реакции, непосредственно превращаемые в электрическую энергию, многократно обратимы). Электрические аккумуляторы используются для накопления энергии и автономного питания различных устройств.
1.Принцип действия
Принцип действия аккумулятора основан на обратимости химической реакции. Работоспособность аккумулятора может быть восстановлена путём заряда, то есть пропусканием электрического тока в направлении, обратном направлению тока при разряде. Несколько аккумуляторов, объединённых в одну электрическую цепь, составляют аккумуля́торную батаре́ю.
1.Свинцово-кислотный аккумуляторПринцип работы свинцово-кислотных аккумуляторов основан на электрохимических реакциях свинца и диоксида свинца в среде серной кислоты. Химическая реакция (слева направо — разряд, справа налево — заряд):
· Анод:
{displaystyle PbO_{2}+SO_{4}^{2-}+4H^{+}+2e^{-}longrightarrow
PbSO_{4}+2H_{2}O} 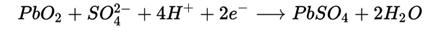
· Катод:
{displaystyle Pb+SO_{4}^{2-}-2e^{-}longrightarrow PbSO_{4}}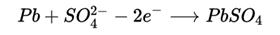
Литий-ионный аккумулятор состоит из электродов (катодного материала на алюминиевой фольге и анодного материала на медной фольге), разделенных пропитанными электролитом пористыми сепараторами. Переносчиком заряда в литий-ионном аккумуляторе является положительно заряженный ион лития, который имеет способность внедряться (интеркалироваться) в кристаллическую решетку других материалов (например, в графит, окислы и соли металлов) с образованием химической связи, например: в графит с образованием LiC6, окислы (LiMO2) и соли (LiMRON) металлов.
3.Литий-полимерный аккумуляторВ качестве электролита используется полимерный материал с включениями гелеобразного литий-проводящего наполнителя. Используется в мобильных телефонах, цифровой технике и пр.
4.Алюминий-ионный аккумуляторАлюминий-ионный аккумулятор состоит из металлического алюминиевого анода, катода из графита в виде пены и жидкого ионного невоспламеняющегося электролита. Батарея работает через электрохимическое осаждение и растворение алюминия на аноде, и интеркаляцию / деинтеркаляцию анионов хлоралалюмината в графит, используя ионный жидкий электролит. Количество возможных перезарядок батареи - более 7,5 тыс. циклов без потери мощности. Время перезарядки - 1 минута
2.Характеристики
1.Ёмкость аккумулятораЗа емкость аккумулятора принимают количество электричества равное 1 Кл, при силе токе 1 А в течении 1 с, переведем в часы, получаем 1 А*ч=3600 Кл. Но как было сказано ранее - принимают, а не измеряют. Существует распространенное заблуждение, о том, что емкость аккумулятора измеряется в А*ч, это не правда, т.к в 1 А*1 с=1 Кл или 1 А * 1 ч =3600 Кл измеряется количество электричества или электрический заряд; по формуле Q= I*t , где Q -количество электричества или электрический заряд, I - сила тока, t - время протекания электрического тока.
Например, АКБ 12 В на 55 А*ч - это значит, что аккумулятор выдает количество электричества 198 кКл (кило Кулон) по какому-либо контуру, при токе разряда 55 А за 1 ч ( 3600 с) до порогового напряжения 10,8 В, при токе разряда 255 А за 12,9 минут, но на практике это совсем не так, он разряжается гораздо быстрее. Как видно 55 А*ч - это никакая не емкость, тем более, что емкость измеряется в Фарадах, 1 Ф= 1 Кл / 1 В, ее также не стоит путать. Поэтому на АКБ написано количество электричества Q, которое он выдает, при определенном токе разряда и определенном времени его прохождения, но совсем никакая не емкость.
2.Плотность энергииПлотность энергии — количество энергии на единицу объёма или единицу веса аккумулятора.
3.СаморазрядСаморазряд - это потеря аккумулятором ёмкости после полной зарядки при отсутствии нагрузки. Саморазряд проявляется по-разному у разных типов аккумуляторов, но всегда максимален в первые часы после заряда, а после замедляется.
Для Ni-Cd аккумуляторов считают допустимым не более 10% саморазряда за первые 24 часа после проведения зарядки. Для Ni-MH саморазряд чуть меньше. У Li-ion он пренебрежимо мал и значительно себя проявляет в течение месяцев.
В свинцово-кислотных герметичных аккумуляторах саморазряд составляет около 40% за 1 год при условии 20°С и 15% при 5°С. Если температуры хранения более высокие, то саморазряд возрастает: батареи при 40°С теряют ёмкости 40% всего за 4-5 месяцев.
4.Температурный режимБерегите аккумуляторы от огня и воды, чрезмерного нагревания (охлаждения), резких перепадов температур.
Не используйте аккумуляторы при температурах выше +40°С и ниже -25°С.
Нарушение температурного режима может привести к сокращению срока службы или потере работоспособности.
5.Тип аккумулятораТип аккумулятора определяется используемыми материалами. Различают следующие:
· Cn–Po – Графен-полимерный аккумулятор.
· La-Ft – лантан-фторидный аккумулятор
· Li-Ion – литий-ионный аккумулятор (3,2-4,2 V), общее обозначение для всех литиевых аккумуляторов
o Li-Co – литий-кобальтовый аккумулятор, (3,6 V), на базе LiCoO2, технология в процессе освоения
o Li-Po – литий-полимерный аккумулятор (3,7 V), полимер в качестве электролита
o Li-Ft – литий-фторный аккумулятор
o Li-Mn – литий-марганцевый аккумулятор (3,6 V) на базе LiMn2O4
o LiFeS – литий-железно-сульфидный аккумулятор (1,35 V)
o LiFeP или LFP – Литий-железно-фосфатный аккумулятор (3,3 V) на
базе LiFePO4
o LiFeYPO4 – литий-железо-иттрий-фосфатный (Добавка иттрия для
улучшения свойств)
o Li-Ti – литий-титанатный аккумулятор (3,2 V) на базе Li4Ti5О12
o Li-Cl – литий-хлорный аккумулятор (3,99 V)
o Li-S – литий-серный аккумулятор (2,2 V)
o LMPo – литий-металл-полимерный аккумулятор
· Fe-air – железо-воздушный аккумулятор
· Na/NiCl – никель-солевой аккумулятор (2,58 V)
· Na-S – натрий-серный аккумулятор, (2 V), высокотемпературный аккумулятор
· Ni-Cd – никель-кадмиевый аккумулятор (1,2 V)
· Ni-Fe – железо-никелевый аккумулятор (1,2–1,9 V)
· Ni-H2 – никель-водородный аккумулятор (1,5 V)
· Ni-MH – никель-металл-гидридный аккумулятор (1,2 V)
· Ni-Zn – никель-цинковый аккумулятор (1,65 V)
· Pb – свинцово-кислотный аккумулятор (2 V)
· Pb-H – свинцово-водородный аккумулятор
· Ag-Zn – серебряно-цинковый аккумулятор (1,85 V)
· Ag-Cd – серебряно-кадмиевый аккумулятор (1,6 V)
· Zn-Br – цинк-бромный аккумулятор (1,8 V)
· Zn-air – цинк-воздушный аккумулятор
· Zn-Cl – цинк-хлорный аккумулятор
· RAM – щелочной элемент (1,5 V)
· Ванадиевый аккумулятор (1,41 V)
· Алюминиево-графитный аккумулятор (2 V)
· Алюминиево-ионный аккумулятор (2 V)
Электрические и эксплуатационные характеристики аккумулятора зависят от материала электродов и состава электролита. Сейчас наиболее распространены следующие аккумуляторы:
|
Тип |
ЭДС(В) |
Область применения |
|
свинцово-кислотные Pb |
2,1 |
троллейбусы, трамваи, воздушные суда, автомобили, мотоциклы, электропогрузчики, штабелеры, электротягачи, аварийное электроснабжение, источники бесперебойного питания |
|
никель-кадмиевые Ni-Cd |
1,2 |
замена стандартного гальванического элемента, строительные электроинструменты, троллейбусы, воздушные суда |
|
никель-металл-гидридные Ni-MH |
1,2 |
замена стандартного гальванического элемента, электромобили |
|
литий-ионные Li‑ion |
3,7 |
мобильные устройства, строительные электроинструменты, электромобили |
|
литий-полимерные Li‑pol |
3,7 |
мобильные устройства, электромобили |
|
никель-цинковые Ni-Zn |
1,6 |
замена стандартного гальванического элемента |
По мере исчерпания химической энергии напряжение и ток падают, аккумулятор перестаёт действовать. Зарядить аккумулятор (батарею аккумуляторов) можно от любого источника постоянного тока с бо́льшим напряжением при ограничении тока. Наиболее распространённым считается зарядный ток (в амперах) в 1/10 номинальной ёмкости аккумулятора (в ампер⋅часах), однако эта величина не имеет никакого научного обоснования.
Однако, основываясь на техническом описании, распространяемом изготовителями широко применяемых электрических аккумуляторов (NiMh, NiCd), можно сделать предположение о том, что данный режим заряда, обычно именуемый стандартным, рассчитывается исходя из продолжительности восьмичасового рабочего дня, когда разряженный в конце рабочего дня аккумулятор подключается к сетевому зарядному устройству до начала нового рабочего дня. Применение такого режима заряда для этих типов аккумуляторов при систематическом использовании позволяет соблюсти качественно-стоимостной баланс эксплуатации изделия. Таким образом с подачи изготовителя данный режим можно применять только для никель-кадмиевых и никель-металлгидридных аккумуляторов.
Многие типы аккумуляторов имеют различные ограничения, которые необходимо учитывать при зарядке и последующей эксплуатации, например NiMH-аккумуляторы чувствительны к перезаряду, литиевые — к переразряду, напряжению и температуре. NiCd- и NiMH-аккумуляторы имеют так называемый эффект памяти, заключающийся в снижении ёмкости, в случае когда зарядка осуществляется при не полностью разряженном аккумуляторе. Также эти типы аккумуляторов обладают заметным саморазрядом, то есть они постепенно теряют заряд, даже не будучи подключенными к нагрузке. Для борьбы с этим эффектом может применяться капельная подзарядка.
К сожалению, в большинстве случаев возможность систематического использования аккумуляторов есть только в портативных устройствах радиосвязи и иной цифровой технике, где используются литий-ионные аккумуляторы и система контроля заряда и разряда встроена в устройство. В бюджетном сегменте "простые" никель-металл-гидридные и никель-кадмиевые аккумуляторы используются в качестве бюджетной замены щелочных элементов питания. В качестве источника тока для бюджетного аккумуляторного электроинструмента используются никель-кадмиевые аккумуляторы. Если в первом случае обычно есть возможность выбирать между бюджетным устройством "стандартного" заряда и з. у. с контролем заряда (капельный заряд, импульсный заряд, ускоренный заряд с контролем напряжения и т. д.), то во втором случае изделие комплектуется как правило трансформаторным источником питания для зарядки постоянным током, что при несоблюдении технических условий эксплуатации аккумулятора снижает срок его службы.
3. Назначение аккумуляторов в авиации
На самолетах и на аэродромах используются кислотные и щелочные аккумуляторы. По назначению аккумуляторы делятся на бортовые и аэродромные (наземные).
К основным параметрам, характеризующим электрические свойства аккумуляторов, относятся:
-электродвижущая сила Е, (В);
-внутреннее сопротивление Rа, (Ом);
-напряжение U, (В);
-емкость Q, (А.ч).
Внутреннее электрическое сопротивление аккумулятора определяется в основном сопротивлением электролита и электродов. Авиационные аккумуляторы обладают малым внутренним сопротивлением, что позволяет получать большие токи при незначительных внутренних потерях.
Напряжение аккумулятора отличается от его ЭДС на величину падения напряжения на внутреннем сопротивлении Ra при протекании тока заряда I3 или разряда Iр (при заряде U = Е + I3 Ra, при разряде U = Е — Iр Rа ).
Емкость аккумулятора определяется количеством электричества, которое можно получить от полностью заряженного аккумулятора при разряде его током постоянной величины до допустимого минимального остаточного напряжения.
Номинальная емкость аккумулятора – количество электричества, которое аккумулятор способен отдать, будучи заряженным, при определенных условиях (температура, режим разряда и конечное напряжение). Емкость аккумулятора измеряется в ампер-часах (а.ч).
Из авиационных аккумуляторных батарей наиболее распространены следующие:
-кислотные бортовые 12-САМ-28, 12-САМ-55, 12-АСАМ-23;
-щелочные бортовые 20-НКБН-25, VARTA, SAFT.
Первые цифры указывают число последовательно соединенных аккумуляторов в батарее, последние - номинальную емкость батареи в ампер -часах. Буквы обозначают: САМ - стартерная авиационная моноблочная; АСАМ - авиационная стартерная с абсорбированным электролитом моноблочная; НКБН - никелево - кадмиевая безламельная намазная.
1.СВИНЦОВО-КИСЛОТНЫЕ АККУМУЛЯТОРНЫЕ БАТАРЕИ
Назначение аккумуляторов
Авиационные свинцово-кислотные аккумуляторные батареи относятся к химическим источникам тока. Каждая авиационная аккумуляторная батарея состоит из 12 последовательно соединенных аккумуляторов (элементов). Это позволяет иметь на клеммах аккумуляторной батареи номинальное напряжение в 24 в.
В целях сокращения авиационные аккумуляторные батареи часто называют «авиационная батарея», «авиационный аккумулятор» или «батарея», «аккумулятор».
По назначению авиационные аккумуляторы разделяются на 2 группы:
1-я группа — бортовые аккумуляторы;
2-я группа — аэродромные аккумуляторы.
К бортовым авиационным аккумуляторам относятся следующие типы аккумуляторов 12-А-5, 12-А-10, 12-А-ЗО, 12- АСАМ-23, 12-САМ-28, 12-САМ-55.
Эти аккумуляторы устанавливаются на самолете и предназначаются:
а) для питания электроэнергией потребителей самолета, когда генератор не работает (например, при стоянках самолета или при выходе генератора из строя). В этом случае бортовые авиационные аккумуляторы служат резервными источниками электроэнергии;
б) для автономного запуска двигателей самолетов. Последнее относится только к бортовым авиационным аккумуляторам типов 12-АСАМ-23, 12-САМ-28 и 12-САМ-55.
К аэродромным авиационным аккумуляторам относятся аккумуляторы типов 12-АО-50, 12-АО-52 и 12-АСА-145.
Эти аккумуляторы устанавливаются на специальных тележках или автомобилях и предназначаются:
а) для запусков двигателей самолетов всех типов;
б) для проверки электрооборудования самолета перед полетом. Внешний вид аккумулятора приведен:
на фиг. 1,2, 3—12-А-5, 12-А-10и 12-А-ЗО, на фиг. 4, 5— 12-САМ-28 и 12-САМ-55, " на фиг. 6— 12- АСАМ-23, на фиг. 7, 8— 12-АО-50 и 12-АО-52.




Заключение
Одним из наиболее перспективных методов преобразования энергии является электрохимический способ преобразования химической энергии в электрическую, который осуществляется в химических источниках тока. К достоинствам последних относится высокий КПД, бесшумность, безвредность, возможность использования в космосе и под водой, в переносных устройствах, на транспорте и т. п.
Электрохимические процессы заключаются в том, что атомы или ионы одного из активных веществ отдают свои электроны, а атомы или ионы другого вещества принимают их. Эти процессы происходят в пространстве, заполненном жидким электролитом. Переход электронов от одного реагирующего вещества к другому возможен при соединении этих веществ внешним проводником. Выделяющаяся энергия веществ проявляется в виде электрического тока, протекающего по замкнутой цепи, т. е. происходит разряд источника энергии. При разряде химическая энергия превращается в электрическую, а реагирующие вещества - в продукты разряда.
Проводятся исследования по совершенствованию существующих и созданию новых аккумуляторов. Это в значительной степени обусловлено необходимостью создания электромобилей, не дающих вредных выбросов в окружающую среду. В настоящее время в Советском Союзе и других странах уже создано несколько моделей электромобилей со свинцовыми аккумуляторами. Однако эти электромобили имеют малый пробег между зарядами аккумулятора (до 60 км) из-за невысокого значения его удельной энергии. Такие электромобили могут использоваться, если пробег за день невелик (грузовые фургоны, машины коммунального хозяйства). Необходимо создать недорогой аккумулятор, удельная энергия которого значительно превышала бы удельную энергию свинцового аккумулятора.
Разработаны
никель-цинковые аккумуляторы, в которых отрицательным электродом служит цинк, а
положительным электродом — гидроксид никеля. Удельная
энергия около  что обеспечивает
пробег электромобиля без заряда 100—150 км. Ведется разработка серно-натриевого
аккумулятора с твердым электролитом. Отрицательным электродом служит натрий, положительным
— сера в смеси с графитом, электролитом — соединение
что обеспечивает
пробег электромобиля без заряда 100—150 км. Ведется разработка серно-натриевого
аккумулятора с твердым электролитом. Отрицательным электродом служит натрий, положительным
— сера в смеси с графитом, электролитом — соединение  , обладающее
нонной (по Na) проводимостью.
Удельная энергия аккумулятора достигает
, обладающее
нонной (по Na) проводимостью.
Удельная энергия аккумулятора достигает  .
.
Литература
· Войнаровский П. Д.,. Электрические аккумуляторы // Энциклопедический словарь Брокгауза и Ефрона : в 86 т. (82 т. и 4 доп.). — СПб., 1890—1907.
· Web-сайт: studopedia.org
· Web-сайт: wikipedia.org
· Web-сайт: guap.ru













 (zip - application/zip)
(zip - application/zip)










