РЕФЕРАТ на тему:
Идиопатическая тромбоцитопеническая пурпура.
Выполнил: студент 643 группы Начинов О.Б
Проверила ассистент кафедры: Власова А.Н
Содержание:
1. Введение……………………………………………………….3
2. Этиопатогенез…………………………………………………3
3. Классификация……………………………………………….6
4. Клиника………………………………………………………..7
5. Диагностика…………………………………………………..10
6. Дифференциальная диагностика………………………….11
7. Лечение……………………………………………………….15
8. Диспансеризация…………………………………………….23
9. Список литературы....................................................................
Введение:
Идиопатическая тромбоцитопеническая пурпура (ИТП), или болезнь Верльгофа (ранее — геморрагическая тромбоцитопения), — одно из первых идентифицированных геморрагических заболеваний человека. Впервые описано в 1735 году, еще задолго до того, как были обнаружены сами тромбоциты, ганноверским врачом Верльгофом. Причиной кровоточивости почти в 80 % случаев являются патологические изменения тромбоцитов (их функциональная несостоятельность и/или количественный дефицит). При этом лидирующая позиция в структуре патологии этих форменных элементов принадлежит количественному дефекту кровяных пластинок.
Термин «тромбоцитопения» подразумевает снижение количества тромбоцитов в периферической крови менее 150 х 10 9 /л. Процесс считается идиопатическим, если причину его выявить не удается. Примерно 95 % случаев всех тромбоцитопений (по данным Американского общества гематологов, 1996) относятся именно к этой группе. Понятие «пурпура» (лат. purpura — краска темно-багрового цвета) предусматривает наличие капиллярных геморрагий, точечных кровоизлияний и экхимозов.
Заболеваемость ИТП составляет 1,5–2,0 на 100 тыс. детского населения. Частота ИТП достигает 125 на 1 млн детского и взрослого населения в год.
Заболевание может возникать в любом возрасте, но чаще развивается в преддошкольном и школьном периоде. После 10-летнего возраста прослеживается отчетливое преобладание девочек, которые болеют в 2 раза чаще мальчиков.
Этиопатогенез
Развитие ИТП может быть спровоцировано воздействием ряда факторов, которые нельзя однозначно назвать этиологическими. Действие провоцирующих факторов реализуется на фоне конституциональной предрасположенности организма. В роли провоцирующих факторов могут выступать вирусы, реже бактериальные агенты, профилактические прививки, лекарственные препараты, избыточная инсоляция, переохлаждение, физические и психические травмы, операции и т.д. Время с момента воздействия провоцирующих факторов до развития пурпуры в среднем составляет 2 недели. Однако примерно у трети больных ИТП начинается без видимой причины.
Механизм развития тромбоцитопении при ИТП заключается в повышенной деструкции тромбоцитов в периферическом русле. Причем степень развития тромбоцитопении определяется как скоростью разрушения кровяных пластинок, так и компенсаторными возможностями костного мозга. Динамическое равновесие этих двух процессов обеспечивает нормальное содержание тромбоцитов в периферической крови. Сдвиг в сторону ускорения процессов разрушения приводит к развитию тромбоцитопении.
Повышенное разрушение тромбоцитов при болезни Верльгофа вызвано реализацией иммунопатологического процесса. В настоящее время иммунный генез ИТП общепризнан, что подтверждается обнаружением антитромбоцитарных антител (АТ), высоким содержанием IgG на поверхности тромбоцитов, обнаружением лимфоцитов, сенсибилизированных к аутотромбоцитам, в крови больных. Пусковым моментом иммунопатологического процесса при ИТП является нарушение переваривающей способности макрофагов селезенки под влиянием провоцирующих факторов, приводящее к снижению нормальной дезинтеграции тромбоцитов в них. При этом на поверхность макрофагов поступают тромбоцитарные антигены, в норме на ней не появляющиеся, что приводит к контакту с лимфоцитами «скрытых» ранее от них тромбоцитарных антигенов.
Продолжительность жизни тромбоцитов при ИТП резко сокращается: с 7–10 дней до нескольких часов. Продукция же их в костном мозге остается нормальной или даже возрастает (гиперрегенераторная тромбоцитопения). Отшнуровка тромбоцитов от мегакариоцитов происходит гораздо быстрее, чем в физиологических условиях, однако при ИТП создается ошибочное впечатление о нарушении этого процесса. В большинстве случаев количество мегакариоцитов при тромбоцитопении увеличивается, резко ускоряется отщепление кровяных пластинок от них, значительно возрастает (в 2–6 раз по сравнению с нормой) число тромбоцитов, образующихся в единицу времени. Увеличение числа мегакариоцитов и гиперпродукция тромбоцитов связаны с ростом выработки тромбопоэтинов в ответ на снижение количества кровяных пластинок. Так как антитела могут быть направлены и против мегакариоцитов, то в такой ситуации этот росток представляется опустошенным (гипорегенераторная тромбоцитопения).
Роль селезенки в развитии ИТП не ограничивается нарушением переваривающей способности ее макрофагов, что играет роль пускового механизма в развитии иммунопатологического процесса при воздействии провоцирующих факторов. Помимо этого селезенка является местом продукции антитромбоцитарных антител, вырабатывающихся селезеночным пулом лимфоцитов, а также органом, где происходит деструкция тромбоцитов и поглощение их макрофагами. При ИТП создается порочный круг: с одной стороны, внутрисосудистый лизис тромбоцитов под влиянием антитромбоцитарных АТ наряду с их усиленной деструкцией в селезенке приводит к компенсаторной активации тромбоцитопоэза, в то время как гибель кровяных пластинок, на поверхности которых содержатся иммуноглобулины, приводит к активации В-лимфоцитов, в результате чего стимулируется выработка антитромбоцитарных антител, которые вновь вызывают разрушение оставшихся в кровотоке кровяных пластинок. Тромбоциты же, загруженные иммунными комплексами, фагоцитируются макрофагами и нейтрофилами. Последние выделяют фактор, активирующий тромбоциты (FAT). Действие этого фактора приводит к усилению агрегационной функции и секреторных процессов тромбоцитов, оставшихся в кровотоке, что вызывает снижение их функциональных свойств, т.е. к количественному дефекту тромбоцитов присоединяется и качественный — развивается тромбоцитопатия.
Получив ответ на вопрос о причинах развития геморрагического синдрома при ИТП, врачу предстоит ответить на следующий: каков же механизм его развития?
Развитие геморрагического синдрома при болезни Верльгофа преимущественно обусловлено нарушением ангиотрофической функции тромбоцитов. Известно, что компенсаторные возможности детского организма чрезвычайно высоки. Свидетельством этого является тот факт, что трофику сосудов поддерживают всего лишь 10–15 % циркулирующих в кровотоке тромбоцитов. Именно этого количества кровяных пластинок, а это 15–30 х 109/л тромбоцитов, достаточно для поддержания трофики сосудов и эффективного гемостаза. При тяжелой тромбоцитопении сосудистый эндотелий, лишенный тромбоцитарной подкормки, становится порозным, повышенно проницаемым, что приводит к возникновению спонтанных геморрагий. Наряду с нарушением ангиотрофической функции кровяных пластинок имеет место нарушение процессов свертывания (снижение потребления протромбина, нарушение ретракции кровяного сгустка) и активация системы фибринолиза. Вследствие тромбоцитопении и тромбоцитопатии при ИТП снижается содержание серотонина, секретируемого кровяными пластинками, физиологическая роль которого заключается в обеспечении вазоконстрикции мелких сосудов. Его дефицит в определенной мере поддерживает кровоточивость при небольших травмах.
В большинстве случаев геморрагический синдром в виде проявлений на коже и слизистых манифестирует при снижении числа кровяных пластинок в периферической крови менее 30–50 х 109/л. Кровоточивость же возникает достаточно поздно, обычно при снижении числа тромбоцитов менее 20–30 х 109/л. Серьезное спонтанное кровотечение (например, желудочно-кишечное) или геморрагический инсульт развиваются, как правило, при тромбоцитопении менее 10 х 109/л. Поэтому тромбоцитопения во врачебной практике довольно часто встречается в качестве лабораторного феномена и является случайной находкой, так как клинически при уровне тромбоцитов более 50 х 109/л практически себя не проявляет. Необходимо помнить, что наличие геморрагического синдрома при количестве тромбоцитов более 70 х 109/л требует исключения их качественного дефекта.
Классификация:
Формы:
— гетероиммунная. Эта форма возникает при изменении антигенной структуры кровяных пластинок под влиянием различных воздействий (вирусов, новых антигенов, гаптенов). Имеет благоприятный прогноз: по окончании действия причинного фактора тромбоциты восстанавливают свои антигенные свойства и выработка антител прекращается. Имеет острое течение. У детей чаще развивается именно эта форма тромбоцитопенической пурпуры;
— аутоиммунная. Эта форма развивается в результате действия на тромбоциты аутоантител, вырабатывающихся против собственных неизмененных кровяных пластинок, мегакариоцитов, а также антигена общего предшественника тромбоцитов, эритроцитов, лейкоцитов — стволовой клетки. Имеет хроническое, рецидивирующее течение. Начальные пусковые звенья выработки аутоантител остаются неясными.
По течению:
1) острое (до 6 мес.);
2) хроническое (более 6 мес.):
— с рецидивами (редкими, частыми);
— непрерывно рецидивирующее.
По периодам:
1) обострения (криз);
2) ремиссии:
— клинические (отсутствие геморрагий при наличии лабораторной тромбоцитопении);
— клинико-гематологические (отсутствие клинических и лабораторных проявлений тромбоцитопении).
По тяжести:
1) легкая (кожный синдром);
2) средней тяжести (умеренно выраженный геморрагический синдром в виде кожных проявлений и кровотечений, количество тромбоцитов 50–100 х 10 9 /л);
3) тяжелая (длительные и обильные кровотечения, кожные проявления, количество тромбоцитов менее 30–50 х 109/л, постгеморрагическая анемия).
Выделение таких форм несколько условно, так как степень тромбоцитопении не всегда соответствует степени кровоточивости. Клинический интерес представляет классификация, предложенная W. Grosby (1975), подразделяющая пурпуру в зависимости от отсутствия или наличия кровотечения на «сухую» и «влажную», что соответствует легкой и среднетяжелой либо тяжелой формам ИТП.
Клиника:
Заболевание у детей в большинстве случаев начинается остро, с выраженных клинических проявлений, чаще через 2 недели после воздействия провоцирующего фактора. Но у части больных (примерно у половины пациентов с хроническим течением) ИТП начинается исподволь. Причем первые признаки заболевания довольно часто остаются незамеченными либо объясняются травматизацией, так как дети физически очень активны и легко травмируются. Незамеченной остается неадекватность геморрагий перенесенному механическому воздействию. И только в последующем, при манифестации клинических проявлений заболевания, тщательный сбор анамнеза позволяет выявить наличие первых признаков заболевания в более ранние периоды жизни ребенка и их неадекватность травме.
Клинически ИТП проявляет себя кожным геморрагическим синдромом и кровотечениями из микроциркуляторного русла.
Кожный геморрагический синдром представлен экхимозами и петехиями. Для него характерны те же признаки, что и для геморрагического синдрома, возникающего при тромбоцитопениях иного генеза: спонтанность, несимметричность, полиморфность и полихромность.
Геморрагии возникают спонтанно (преимущественно ночью) или под влиянием легких ушибов, сдавлений. Они несимметричны, излюбленной локализации в отличие от геморрагического васкулита не имеют. Однако несколько чаще располагаются на конечностях и передней поверхности туловища (большая травматизация этих зон), а также на лбу (близость костных образований). Довольно часто геморрагии возникают в местах инъекций. Геморрагии не возникают на ладонях, подошвах. Кровоизлияния в слизистые оболочки отмечаются примерно у 2/3 больных. Это прежде всего слизистые ротовой полости (неба, глотки, миндалин), глаз (конъюнктива, склеры). Описаны кровоизлияния в стекловидное тело, сетчатку. Наличие геморрагий в области головы, особенно орбиты глаза, рассматривается как прогностически неблагоприятный признак, свидетельствующий о тяжести состояния и указывающий на высокий риск развития кровоизлияний в головной мозг.
Геморрагии при ИТП полиморфны, имеют характер петехий и экхимозов различных размеров (от 0,5 до 10 см и более в диаметре) и форм. Так как геморрагический синдром склонен к рецидивированию, то имеет место полихромность, обусловленная наличием геморрагий, находящихся на различных стадиях обратного развития: элементы в зависимости от давности их появления имеют разную окраску — от ярких пурпурных до сине-зеленых и желтых. Кожа больного приобретает сходство со шкурой леопарда — «шагреневая кожа». Обращает на себя внимание неадекватность геморрагий степени внешнего механического воздействия.
Кровотечения из микроциркуляторного русла . Как правило, кровотечения развиваются параллельно кожному геморрагическому синдрому. Наиболее типичны спонтанные носовые кровотечения, нередко упорные, обильные, рецидивирующие. Возможно также развитие десневых, маточных, реже желудочно-кишечных, почечных кровотечений. Иногда заболевание сопровождается минимальными проявлениями в виде кровоточивости десен.
Нередко заболевание проявляет себя длительным кровотечением после удаления зубов. Оно начинается сразу же после вмешательства, длительно (несколько часов, реже день) не купируется, однако после остановки, как правило, не возобновляется, чем и отличается от кровотечения при коагулопатиях, в частности гемофилии.
В тяжелых случаях возможны кровоизлияния в головной мозг, другие жизненно важные органы (в том числе и надпочечники), что может служить непосредственной причиной смерти. Частота их колеблется в пределах 1–3 %. Кровоизлияния в головной мозг развиваются у больных с «влажной» пурпурой, как правило, в первый месяц заболевания. Симптоматика кровоизлияния в головной мозг не является специфичной: головная боль, головокружение, рвота, судороги, менингеальный симптомокомплекс, коматозное состояние или сопор, гемипарезы, параличи. При этом число тромбоцитов у больных, как правило, не превышает 10 х 109/л.
У девочек пубертатного периода при ИТП менструации обильные, длительные (до 2–5 недель), нередко приводящие к анемизации, в тяжелых случаях возможно развитие длительных ювенильных маточных кровотечений, требующих активной лечебной тактики.
За исключением признаков повышенной кровоточивости, состояние больного с ИТП не страдает. Отсутствуют симптомы интоксикации, температура тела нормальная, лимфатические узлы не увеличены. При развитии постгеморрагической анемии могут появиться соответствующие жалобы и изменения со стороны сердечно-сосудистой системы. Эти нарушения быстро нормализуются после ликвидации анемии.
Отличительным признаком болезни Верльгофа от вторичных тромбоцитопений является отсутствие гепатоспленомегалии. Лишь у 10 % детей раннего возраста, больных ИТП, возможно незначительное увеличение (на 1–2 см) селезенки.
При гетероиммунной форме ИТП, для которой характерно острое течение, геморрагический синдром обычно удается купировать в течение месяца с довольно быстрой обратной динамикой клинических симптомов. Выздоровление нередко наступает уже через 2–3 месяца. Однако первые клинические проявления заболевания не позволяют отнести конкретный случай ИТП к определенной форме. По дебюту заболевания предсказать дальнейшее его течение трудно. Болезнь начинается остро и бурно не только во всех случаях гетероиммунной тромбоцитопении. Такое же начало отмечается примерно у половины больных аутоиммунной тромбоцитопенией. Однако при этой форме болезнь может начинаться и исподволь, постепенно, без выраженных острых клинических проявлений и, как правило, без видимой причины. Первый криз может принимать затяжной характер и, несмотря на проводимую терапию, клинико-лабораторные проявления могут удерживаться длительно. Иногда на фоне лечения глюкокортикоидами признаки болезни исчезают, число тромбоцитов нормализуется. Однако после их отмены (а в некоторых случаях на фоне снижения дозы кортикостероидов) или после какой-либо инфекции (провокации) вновь наступает обострение, заболевание принимает хроническое волнообразное течение, когда периоды улучшения вновь сменяются периодами обострения, и затягивается на многие годы. Получить полную клинико-гематологическую ремиссию при аутоиммунной форме бывает очень трудно.
Факторами риска хронического течения ИТП по Н.П. Шабалову (1998) являются:
— наличие указаний в анамнезе на частую упорную кровоточивость, наблюдаемую ранее чем за полгода до криза, по которому поставлен диагноз ИТП;
— отсутствие связи развития криза с действием какого-либо провоцирующего фактора;
— наличие у больного хронических очагов инфекции;
— лимфоцитарная реакция костного мозга (число лимфоцитов более 13 %);
— низкое содержание Т2 — лимфоцитов-супрессоров в периферической крови до начала гормональной терапии;
— выраженные упорные кровотечения в сочетании с генерализованной пурпурой на фоне проводимой терапии;
— возникновение ИТП у девушек в пубертатном возрасте.
Диагностика ИТП:
Базируется на адекватной оценке жалоб, анамнеза, клинических проявлений, положительных результатов проб на резистентность капилляров (жгута, щипка, Кончаловского — Румпель — Лееде), изменений лабораторных показателей: снижение количества тромбоцитов периферической крови менее 150 х 10 9 /л, увеличение длительности кровотечения по Дюке более 4 мин, снижение ретракции кровяного сгустка менее 60–75 %, увеличение содержания мегакариоцитов в костном мозге более 54–114 в 1 мкл (либо снижение при длительно текущих кризах), обнаружение антитромбоцитарных антител, нарушение функциональных свойств тромбоцитов (снижение адгезии, нарушение агрегации к АДФ, тромбину, коллагену), увеличение размеров кровяных пластинок, их пойкилоцитоз, появление малозернистых «голубых» клеток.
Все же главным лабораторным признаком ИТП является тромбоцитопения. Однако для постановки диагноза и начала терапии однократного лабораторного выявления тромбоцитопении недостаточно. Необходимо проведение повторного (на протяжении недели с интервалом в 2–3 дня) исследования периферической крови с определением числа кровяных пластинок и обязательным изучением формулы крови. Общий анализ крови при ИТП практически не изменен. Однако в случаях обильных кровопотерь в анализе периферической крови выявляются признаки постгеморрагической анемии и ретикулоцитоз.
Выявление провоцирующего инфекционного фактора (в случаях гетероиммунных форм тромбоцитопении) базируется на обнаружении диагностически значимого повышения титра антител к тому или иному возбудителю (довольно часто к цитомегаловирусу, вирусу Эпштейна — Барр, парвовирусу В19, вирусам краснухи, кори, ветряной оспы и др.).
Дифференциальная диагностика:
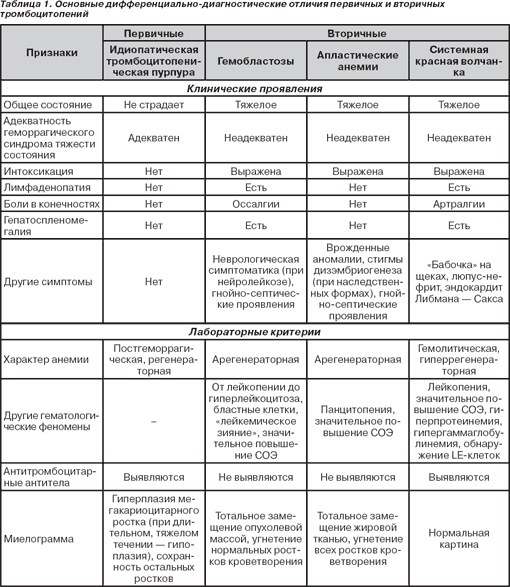
Во всех случаях подозрения на ИТП необходимо исключить вторичные (симптоматические) формы тромбоцитопений (табл. 1), а также тромбоцитопатии, геморрагический васкулит и т.д.
При геморрагическом васкулите (ГВ) кожный геморрагический синдром представлен петехиями, имеющими склонность к слиянию, располагающимися симметрично, имеющими излюбленную локализацию (разгибательные поверхности верхних и нижних конечностей, ягодицы). Помимо кожных проявлений, при ГВ довольно часто развивается поражение суставов (суставной синдром), желудочно-кишечного тракта (абдоминальный синдром), почек (почечный синдром). При этом страдает общее состояние ребенка: развиваются интоксикационный, болевой абдоминальный синдромы. Для ГВ характерны укорочение времени свертывания по Ли — Уайту, свидетельствующее о гиперкоагуляции, при нормальной длительности кровотечения, лейкоцитоз со сдвигом формулы влево, умеренное повышение СОЭ, диспротеинемия со значительной гипопротеинемией, гипоальбуминемией, увеличением α1-, β2-, β-глобулинов, повышение уровня гликопротеидов, положительный СРП, повышение уровня ЦИК.
Симптоматические тромбоцитопении развиваются при многих заболеваниях, в том числе при системной красной волчанке, гемобластозах, апластических анемиях, ДВС-синдроме, иммунодефицитных состояниях, хроническом гепатите, гемолитико-уремическом синдроме, инфекционных заболеваниях (сепсисе, ВИЧ- и ТОRCH-инфекциях, малярии и др.), перинатальной гипоксии и т.д. Клиническая картина при вторичных тромбоцитопениях обусловлена прежде всего течением основного заболевания. Практически при всех симптоматических тромбоцитопениях страдает общее состояние больного: выражен интоксикационный синдром, тяжесть состояния неадекватна геморрагическому синдрому, в патологический процесс вовлекаются внутренние органы и т.д. Так, при системной красной волчанке выявляются гепатоспленомегалия, лимфаденопатия, гиперкератоз, люпус-нефрит, эндокардит Либмана — Сакса, при лабораторном исследовании регистрируются лейкопения, значительное повышение СОЭ, гиперпротеинемия, гипергаммаглобулинемия, обнаруживаются LE-клетки. Апластические анемии помимо интоксикационного синдрома, геморрагических проявлений, присоединения гнойно-воспалительных процессов сопровождаются панцитопенией, резким повышением СОЭ. При наследственно обусловленных апластических анемиях регистрируются врожденные аномалии и/или стигмы дизэмбриогенеза. Течение лейкемии сопровождается гепатоспленомегалией, болями в костях (оссалгиями), лимфаденопатией, проявлениями нейролейкоза, наслоением гнойно-септических процессов, в периферической крови регистрируются лейкоцитоз за счет появления бластных клеток, «лейкемическое зияние», значительное повышение СОЭ.
Оценка состояния костного мозга — весьма важный этап в исключении вторичности тромбоцитопении и выборе тактики ее лечения. Так, при первичной тромбоцитопении регистрируется гиперплазия мегакариоцитарного ростка на фоне сохранных других ростков кроветворения. Однако при длительно текущем процессе, особенно аутоиммунной форме заболевания, может развиться истощение мегакариоцитарного ростка. В то же время при апластических анемиях выявляется гипоплазия (аплазия) костного мозга за счет вытеснения нормальных ростков кроветворения жировой тканью. В миелограмме при лейкемии регистрируется увеличение числа бластных клеток более 30 %, угнетение эритроидного и мегакариоцитарного ростков кроветворения с последующим вытеснением их опухолевой массой.
Имеются различия и в характере анемии при вторичных тромбоцитопениях. Ее возникновение при системной красной волчанке и гемолитико-уремическом синдроме обусловлено гемолизом, при гемобластозах и апластических анемиях — гипоплазией эритроидного ростка, при идиопатической тромбоцитопенической пурпуре — исключительно кровопотерей.
Тромбоцитопения как симптом может наблюдаться при инфекционных и гнойно-воспалительных заболеваниях, особенно у новорожденных и детей раннего возраста. Примечательно, что около 37 % новорожденных, заболевших в пери- либо неонатальном периоде, имеют лабораторно подтвержденную тромбоцитопению и у половины из них она сопровождается геморрагическим синдромом. Причем на долю тромбоцитопений, развивающихся на фоне инфекционно-воспалительных заболеваний, приходится около 65 % всех тромбоцитопений неонатального периода. Однако следует помнить, что на первый план, как и при всех вторичных тромбоцитопениях, выступают симптомы основного заболевания.
При проведении дифференциальной диагностики следует помнить, что развитие тромбоцитопении может быть вызвано не только воздействием внешних факторов, но и генетической детерминированностью.
Синдром Бернара — Сулье (синдром гигантских тромбоцитов) — врожденная тромбоцитопатия, сопровождающаяся кровоизлияниями в кожу, слизистые оболочки, внутренние органы, развитием носовых кровотечений. Помимо тромбоцитопении характерно наличие гигантских (напоминающих лимфоциты) тромбоцитов, увеличение времени свертывания. В тромбоцитах отсутствует гликопротеин, отвечающий за взаимодействие между фактором Виллебранда и мембраной тромбоцита, что приводит к нарушению адгезии кровяных пластинок к коллагену.
При уменьшении числа тромбоцитов у мальчиков в первые дни и месяцы жизни следует исключить возможность генетически обусловленной тромбоцитопении (синдром Вискотта — Олдрича), наследуемой по рецессивному типу, сцепленному с Х-хромосомой. Заболевание проявляется в виде экзематозных высыпаний на коже, повышенной кровоточивости, кровоизлияний во внутренние органы, повторных гнойных инфекций (чаще в виде гнойных отитов по причине иммунодефицита), спленомегалии. При синдроме Вискотта — Олдрича отмечается врожденный дефект тромбоцитов, что предопределяет их повышенную разрушаемость. В крови больных обнаруживается много мелких кровяных пластинок. Диагностическое значение имеет низкий уровень IgM, повышение уровня IgА и gЕ, нормальное или повышенное содержание IgG, нарушение агрегации тромбоцитов, лимфопения.
Синдром серых тромбоцитов (недостаточность α-гранул) характеризуется увеличением размеров тромбоцитов, их серой окраской, снижением количества a -гранул и тромбоцитспецифических белков этих же гранул. При тромбастении Гланцмана нарушена агрегационная функция тромбоцитов. Синдром семьи Фехтнер сопровождается макротромбоцитопенией, включениями в лейкоцитах, нефритом, глухотой. Для синдрома Чедиака — Хигаши характерно сочетание тромбоцитопении с дефектами пигментации волос, кожи, сетчатки глаза. У больных с ТАР-синдромом отсутствует радиальная кость, выявляется также тромбоцитопатия.
Для синдрома Мая — Хегглина характерна макротромбоцитопения, наличие крупных базофильных включений в нейтрофилах и эозинофилах (тельца Деле). При синдроме Эпстайна выявляется макротромбоцитопения в сочетании с синдромом Альпорта.
При синдроме Мошковица (тромботической тромбоцитопенической пурпуре) отмечается острое начало, геморрагический синдром вследствие тромбоцитопении потребления, лихорадка с ознобом, микроангиопатическая гемолитическая анемия, нарушение функции почек, ЦНС, ССС. Характерна неврологическая симптоматика: нарушения сознания, расстройства чувствительности, двигательные нарушения вплоть до судорог, комы. Механизм развития тромботической тромбоцитопенической пурпуры связан с наличием субстанций, влияющих на функцию эндотелия. Последний освобождает значительное количество мультимерных форм фактора Виллебранда, который разрушается до фрагментов, способных вызывать агрегацию тромбоцитов. Это приводит к образованию множественных тромбов в мелких артериолах и капиллярном русле. Причем тромбы практически полностью состоят из тромбоцитов, количество фибрина в них незначительное. Именно тромботические проявления обусловливают клинические проявления заболевания.
Однако, проводя дифференциальную диагностику, следует помнить, что подавляющую часть всех тромбоцитопений все-таки составляют приобретенные формы.
Диагноз ИТП — это диагноз исключения. Для его постановки необходимо отвергнуть все заболевания, сопровождающиеся развитием вторичной, симптоматической тромбоцитопении.
Таким образом, профессиональный подход к оценке клинической ситуации, трактовке данных дополнительных методов исследования, верификация диагноза с последующим выбором адекватной лечебной тактики являются залогом успешной борьбы не только с геморрагическим синдромом, но и с заболеванием, приведшим к его возникновению. Подходы к терапии и принципы оказания помощи больным с ИТП будут рассмотрены в следующей лекции.
Лечение:
В терапии идиопатической тромбоцитопенической пурпуры (ИТП) или болезни Верльгофа, как и других тромбоцитопений, необходимо соблюдение ряда принципов:
— госпитализация всех больных с геморрагическим синдромом независимо от степени его выраженности или количества тромбоцитов;
— выбор адекватного метода транспортировки больного в ЛПУ (санитарный транспорт, горизонтальное положение), так как при количестве тромбоцитов менее 30 х 109/л (критический уровень) могут развиться спонтанные кровоизлияния и угрожающие жизни кровотечения;
— соблюдение строгого постельного режима до стойкого купирования геморрагического синдрома, в дальнейшем режим предусматривает ограничение травмирующих игр и занятий;
— верификация диагноза;
— строго дифференцированный, индивидуальный подход;
— этиотропная терапия при выявлении этиологически значимого агента.
Терапия идиопатической тромбоцитопенической пурпуры предусматривает 3 этапа:
— консервативный;
— оперативный;
— применение цитостатиков (терапия отчаяния).
ПЕРВЫЙ ЭТАП (КОНСЕРВАТИВНЫЙ)
Одной из основных задач терапии ИТП является купирование геморрагического синдрома (в том числе и его последствий), довольно часто представляющего угрозу для жизни больного. Купирование геморрагического синдрома, развивающегося при ИТП, проводится в соответствии с теми же принципами, что и при тромбоцитопениях другого генеза. Это достигается с помощью применения гемостатических препаратов:
— ангиопротекторов: 12,5% раствор дицинона (этамзилата натрия) по 1,0–2,0 мл 2–4 раза в/в, в/м либо по 0,5 г 4–6 раз в сутки внутрь; 0,025% раствор адроксона 1,0–2,0 мл 1–2 раза в/м или п/к. Гемостатический эффект этих препаратов связан с уменьшением проницаемости мелких сосудов и капилляров, усилением тромбоцитарно-сосудистой реакции, остановкой кровотечения из мелких и мельчайших сосудов;
— ингибиторов фибринолиза: 5% раствор эпсилон-аминокапроновой кислоты (АКК) в дозе 100–200 мг/кг в/в капельно (у новорожденных 0,05 г/кг в сутки в/в капельно 1 раз в сутки), при остановке кровотечения переход на пероральный прием по 0,1–0,2 г/кг/сут. за 3–4–8 приемов; парааминобензойной кислоты (памба) по 50–100 мг в/в или в тех же дозах внутрь 2–3 раза в сутки. Фармакодинамика ингибиторов фибринолиза заключается в подавлении плазминогена, плазмина, активации фактора XII, кининовой системы. Ингибиторы фибринолиза способствуют стабилизации фибрина и его отложению в сосудистом русле, опосредованно индуцируют агрегацию и адгезию тромбоцитов и эритроцитов. Эти же препараты можно применять местно для остановки наружных кровотечений. Помимо них с этой же целью используют гемостатическую губку, тромбин, фибриноген, криотерапию и т.д.;
— метаболических препаратов: лития карбонат по 0,025–0,3 г внутрь 3 раза в день (7 дней), рибоксин по 0,05–0,2 г 2–3 раза в день (2–3 недели), АТФ со жженой магнезией.
В зависимости от локализации кровотечения лечебная тактика имеет свои особенности:
— при носовом кровотечении в носовые ходы закапывают по 3–5 капель в каждую ноздрю каждые 3–5 мин раствор тромбина и адроксона в эпсилон-аминокапроновой кислоте (20 мг тромбина растворяют в 50 мл 5% раствора АКК и добавляют 2 мл 0,025% раствора адроксона). Можно чередовать закапывание предыдущего раствора с закапыванием сосудосуживающих препаратов (1% эфедрина, разведение адреналина 1 : 10 000). Допускается чередование тампонов с указанной ранее гемостатической смесью в передний носовой ход с тампонами с 1–5% раствором феракрила, гемостатической губкой, фибриновой пленкой. Следует помнить, что передняя тампонада носовых ходов должна быть рыхлой, а задняя противопоказана. Тампоны ставятся в носовые ходы не более чем на 24 часа, при невозможности их замены необходимо назначение антибиотиков с профилактической целью;
— при желудочно-кишечном кровотечении рекомендуется применение охлажденной механически и химически щадящей пищи (стол № 5а), назначается внутрь 50 мл охлажденного 5% раствора эпсилон-аминокапроновой кислоты с добавлением 1 мл 0,025% раствора адроксона и тромбина: по 1 чайной либо столовой ложке 4–6 раз в сутки;
— при маточном кровотечении назначаются средства, усиливающие сократительную способность матки: прегнин по 0,01 г 2 раза в сутки под язык; при нарушении гормонального фона — эстрогены: 0,05% раствор фолликулина по 1,0 мл 1 раз в день в/м или 1% раствор прогестерона по 1,0 мл 1 раз в день в/м.
Следует помнить, что переливание тромбоконцентрата при иммунных тромбоцитопениях противопоказано, так как его использование может усугубить разрушение кровяных пластинок за счет избыточного образования антител. При ИТП к переливанию тромбоцитарной массы прибегают только лишь при жизнеугрожающих кровотечениях.
Этиотропная терапия применяется при выявлении лабораторных маркеров того или иного возбудителя. Внедрение современных иммунологических методов дает возможность выявить этиологически значимых в развитии ИТП возбудителей, и прежде всего цитомегаловирус. В связи с этим целесообразно применение специфических противовирусных препаратов, таких как цимевен, цитотект и др. Включение этих медикаментозных средств в комплекс лечения больных позволяет прервать течение довольно упорных форм этого заболевания.
Патогенетическая терапия направлена на ликвидацию иммунного процесса, что достигается как путем применения традиционных подходов (гормональная терапия), так и использованием современных методов.
В последние годы произведен пересмотр доз глюкокортикоидов при ИТП. Как показал опыт, длительное лечение заболевания в дозе 1 мг/кг/сут. способствует хронизации процесса и ведет к торможению тромбоцитопоэза в костном мозге. Глюкокортикоиды, как малые иммунодепрессанты, назначаются в стартовой дозе 2,0 мг/кг массы тела в сутки внутрь в пересчете на преднизолон, которому и отдается предпочтение. Однако в тяжелых случаях эта доза может оказаться недостаточной, поэтому с целью повышения эффективности лечения в настоящее время отмечается тенденция к увеличению доз преднизолона. Дозы в этих случаях повышают до 4–8 мг/кг/сут. внутрь в течение недели с последующим их снижением. Эффект терапии обычно проявляется в первые дни лечения. Вначале исчезает геморрагический синдром, затем начинается увеличение числа тромбоцитов. Первые порции тромбоцитов почти целиком уходят на «подкормку» эндотелия. Гормональную терапию даже при относительно быстром эффекте рекомендуется проводить в исходной дозе в течение 3–4 недель с последующим постепенным снижением (каждые 5–7 дней по 5 мг) до полной отмены. Однако отмена глюкокортикоидов у части больных приводит к снижению числа кровяных пластинок.
Существуют и другие схемы лечения глюкокортикоидами. При отсутствии эффекта от лечения преднизолоном применяют дексаметазон (0,6 мг/кг/сут. в течение 4 дней каждые 28 дней) прерывистыми курсами (можно провести до 6 таких курсов) с исследованием тромбоцитов на 5, 18, 28-й день от начала лечения.
Длительность лечения кортикостероидами не должна превышать 1 мес. Многомесячное применение глюкокортикоидов неэффективно и приводит к осложнениям: гипокалиемии, артериальной гипертензии, образованию стероидных язв, повышению уровня сахара в крови (риск развития стероидного диабета), гнойно-септическим осложнениям, остеопорозу, формированию «кушингоида», синдрома отмены и др.
Современные направления лечения ИТП на первом этапе сводятся к внутривенному введению иммуноглобулина (ВВИГ), назначению антирезус-D-сыворотки (анти-D-иммуноглобулина), применению интерферон-альфа-2.
ВВИГ — препарат нормального полиспецифического IgG, полученного из пула сывороток нескольких тысяч доноров, с таким же распределением по субклассам, как и в нормальной сыворотке, и периодом полувыведения около 3 недель. Механизм действия ВВИГ основан на подавлении активности антитромбоцитарных антител. Положительный эффект иммуноглобулинов обусловлен блокадой Fc-рецепторов макрофагов, что уменьшает опсонизацию тромбоцитов и предотвращает их разрушение в кровеносном русле. Он также модулирует иммунный ответ путем усиления функции Т-клеток-супрессоров. ВВИГ назначается по схеме 0,4 г/кг в течение 5 дней ежедневно либо 1 г/кг в течение 2 дней.
Важным преимуществом ВВИГ в сравнении с глюкокортикоидами является его эффективность при использовании в ургентных ситуациях, развивающихся при ИТП. Применение ВВИГ позволяет быстро повысить уровень тромбоцитов в крови и тем самым снять угрозу такого опасного осложнения, как внутричерепное кровоизлияние, а также срочно подготовить больного к спленэктомии, остающейся одним из наиболее мощных средств лечения ИТП. Эффект при применении ВВИГ достигается значительно быстрее (через 24–48 часов), чем при использовании глюкокортикоидов. У подавляющего большинства больных, получающих ВВИГ, начиная со 2-го дня, количество тромбоцитов повышается, достигая максимума на 4–11-й день, одновременно прекращается геморрагический синдром. Однако эффект этот кратковременный и длится лишь 3–4 недели. После завершения инфузий ВВИГ число тромбоцитов обычно постепенно снижается, но некоторое время держится на гемостатическом уровне. Тот же результат наблюдается при повторных инфузиях. Возможны повторные курсы введения иммуноглобулина, их сочетание с преднизолоном.
В целом применение иммуноглобулина приводит к повышению количества тромбоцитов у 75 % пациентов, более чем у половины из них число кровяных пластинок достигает нормальных цифр. Стойкая клинико-гематологическая ремиссия после 1-го курса лечения отмечается у 25–30 % больных.
Аутоиммунная форма ИТП, особенно при тяжелом ее течении, часто является показанием к применению высоких доз ВВИГ. Основной целью при этом является подавление активности антитромбоцитарных антител, снижение уровня тромбоцитассоциированного IgG, ингибирование макрофагальной деятельности клеток ретикулоэндотелиальной системы (РЭС). Все это имеет особое значение при рефрактерности ИТП к терапии кортикостероидами.
Внутривенное введение больших доз иммуноглобулина при лечении больных аутоиммунной формой ИТП успешно применяется в процессе подготовки к различным плановым операциям, в частности перед спленэктомией. В этих случаях назначают по 0,6 г/кг ежедневно в течение 3 дней, что приводит к росту числа тромбоцитов, после чего выполняется операция. Такая подготовка резко снижает риск проведения спленэктомии. Серьезных побочных явлений или осложнений даже при таких дозах, как правило, не наблюдается. Однако следует помнить о возможности развития побочных эффектов, вызываемых иммуноглобулином: головной боли, тошноте, повышении температуры тела, аллергических реакциях.
Несмотря на высокую эффективность рассматриваемого метода лечения, препятствием к более широкому его применению является высокая стоимость препарата. Лекарственные формы иммуноглобулина для внутривенного введения, выпускаемые в разных странах и разными фирмами, принципиально однотипны по своему действию, но имеют различные названия: Gamma-Venin (Германия), Sandoglobulin (Швейцария), Veinoglobuline (Франция), Gammonativ (Швеция), Polyglobin (США), Пентаглобин (Россия).
Из блокаторов клеток РЭС наряду с ВВИГ, применение которого предпочтительнее в угрожающих жизни ситуациях, в лечении больных с ИТП применяется анти-D-иммуноглобулин, использующийся в акушерской практике для профилактики гемолитической болезни новорожденных. Анти-D-иммуноглобулин представляет собой стерильную лиофильно высушенную фракцию IgG, содержащую антитела к Rh (D).
Терапия анти-D-иммуноглобулином — новый метод лечения тромбоцитопений, базирующийся на конкуренции кровяных пластинок с эритроцитами. Известно, что как эритроциты, так и тромбоциты секвестрируются в системе фагоцитирующих макрофагов. Под действием анти-D-иммуноглобулина эритроциты больного активируются и интенсивно разрушаются. Секвестрация же тромбоцитов не происходит, так как макрофаги перегружены активированными эритроцитами. Это приводит к невостребованности кровяных пластинок. Последние остаются циркулировать в крови, что удлиняет продолжительность их жизни и приводит соответственно к увеличению численности тромбоцитов, так как костный мозг находится в состоянии гиперплазии. Сведения об эффективности этого метода противоречивы. В наблюдениях, где отмечался неполный и кратковременный эффект, применялись малые дозы препарата (10 мкг/кг). Оптимальной же признана курсовая доза 50 мкг/кг, причем допускается как однократное в/в введение всей дозы, так и дробное (в/в или в/м) в течение 2–5 дней. Терапия анти-D-иммуноглобулином позволяет достичь полного гематологического ответа у 72 % детей с аутоиммунной формой ИТП. Считается, что повторные введения препарата не менее эффективны, чем первое. Основным побочным эффектом применения анти-D-иммуноглобулина является транзиторная гемолитическая анемия.
В последние годы в терапии больных со стероидорезистентной ИТП успешное применение находит иммунокорригирующая терапия препаратами интерферона. Как известно, при ИТП, помимо активации клеточного звена иммунитета и усиления процессов антителобразования, развивается дефицит продукции как α-, так и γ- интерферона. С этой целью используется интерферон-альфа-2, являющийся активным физиологическим регулятором, в дозе 1 500 000–3 000 000 МЕ 3 раза в неделю п/к или в/м в течение 4 и более недель в зависимости от получаемого эффекта. И хотя механизм действия препарата при ИТП остается пока неясным, очевиден его ингибирующий эффект на продукцию иммуноглобулинов В-клетками за счет уничтожения излишков популяции клональных лимфоцитов, вовлеченных в выработку аутоантител.
Оценка эффективности первого этапа терапии проводится через 3–6 месяцев после назначения лечения. В тех случаях, когда эффект неполный или нестабильный (а он отсутствует в 10–15 % случаев), возникает необходимость решения вопроса о показанности 2-го (оперативного) этапа лечения.
ВТОРОЙ ЭТАП (ОПЕРАТИВНЫЙ)
Второй этап терапии ИТП предусматривает проведение спленэктомии. Удаление селезенки — паллиативный метод, обеспечивающий продление жизни тромбоцитов за счет устранения органа, являющегося местом их разрушения, а также выработки антитромбоцитарных антител. Показаниями к спленэктомии являются:
— неэффективность терапии на протяжении 3–6 месяцев: некупируемый геморрагический синдром или его возобновление на фоне снижения дозы глюкокортикоидов;
— количество тромбоцитов 10 х 109/л без геморрагического синдрома;
— отсутствие тенденции к росту при активном лечении на протяжении 3 месяцев при количестве кровяных пластинок менее 30 х 109/л.
При развитии кровоизлияния в мозг операция проводится экстренно, в первые же часы.
Проведение спленэктомии у 75 % пациентов приводит к практическому выздоровлению. Интересно, что геморрагический синдром исчезает после операции даже при низком уровне кровяных пластинок более чем у половины больных. Количество тромбоцитов периферической крови у большинства прооперированных больных повышается уже через 4–6 часов после операции, достигая максимума на 2–6-е сутки. В последующем происходит некоторое их снижение, что не является основанием для назначения гормональной терапии, так как на протяжении нескольких недель или месяцев происходит нормализация их уровня на фоне применения препаратов, улучшающих функциональное состояние тромбоцитов. У части пациентов наблюдается отсроченный эффект — медленное повышение уровня тромбоцитов в последующие 5–6 месяцев после операции.
Одной из причин неэффективности спленэктомии может быть наличие не удаленных во время операции добавочных селезенок, частота выявления которых варьирует от 10 до 25 %. Потенциальными факторами риска спленэктомии являются технические сложности во время операции у больных с ИТП, как правило, длительно получавших гормональную терапию, развитие кровотечений во время операций и в послеоперационном периоде, а также инфекционно-септические осложнения. Спленэктомию производят, как правило, на фоне глюкокортикоидной терапии. Обычно дозу глюкокортикоидов повышают за 4–5 дней до операции, затем за 2 дня до операции дозу удваивают.
Однако следует помнить, что удаление селезенки отрицательно воздействует на иммунологическую реактивность организма ребенка. Селезенка является единственным источником тафтсина (одной из фракций гамма-глобулинов), который влияет на фагоцитарную активность нейтрофилов и регулирует деятельность Т- и В-лимфоцитов. Дефицит тафтсина приводит к снижению фагоцитарной активности лейкоцитов и депрессии РЭС.
Дети, перенесшие спленэктомию, становятся восприимчивыми к воздействию инфекционных возбудителей, прежде всего менингококков и пневмококков. Особенно опасны пневмококковые инфекции в первые полгода после спленэктомии, поэтому этой категории больных целесообразно проводить бициллинопрофилактику (бициллин-5 по 1 200 000–1 500 000 ЕД ежемесячно).
Многими гематологами при отсутствии тяжелого геморрагического синдрома рекомендуется выжидательная тактика, поскольку довольно часто в течение года у многих больных возникает спонтанная ремиссия.
В настоящее время альтернативой спленэктомии является проведение рентгеноэндоваскулярной окклюзии селезенки. В качестве эмболизирующего материала используются силиконовые сферы или цилиндры. При этом проводится поэтапное «выключение» 90–95 % паренхимы органа. Рентгеноэндоваскулярная окклюзия селезенки не уступает спленэктомии по эффективности и имеет минимальное количество осложнений, особенно у больных с тяжелой ИТП. Этот эффективный метод лечения детей с хронической ИТП позволяет достичь длительной клинико-гематологической ремиссии в 45 % случаев. Использование данного метода в педиатрической практике особенно актуально в связи с его малой травматичностью и относительной безопасностью развития инфекционных осложнений. Кроме того, после эмболизации за счет коллатералей продолжает функционировать 2–5 % селезеночной ткани, выполняющей свою иммунологическую функцию, что крайне важно для организма ребенка.
ТРЕТИЙ ЭТАП (ПРИМЕНЕНИЕ ЦИТОСТАТИКОВ)
Третий этап назван терапией отчаяния. Это обусловлено не только общеизвестными осложнениями при применении цитостатиков, но и их способностью повреждать половые железы, вызывать хромосомные перестройки, снижать противоопухолевый иммунитет. Поэтому назначают эти препараты больным ИТП только при неэффективности спленэктомии. К счастью, в проведении этого этапа нуждаются лишь отдельные пациенты.
Цитостатики (винкристин, винбластин, азатиоприн, циклофосфан, имуран и т.д.) применяются в комбинации с глюкокортикоидами на протяжении 2–3–5 месяцев. Предпочтение отдается винкристину 1,5 мг/м2 (в/в струйно 1 раз в неделю, курс лечения 3–6 недель), винбластину (разовая доза в 2 раза выше), азатиоприну (2–3 мг/кг, курс 3–5 мес), циклофосфану (200–400 мг в сутки, парентеральное введение, на курс 6–8 г). Эффект, как правило, наступает через 1,5–2 месяца, после чего кортикостероиды постепенно отменяют.
Довольно перспективным методом лечения ИТП является введение больному тромбоцитов, нагруженных винкристином. При этом введенные кровяные пластинки активно поглощаются макрофагами — клетками, непосредственно отвечающими за разрушение тромбоцитов, что приводит к невостребованности собственных тромбоцитов больного, а следовательно, продлению их жизни.
Диспансеризация больных с ИТП подразумевает:
Частота осмотров педиатром и гематологом на первом году болезни 1 раз в месяц, далее 1 раз в 3 мес до 2 лет, далее 1 раз в 6 мес.
Перед диспансерным осмотром проводят обследования анализ крови с подсчетом тромбоцитов, время кровотечения в первые 3 мес каждые 2 нед, далее 9 мес 1 раз в месяц, в дальнейшем 1 раз в 2-3 мес, по показаниям чаще, другие исследования по показаниям освобождение от занятий физкультурой на 1 мес после выздоровления, далее постоянно подготовительная группа.
Диспансеризация при остром течении 3 года, при хроническом — до 18 лет.
Инвалидность при хронической тромбоцитопенической пурпуре при непрерывно рецидивирующем течении с тяжелыми геморрагическими кризами (с числом громбоцитов в крови 50x109/л) сроком до достижения 18 лет.
— санацию хронических очагов инфекции;
— ограничение физических нагрузок, в том числе освобождение от занятий физкультурой. При стойкой ИТП, гормональной терапии школьникам показана учеба на дому;
— освобождение от профилактических прививок в течение 1 года после выздоровления, в дальнейшем вопрос решается индивидуально (в зависимости от эпидемиологических показаний, разрешения иммунолога при нормальном количестве тромбоцитов, проведения до и после прививки 5-дневного курса десенсибилизирующей терапии);
— ограничение инсоляции, физиотерапевтических и тепловых процедур;
— при необходимости оперативного лечения — предварительную подготовку с применением гемостатических препаратов;
— проведение 2-месячных курсов гемостатической терапии 2–3 раза в год с включением фитопрепаратов: крапивы, кукурузных рылец, зверобоя, водяного перца, пастушьей сумки, лесной земляники, тысячелистника, шиповника и т.д.
Таким образом, проблема лечения ИТП в детском возрасте представляет определенные трудности, что требует вдумчивого отношения врача, адекватности проводимых мероприятий в каждом конкретном случае и предопределяет успех терапии, а значит, не только прогноз для жизни больного, но и для ее качества в последующем.
Список литературы
1. Баркаган З.С. Геморрагические заболевания и синдромы. — М.: Медицина, 1988. — 528 с.
2. Ващенко Т.Ф., Долгина Е.Н., Кисляк Н.С. и др. Значение иммунокорригирующей терапии препаратами интерферона в лечении идиопатической тромбоцитопенической пурпуры у детей // Гематология и трансфузиология. — 1999. — № 1. — С. 9-14.
3. Гайдукова С.Н., Выдыборец С.В. Идиопатическая тромбоцитопеническая пурпура // Мистецтво лікування. — 2004. — № 10 (016). — С. 26-30.
4. Донюш Е.К., Быкова Л.П., Хаспекова С.Г., Никаноров А.Ю., Бабаев Э.С. Использование эндоваскулярной окклюзии селезенки в лечении детей с хронической аутоиммунной тромбоцитопенической пурпурой, резистентных к консервативной терапии // Гематология и трансфузиология. — 2001. — Т. 46, № 4. — С. 39-41.
5. Кузьмина Л.А. Гематология детского возраста. — М.: МЕДпресс-информ, 2001. — С. 365-381.
6. Мазурин А.В., Петров В.Ю., Плахута Т.Г., Якунина Л.Н., Сосков Г.И. Гематурия как проявление геморрагических болезней у детей // Гематология и трансфузиология. — 2001. — Т. 46, № 1. — С. 29-31.
7. Макаров А.П., Белозерская Г.Г., Петрухина Г.Н., Самойлов А.В. Гемостатические средства резорбтивного действия // Гематология и трансфузиология. — 1992. — № 1. — С. 34-36.
8. Нарушение гемостаза у детей: Библиотека практ. врача. — М.: Медицина, 1993. — С. 165-171.
9. Неотложные состояния у детей / Петрушина А.Д., Мальченко Л.А., Кретинина Л.Н. и др. — М.: Мед. книга: Изд. центр «Академия»: Изд-во НГМА, 2002. — 176 с.
10. Романова А.Ф. Гипопластическая и апластическая анемия. — К.: Здоров’я, 1982. — 52 с.
11. Руководство по гематологии / Под ред. А.И. Воробьева. — М.: Медицина, 1985. — 816 с.
12. Сибгатуллина Ф.И., Агафонова Е.В., Кринкина Р.А. и др. Синдром Вискота — Олдрича // Педиатрия. — 1998. — № 2. — С. 103-106.
13. Справочник по гематологии / Под ред. А. Романовой. — Ростов-на-Дону: Феникс, 2000. — С. 270-341.
14. Третьякова О. Алгоритм диагностики и лечения тромбоцитопений у детей и подростков // Ліки України. — 2004. — № 11 (88). — С. 44-48.
15. Третьякова О.С. Тромбоцитопения в практике педиатра: современные подходы к диагностике и лечению // Мистецтво лікування. — 2006. — № 1 (027). — С. 82-85.
16. Шабалов Н.П. Тромбоцитопатии // Гематология детского возраста / Под ред. Н.А. Алексеева. — СПб.: Гиппократ, 1998. — С. 322-345.
17. Шабалов Н.П. Тромбоцитопении // Гематология детского возраста / Под ред. Н.А. Алексеева. — СПб.: Гиппократ, 1998. — С. 317-322.
18. Шарыгин С.Л. Внутривенное введение иммуноглобулина при тромбоцитопениях у взрослых (по материалам зарубежной литературы) // Советская медицина. — 1991. — № 7. — С. 37-39.
19. Favier R. et al. A novel genetic thrombocytopenia (Paris-Trousseau) associated with platelet inclusions, dysmegakaryopoiesis and chromosome deletion at Щ23 // C. R. Acad. Sci. —1993. — 316. — 698-701.
20. Imbach P. Chronic immune thrombocytopenic purpura: diagnosos and treatment of children // Гематология и трансфузиология. — 1998. — Т. 43, № 3. — С. 27.
21. Linch D., Hutton R., Cowan D. et al. Primary thrombocythaemia in childhood // Scand. J. Haematol. — 1983. — Vol. 9, № 2. — P. 55-56.
22. Schmalze F., Mufti G.I. edt. Myelodysplastic syndromes. — NY; Berlin: Springer-Venag, 1992. — 336 p.
23. Willoughby M. Детская гематология: Пер. с англ. — М.: Медицина, 1981. — 672 с.














 (zip - application/zip)
(zip - application/zip)










