Державний вищий навчальний заклад
«Прикарпатський національний університет імені Василя Стефаника»
Інститут природничих наук
Кафедра біохімії та біотехнології
КУРСОВА РОБОТА
з біології
на тему: АНТИОКСИДАНТНИЙ ПОТЕНЦІАЛ В РІЗНИХ ШТАМАХ ДРІЖДЖІВ
SACCHAROMYCES CEREVISIAE
Студентки ІІІ курсу, групи Б-31
напряму 6.040102 «Біологія»
Фучко І.Т.
Керівник: доц., д.б.н. Семчишин Г.М.
 Національна
шкала:
Національна
шкала:
 Університетська
шкала:
Університетська
шкала:
 Оцінка ECTS:
Оцінка ECTS:

 Члени комісії:
Члени комісії:
(підпис) (прізвище та ініціали)
 |
 |
(підпис) (прізвище та ініціали)
 |
 |
(підпис) (прізвище та ініціали)
м. Івано-Франківськ – 2016 рік
ЗМІСТ
с.
СПИСОК
СКОРОЧЕНЬ.......................................................................
..................
3
ВСТУП...........................................................................
..........................................4
1. ОГЛЯД ЛІТЕРАТУРИ................................................................. ..................... 6
1.1. Дріжджі Saccharomyces cerevisiae та їх використання......................... 6
1.2. Морфологічні та біохімічні особливості клітин дріжджів
Saccharomyces
cerevisiae................................................................................
........
8
1.3 Активовані форми кисню........................................................................
10
1.4Антиоксидативний потенціал.................................................................. 12
2. МАТЕРІАЛИ І МЕТОДИ ДОСЛІДЖЕННЯ.................................................. 13
2.1.
Об’єкт дослідження і реактиви ............. ..............................................
13 2.2. Умови культивування дріжджів............................................................
13 2.3 Умови отримання безклітинних екстрактів...........................................13
2.4
Оцінка загальної антиоксидантної
здатності........................................ 14 2.5Визначення
концентрації білка і статистична обробка результатів...
14
3. РЕЗУЛЬТАТИ ДОСЛІДЖЕННЯ ТА ЇХ ОБГОВОРЕННЯ........................... 15
ВИСНОВКИ........................................................................
..................................
22
СПИСОК
ЛІТЕРАТУРИ......................................................................
................
23
СПИСОК СКОРОЧЕНЬ
АФК - активні форми кисню
ДНК - дезоксирибонуклеїнова кислота
ВРО - вільнорадикальне окиснення
ВРР - вільнорадикальні реакції
СОД - супероксиддисмутаза
ВСТУП
Усі живі організми, у тому числі і дріжджі в природних умовах можуть піддаватися впливу різних зовнішніх факторів, потраплячи таким чином в стресові ситуації. Неочікувані зміни в середовищі існування, можуть спричиняти зміни в структурах біомолекул та їх клітинних функцій. В таких випадках клітини змушені швидко реагувати, адаптовуючи власні внутрішньоклітинні системи, щоб не загинути. Серед таких стресових умов, існує такий як оксидативний стрес , що призводить до збільшення АФК.
Окислювально-відновлювальний стан клітини підтримується спеціалізованими ферментами в результаті постійного притоку енергії. Порушення цього стану викликає підвищення активних форм кисню, таких як пероксиди і вільні радикали. Білки, ліпіди і ДНК окислюються в результаті дії АФК, що призводить до мутацій і нездатності виконувати свої функції в подальшому. У людей окислювальний стрес призводить до таких захворювань, як атеросклероз і хвороба Альцгеймера, і також відповідає за прискорене старіння. Проте, організм може використовувати окислювальний стрес як захисний механізм. Імунна система людини використовує окислювальний стрес для боротьби з патогенами , а деякі АФК можуть служити медіаторами в клітинних сигнальних шляхах.(3)
Надлишок АФК може спричинити модифікацію біологічно важливих молекул, тому генерація АФК у клітині врівноважується знешкодженням і рівень цих оксидантів є відносно низьким ( 10-10 – 10-6 М). Каталаза разом з іншими антиоксидантними ферментами бере участь у деградації АФК.
Дріжджі Saccharomyces cerevisiae містять дві форми каталази – каталазу А та каталазу Т, які кодуються відповідними генами СТА1 і СТТ1. Каталаза А локалізується в пероксисомах і її основна функція – детоксикація Н2О2 , який утворюється при β-окисленні жирних кислот. Фізіологічна роль цитозольної каталази Т менше вивчена. Проте відомо, що зростання активності ферменту за дії оксидативного, осмотичного стресу та у разі голодування пов’язано, в першу чергу, з експресією гена СТТ1.(4)
Мета роботи – дослідити антиоксидантивну відповідь у різних штамах дріжджів Saccharomyces cerevisiae. Та зробити висновки про їх захист на дію АФК що утворюються при оксидативному стресі у дріжджів Saccharomyces cerevisiae штамів: УPH250 - дикий , та безкаталазні CTA1 та CTT1.
Розділ 1. ОГЛЯД ЛІТЕРАТУРИ
1.1. Дріжджі Saccharomyces cerevisiae та їх використання
Дріжджі Saccharomyces cerevisiae є поширеним, популярним та зручним об’єктом для досліджень. Добре вивченою і розшифрованою є послідовність нуклеотидів генетичного матеріалу, що складається з 12 млн. пар основ. Saccharomyces cerevisiae відносяться до класу Ascomycota (сумчасті гриби), підкласу Hemiascomycetidae (голосумчасті), порядку Endomycetales (ендоміцети), родини Saccharomycetaceae (сахароміцети).
Переважно клітини пекарських дріжджів мають розміри: 9-11 мкм - довжина; 6-8 мкм - ширина. Їхні форми бувають: округла, еліпсоїдна чи яйцеподібна. Та в загальному їх форма і розміри залежать від фізіологічного стану та умов культивування. Головна особливість пекарських дріжджів у тому, що за структурою вони подібні до клітин ссавців, а багато білків є гомологічними до людських. Це їх і робить хорошим модельним об"єктом для досліджень.[1]
Дріжджі є хемоорганогетеротрофами і використовують органічні сполуки як для отримання енергії, так і як джерело вуглецю. Їм необхідний кисень для дихання, проте за його відсутності багато видів здатні отримувати енергію за рахунок анаеробного дихання (бродіння) з виділенням спиртів, тобто вони є факультативними анаеробами. Основним джерелом вуглецю для пекарських дріжджів Saccharomyces cerevisiae, є глюкоза, яка забезпечує клітини енергією. Проте, фруктоза, теж може бути джерелом вуглецю та енергії. Таким чином, глюкоза та фруктоза – це взаємозамінні моносахариди, що використовуються як вуглецевмісні джерела в середовищі культивування дріжджів Saccharomyces cerevisiae. (2)
Життєвий цикл клітин Saccharomyces cerevisiae полягає у тому, що вони можуть жити і рости у двох формах, гаплоїдній і диплоїдній. Гаплоїдні клітини здатні тільки до вегетативного розмноження, при якому клітини дріжджів діляться в результаті мітозу на дві клітини різного розміру (брунькування), а за умовами стресу ці клітини зазвичай просто вмирають.
Диплоїдні клітини (звичайніша форма) також здатні до мітозу і брунькування, але за умовами стресу вони проходять процес споруляції, мейозу, і утворюють гаплоїдні спори, що проростають у гаплоїдні клітини.
Гаплоїдні клітини можуть мати один з двох типів спаровування, а і α. Клітини двох різних типів здатні до спаровування з утворенням диплоїдної клітини, що є примітивною формою статевого розмноження. Тип спаровування визначається єдиним генетичним локусом, MAT, який у свою чергу управляє статевою поведінкою як гаплоїдних, так і диплоїдних клітин. За допомогою генетичної рекомбінації, гаплоїдні клітини можуть перемикати тип спаровування на кожному клітинному циклі.
Використовуюють Saccharomyces cerevisiae для приготування печеного дріжджового хліба. Дріжджі зумовлюють спиртове бродіння з утворенням безлічі вторинних метаболітів. Проте спирт випаровується при випіканні. Крім того, в тісті формуються міхури вуглекислого газу, що надають хлібу губчасту структуру і м"якість.
Також Saccharomyces cerevisiae широко використовується в пивоварінні, та відомі як «дріжджі верхнього бродіння», через те, що вони спливають на поверхню ємності протягом бродіння. Пиво, при виготовленні якого використовувалися дріжджі верхнього бродіння, називається елем. Ці дріджді не в змозі споживати деякі цукри, в результаті чого пиво стає більш солодким та «фруктовим». (8)
1.2. Морфологічні та біохімічні особливості клітин дріжджів
Saccharomyces cerevisiae
У морфології дріжджів зазвичай використовують макро-і мікроморфологічних ознаки, тому що перший вивчають візуально культуральні ознаки, а другі - за допомогою мікроскопа.
Макроморфологічні ознаки характеризуються зростанням культури в рідких або на щільних середовищах. Ці ознаки дуже мінливі і сильно залежать від складу середовища і умов культивування, тому вони мають дуже обмежене значення в систематиці дріжджів.
При зростанні у рідких середовищах дріжджі викликають помутніння, утворюють осад. (Бабьева, Чернов, 2004).
Мікроморфологічні ознаки, характеризують окремі клітини (форма, розміри), а також способи вегетативного і безстатевого розмноження і утворені при цьому структури.
Найбільш відома властивість багатьох дріжджів - здатність до спиртного бродіння. Багато видів дріжджів можуть переключатися з бродильного метаболізму на дихальний і назад в залежності від умов: за наявності кисню бродіння інгібується і дріжджі починають дихати, у відсутності кисню включається механізм спиртового бродіння. Так як кисневе дихання – енергетично більш вигідний процес, ніж бродіння, то вихід біомаси дріжджів в розрахунку на одиницю використовуваного субстрату вище при вирощуванні їх в аеробних умовах, ніж в анаеробних. Це явище називається ефектом Пастера.
Спиртове бродіння може йти не тільки в анаеробних умовах. При високому вмісті глюкози в середовищі, і в присутності кисню, дріжджі зброджують глюкозу. Таким чином, глюкоза пригнічує процеси анаеробного дихання. Це явище отримало назву ефекту Кребтрі, або катаболітної репресії.
Сумарне рівняння спиртового бродіння:
С6Н12О6 + 2АДФ + 2Фн= 2С2Н5ОН + 2СО2 + 2АТФ + 2Н2О
. (Гонський Я.І.2002)
Saccharomysec cerevisiae інтенсивно зброджують різні субстрати, але в анаеробних умовах перемикаються на дихальний обмін.
При зростанні в аеробних умовах при низькому вмісті глюкози в середовищі, дріжджі одержують АТФ за рахунок процесів дихання. Повне окислення субстрату до вуглекислого газу і води може відбуватися у дріжджів за допомогою трьох різних механізмів: в циклі трикарбонових кислот, в гліоксилатному циклі і в пентозофосфатному циклі.(9)
1.3 Активовані форми кисню
В основі метаболічних процесів людини лежать окислювально-відновні реакції. У результаті окисно-відновних реакцій в організмі постійно проходить генерація активних форм кисню. Серед окисно-відновних реакцій особливу роль відіграють вільнорадикальні реакції (ВРР). До АФК належать вільні радикали, продукти неповного відновлення атомарного кисню, а також пероксид водню, синглетний кисень, озон, гіпохлорит, пероксинітрит.
Окисно-відновні реакції відіграють важливу роль у багатьох фізіологічних і біохімічних процесах: регуляції тонусу судин, клітинній проліферації, синтезі простагландинів, передачі сигналів від міжклітинних сигнальних молекул на регуляторні системи, які контролюють експресію генів, мікробоцидній дії фагоцитів.
Вільнорадикальне окиснення (ВРО), як процес, проявляється в клітковому метаболізмі як у нормі, так і при патології. ВРО є невід"ємною ланкою таких важливих біологічних процесів, як транспорт електронів у дихальному ланцюзі, синтез простагландинів і лейкотриєнів, проліферація і диференціація клітин, метаболізм і синтез катехоламінів, фагоцитоз, метаболізм деяких ксенобіотиків. Ішемічні зміни в органах і тканинах супроводжуються гіперактивацією вільнорадикальних процесів і порушенням функціонально-структурної цілісності біомембран. (6,7)
ВРР можуть бути як ферментативної, так і не ферментативної природи. До перших відносяться реакції дихального ланцюга, синтезу простагландинів, цитохрому, фагоцитозу, посилення метаболізму аденілових нуклеотидів тощо. До других — каталізуємі іонами міді і цинку процеси окиснення органічних сполук, реакції, індуковані різними токсичними факторами, випромінюючою іонізацією тощо. Найважливішою особливістю ВРР є їх ланцюговий характер і обов"язкова участь вільних радикалів у їх реалізації.(7)
Вільний радикал — це молекула або її частина, що має 1 або кілька неспарених електронів на молекулярній або зовнішній атомній орбіталі. Наявність такого електрону наділяє систему високою реакційною здатністю в хімічних перетвореннях і в звязку з цим можливістю ушкодження біологічно важливих молекул.
Отже, ініціальною ланкою ВРР при ушкодженні
клітини є, як правило, утворення в процесі оксигеназних реакцій так званих
активних форм кисню:
— синглетного (О•);
— супероксидного (О2•-);
— гідроксильного радикалу (ОН•);
— пероксиданіону (О22-);
— гіпогалогеніди (OCl-, OBr-,
OI-);
— нітритрадикал (NO);
— пероксинітритрадикал (ОNОО•).
1.4Антиоксидативний потенціал
Дріжджі S. cerevisiae здатні до адаптивних змін у відповідь на дію чинників, які викликають підвищення рівня АФК у їх клітинах (Байляк М. М. 2006), (Байляк М. М. 2007).Ці адаптивні зміни відбуваються за участі антиоксидантної системи.
Умовно розділяють всі системи захисту від дії АФК на три групи: 1) попередження утворення АФК; 2) інгібування розвитку вільнорадикального ланцюга і знешкодження радикалів антиоксидантними ферментами; 3) виправлення пошкоджень (репарація) (Лущак В. І. 2004).
Участь у захисті від АФК беруть ферментативні антиоксидантні системи, які прийнято поділяти на першу та другу лінії захисту. До першої лінії захисту відносять ферменти, які безпосередньо діють на АФК, а до другої лінії антиоксидантних ферментів відносять ті, які не діють на АФК. (Байляк М. М. 2006), (Брюханов А. Л. 2004).
До першої лінії захисту відносять супероксиддисмутазу (СОД), каталазу та деякі пероксидази.
Cупероксиддисмутаза відновлює супероксид-аніон до пероксиду водню і молекулярного кисню за наступною схемою (Байляк М. М. 2006) (Брюханов А. Л. 2004)
О2• + О2• + 2Н+ → Н2О2 + О2
Клітини дріжджів продукують дві форми СОД – цитозольну (Cu,Zn-вмісну) і мітохондріальну (Mn-вмісну), які кодуються відповідно генами SOD1 та SOD2.
Утворений в супероксиддисмутазній реакції, а також в інших метаболітичних процесах, пероксид водню є субстратом для каталази та цілої низки пероксидаз. Каталаза – один з основних ферментів, який здійснює детоксикацію Н2О2 у клітинах дріжджів, розкладаючи пероксид водню до води і молекулярного кисню (Байляк М. М. 2007), (Лущак В. І. 2004) :
2Н2О2 → 2Н2О + О2
Розділ 2. МАТЕРІАЛИ ТА МЕТОДИ ДОСЛІДЖЕННЯ
2.1. Об’єкт дослідження і реактиви
В дослідженні використовували лабораторні штами S. сerevisiae YPH250, ∆cta1 та ∆ctt1.
В роботі використовували наступні реактиви: дріжджовий екстракт, глюкоза, пептон, агар, фенілметилсульфонілфторид, склянні кульки (“Sigma Chemical Co”, USA). Решта реактивів – вітчизняного виробництва.
2.2. Умови культивування дріжджів
Дріжджі вирощували за умов аерації при 28 оС протягом 24 год у середовищі YPD, яке містило 2% пептону, 1% дріжджового екстракту та 2% глюкозу. Отримані культури з розрахунку 1×106 кл/мл переносили у середовище культивування такого ж складу. Культивування здійснювали на шейкері (175 коливань/хвалину) при 28 оС протягом ночі. Після досягнення стаціонарної фази росту, експериментальну культуру використовували для отримання клітинних екстрактів з подальшим визначенням біохімічних параметрів.
2.3. Умови отримання безклітинних екстрактів.
Після стресу клітини осаджували центрифугуванням при 2500 g протягом 5 хв і відмивали в середовищі, яке містило 50 мМ КФБ (рН 7,0). Після останнього відмивання клітин, до осаду додавали суміш буферу (50 мМ КФБ (рН 7.0), 0,5 Мм ЕДТА і 1 мМ фенілметилсульфонілфторид). Об’єм буферу становив 1200 мкл. Клітини дезінтегрували на вортекс-міксері зі скляними кульками діаметром 450-500 мкм. Руйнували клітини протягом 10 циклів, кожен з яких складався з 1 хв вібрації з кульками і 1 хв охолодження в льоді. Скляні кульки і незруйновані рештки клітин осаджували при 13000 g протягом 15 хвилин (4 оС). Отримані супернатанти використовували для визначення біохімічних параметрів.
2.4. Оцінка загальної антиоксидантної здатності.
Загальну антиоксидантну здатність визначали спектрофотометрично (Labsystems Multiskan Mcc/340) за швидкістю знешкодження антиоксидантами безклітинних екстрактів дріжджів катіон-радикалу ABTS•+, максимум оптичного поглинання якого знаходиться при довжині хвилі 414 нм (Erel O 2004). ABTS•+ радикал генерується внаслідок взаємодії 2,2’-азино-біс (3-етиленбензтіазолін-6-сульфонату) (ABTS) з H2O2 в ацетатному буфері (рН 3,6) при витримуванні протягом 1 год в темряві за кімнатної температури (до появи характерного темно-зеленого кольору ABTS•+). У присутності антиоксидантів забарвлений ABTS•+ відновлюється до вихідної безбарвної форми ABTS. Швидкість реакції калібрується за Tролоксом (Trolox, 6-гідрокси-2,5,7,8-тетраметилхроман-2-карбоновою кислотою), який є водорозчинним аналогом вітаміну Е. Результати представлені в тролоксових одиницях (мілімоль) на мг білка.
2.5. Визначення концентрації білка і статистична обробка результатів
Концентрацію білка в пробах визначали методом Бредфорда [18]. Метод ґрунтується на здатності білка зв’язуватись з барвником Кумасі яскраво-синім G-250 і утворювати забарвлені сполуки (λmax = 595 нм). Концентрацію білка в досліджуваних пробах розраховують за допомогою калібрувального графіка, побудованого зі стандартним розчином білка. Як стандарт використовували альбумін сироватки бика.
Статистичну обробку отриманих даних здійснювали за допомогою комп’ютерної програми „Mynova”. Результати представляли як середнє арифметичне ± (М) та похибка середнього арифметичного (SEM). Порівняння середніх арифметичних і визначення достовірної різниці між ними проводили за допомогою критерію Данета.
Розділ 3. РЕЗУЛЬТАТИ ДОСЛІДЖЕННЯ ТА ЇХ ОБГОВОРЕННЯ
3.1. Вплив різних джерел карбону на ріст на загальну антиоксидантну здатність у дріжджів S. cerevisiae штаму YPH250
Як нам відомо, всі аеробні та анаеробні організми, що ростуть піддаються впливові оксидативному / карбонільному стресу, який виникає за дії частково відновлених форм молекулярного кисню (АФК) чи за дії АКС. Тому, щоб себе захистити, у різних організмів виникли різні механізми захисту. Ці механізми захисту було названо антиоксидантною системою (D.J. Jamieson, 1998), (V.I. Lushchak, 2002),(M. Pollak, C. Leeuwenburgh, 1999). Антиоксидантна система S. cerevisiae залежить не тільки від різних чинників навколишнього середовища, а й від фізіологічного стану самої клітини та середовища росту, в якому перебувають дріжджі. Тому ми вирішили порівняти загальну антиоксидантну здатність у дріжджів S. cerevisiae в присутності росту різних джерел карбону (2% глюкоза; 2% фруктоза; 1% етанол та 1% гліцерол).
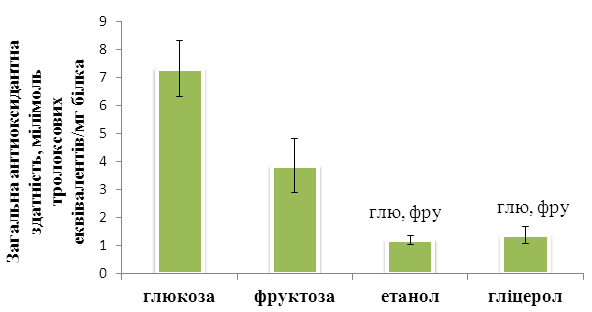
Рисунок 1. Загальна антиоксидантна здатність S. cerevisiae штаму YPH250 за росту в присутності різних джерел карбону. Вірогідно відмінне від відповідних значень, отриманих у присутності глюглюкози i фруфруктози з Р < 0,05, n = 6-10.
Як бачимо на Рис. 1 загальна антиоксидантна здатність дріжджів S. cerevisiae була достовірно вищою у клітин, які росли у присутності глюкози та фруктози, порівняно з клітинами, які росли у присутності етанолу та гліцеролу. Як нам добре відомо, в дріжджів у загальній антиоксидантній системі переважають низькомолекулярні антиоксиданти. Це є загальний вміст тіолів, виснаження яких спостерігається за росту клітин в присутності етанолу та гліцеролу ( A. Balcerczyk 2003)
3.2. Вплив різних джерел карбону на ріст на загальну антиоксидантну здатність у дріжджів S. cerevisiae штаму ∆cta1
3.3. Вплив різних джерел карбону на ріст на загальну антиоксидантну здатність у дріжджів S. cerevisiae штаму ∆ctt1













 (zip - application/zip)
(zip - application/zip)










