МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ РОССИЙСКОЙ ФЕДЕРАЦИИ
ФЕДЕРАЛЬНОЕ государственное БЮДЖЕТНОЕ
образовательное учреждение
высшего образования
«НОВОСИБИРСКИЙ ГОСУДАРСТВЕННЫЙ ТЕХНИЧЕСКИЙ УНИВЕРСИТЕТ»
___________________________________________________
Кафедра инженерных проблем экологии

КУРСОВАЯ РАБОТА
По дисциплине: Органическая химия
На тему: Методы синтеза, особенности строения и реакционной способности альдегидов и кетонов. Исследование физических и химических свойств ацетона, формальдегида и бензальдегида.
Выполнил: Проверил:
Студент гр. СЭ-31
Иванов А. А. Панченко В.Н
«___» ______ 2016г. «___» ______ 2016г.
________________ ________________
(подпись) (подпись)
Новосибирск
2016
Содержание:
Часть 1. Теоретическая часть
ВВЕДЕНИЕ………………………………………………………………………………3
Особенности строения и реакционной способности альдегидов и кетонов…3
Номенклатура альдегидов и кетонов…………………………………………4-5
Физические свойства альдегидов……………………………………………..5-6
Химические свойства альдегидов…………………………………………….6-9
Химические свойства кетонов……………………………………………….9-10
Методы синтеза альдегидов и кетонов…………………………………….10-11
Список использованной литературы…………………………………………………..12
Часть 2. Практическая часть. Лабораторная работа.
1. Изучение физических свойств.
1.1. Определение плотности ацетона с помощью пикнометра…………….…....13
2. Изучение химических свойств альдегидов.
2.1. Окисление альдегидов гидроксидом меди……………………………….......13
2.2. Окисление бензальдегида кислородом воздуха…………………….………..14
2.3. Окисление бензальдегида ……………………………………………………..14
2.4. Реакция формальдегида с аммиаком …………………...………………….…15
ЗАКЛЮЧЕНИЕ…………………………………………………………………………16
Часть 1. Теоретическая часть.
ВВЕДЕНИЕ
Альдегиды
и кетоны относятся к карбонильным органическим
соединениям.
Карбонильными
соединениями называют органические вещества, в молекулах которых имеется группа
>С=О (карбонил или оксогруппа).
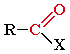
Общая формула карбонильных соединений:
|
|
В зависимости от типа заместителя Х эти соединения подразделяют на: альдегиды ( Х = Н ); кетоны ( Х = R, R" ); карбоновые кислоты ( Х = ОН ) и их производные ( Х = ОR, NH2, NHR, Hal и т.д.).
Особенности строения и реакционной способности альдегидов и кетонов.
|
АЛЬДЕГИДЫ |
|
|||
|
ОБЩАЯ ФОРМУЛА: RCOH |
|
|||
|
Предельные CnH2n+1-CН=О |
Непредельные CH2=CH-CН=О акролеин |
Ароматические С6H5-CН=О бензальдегид |
|
|
|
Суффикс - АЛЬ |
|
|||
|
Изомерия альдегидов: 1. изомерия углеродного скелета, начиная с С4
2. межклассовая изомерия с кетонами, начиная с С3
3. циклическими оксидами (с С2)
4. непредельными спиртами и простыми эфирами (с С3)
|
|
|||
|
КЕТОНЫ |
|
|||
|
ОБЩАЯ ФОРМУЛА: RCOR1 |
|
|||
|
|
||||
|
Суффикс - ОН |
|
|||
|
Изомерия кетонов: 1. углеродного скелета (c C5)
2. положения карбонильной группы (c C5)
3. межклассовая изомерия (аналогично альдегидам). |
|
|||
Номенклатура альдегидов и кетонов
Систематические названия альдегидов строят по названию соответствующего углеводорода с добавлением суффикса -аль. Нумерацию цепи начинают с карбонильного атома углерода.
Тривиальные названия производят от тривиальных названий тех кислот, в которые альдегиды превращаются при окислении.
|
Формула |
Название |
|
|
систематическое |
Тривиальное |
|
|
H2C=O |
метаналь |
муравьиный альдегид (формальдегид) |
|
CH3CH=O |
этаналь |
уксусный альдегид (ацетальдегид) |
|
CH3CH2CH=O |
пропаналь |
пропиновый альдегид |
|
CH3CH2CH2CH=O |
бутаналь |
масляный альдегид |
|
(CH3)2CHCH=O |
2-метил-пропаналь |
изомасляный альдегид |
|
CH3CH2CH2CH2CH=O |
пентаналь |
валериановый альдегид |
|
CH3CH=CHCH=O |
бутен-2-аль |
кротоновый альдегид |
Физические свойства альдегидов:
Метаналь (формальдегид) – газ, альдегиды С2-C5 и кетоны С3-С4 – жидкости, высшие – твердые вещества. Низшие гомологи растворимы в воде, благодаря образованию водородных связей между атомами водорода молекул воды и карбонильными атомами кислорода. С увеличением углеводородного радикала растворимость в воде падает.
Альдегиды обладают удушливым запахом, который при многократном разведении становится приятным, напоминая запах плодов. Альдегиды кипят при более низкой температуре, чем спирты с тем же числом углеродных атомов. Это cвязано с отсутствием в альдегидах водородных связей. В то же время температура кипения альдегидов выше, чем у соответствующих по молекулярной массе углеводородов, что связано с высокой полярностью альдегидов.
Физические свойства некоторых альдегидов:
Формальдегид – газ, с резким запахом, раздражает слизистые ткани и оказывает действие на центральную нервную систему. ОПАСЕН ДЛЯ ЗДОРОВЬЯ! Водный раствор формальдегида – формалин.
Ацетальдегид – жидкость , с запахом зелёной листвы. ОЧЕНЬ ТОКСИЧЕН! Подавляет дыхательные процессы в клетках.
Акролеин СН2 = CHCH=O акриловый альдегид, пропеналь (в производстве полимеров) – образуется при пригорании жиров, жидкость с неприятным запахом, раздражает слизистые ткани.
Бензальдегид C6H5CH=O (производство красителей) – жидкость с запахом горького миндаля, содержится в миндале, листьях черёмухи, косточках персиков, абрикосов.
Физические свойства кетонов.
Простейшие кетоны являются бесцветными жидкостями, которые растворяются в воде. Кетоны обладают приятным запахом. Высшие кетоны – твердые вещества. Газообразных кетонов не бывает, так как уже простейший из них (ацетон) – жидкость. Многие химические свойства, характерные для альдегидов, проявляюся и у кетонов.
Химические свойства альдегидов:
1. Р. Окисления.
Альдегиды легко окисляются до карбоновых кислот. Окислителями могут служить гидроксид меди (II), оксид серебра, кислород воздуха:

Ароматические альдегиды окисляются труднее алифатических. Кетоны, как было сказано выше, окисляются труднее альдегидов. Окисление кетонов проводится в жестких условиях, в присутствии сильных окислителей. Образуются в результате смеси карбоновых кислот. Как отличить альдегиды от кетонов? Различие в способности к окислению служит основой качественных реакций, позволяющих отличить альдегиды от кетонов. Многие мягкие окислители легко реагируют с альдегидами, но инертны по отношению к кетонам. а) Реактив Толленса (аммиачный раствор оксида серебра), содержащий комплексные ионы [Ag(NH3)2]+, дает с альдегидами реакцию «серебряного зеркала». При этом образуется металлическое серебро. Раствор оксида серебра готовят непосредственно перед опытом:
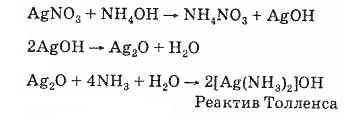
Реактив Толленса окисляет альдегиды до соответствующих карбоновых кислот, которые в присутствии аммиака образуют аммонийные соли. Сам окислитель при этой реакции восстанавливается до металлического серебра. За тонкий серебряный налет на стенках пробирки, который образуется при этой реакции, реакция альдегидов с аммиачным раствором оксида серебра получила название реакции «серебряного зеркала». СН3-СН=O)+2[Ag(NH3)2]OH->CH3COONH4+2Ag+3NH3+H2O. Альдегиды также восстанавливают свежеприготовленный аммиачный раствор гидроксида меди (II), обладающий светло-голубой окраской (реактив Фелинга), до желтого гидроксида меди (I), который при нагревании разлагается с выделением ярко-красного осадка оксида меди (I). СН3-СН=О + 2Cu(ОН)2 — СН3СООН+2CuОН+Н2О 2CuOH->Cu2O+H2O
2. Р. Присоединения
Гидрирование - присоединение водорода.
Карбонильные соединения
восстанавливаются до спиртов водородом, алюмогидридом лития, боргидридом
натрия. Водород присоединяется по связи C=O. Реакция идет труднее, чем
гидрирование алкенов: требуется нагревание, высокое давление и металлический
катализатор (Pt, Ni):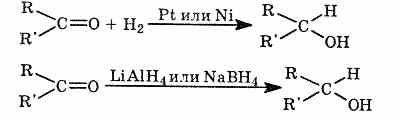
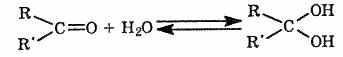
3. Взаимодействие с водой.
4. Взаимодействие, со спиртами.
При взаимодействии альдегидов со спиртами могут образовываться полуацетали и ацетали. Полуацетали представляют собой соединения, в которых при одном атоме углерода содержится гидроксильная и алкоксильная группа. К ацеталям относят вещества, в молекулах которых содержится атом углерода с двумя алкоксильными заместителями.
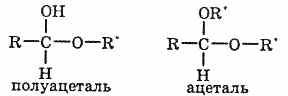
Ацетали, в отличие от альдегидов, более устойчивы к окислению. Благодаря обратимости взаимодействия со спиртами их часто используют в органическом синтезе для « защиты» альдегидной группы.
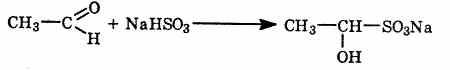
5.Присоединение гидросульфитов.
Гидросульфит NaHSO3 тоже присоединяется по связи C=O с образованием кристаллического производного, из которого карбонильное соединение может быть регенерировано. Бисульфитные производные используются для очистки альдегидов и кетонов.
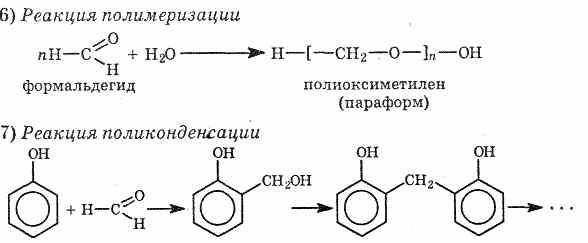
В
результате поликонденсации фенола с формальдегидом в присутствии катализаторов
образуются фенолформальдегидные смолы, из которых получают пластмассы —
фенопласты (бакелиты). Фенопласты — важнейшие заменители цветных и черных металлов
во многих отраслях промышленности. Из них изготавливается большое количество
изделий широкого потребления, электроизоляционные материалы и строительные
детали. Фрагмент фенолформальдегидной смолы показан ниже: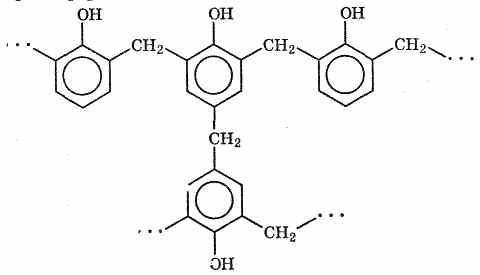
Исходными соединениями для получения альдегидов и кетонов могут быть углеводороды, галогенопроизводные, спирты и кислоты.
Химические свойства кетонов:
1)
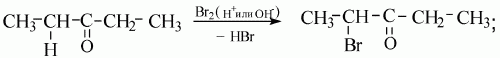
2) гидрирование кетонов в присутствии катализаторов приводит к образованию вторичных спиртов.
Кетоны окисляются значительно труднее альдегидов и только сильными окислителями. При окислении кетонов происходит разрыв (деструкция) углеродной цепи, и образуется смесь продуктов. Кетоны не вступают в реакцию «серебряного зеркала».
Получение:
1) кетоны образуются при окислении или каталитическом дегидрировании вторичных спиртов в присутствии медных катализаторов, например:
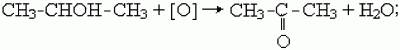
2) как и альдегиды, кетоны можно получить гидролизом дигалогенпроизводных алканов. Чтобы получился кетон, оба атома галогена в исходном соединении должны находиться при одном (не крайнем) атоме углерода:
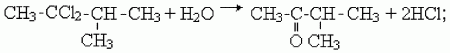
3) кетоны образуются в результате присоединения воды к гомологам ацетилена в присутствии катализаторов – солей ртути (II), например:
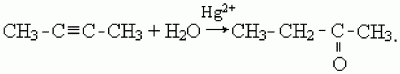
Методы синтеза альдегидов и кетонов.
Методы синтеза альдегидов:
1) Окисление первичных спиртов R CH2 OH R C O H PCC
2) Дегидрирование первичных спиртов R CH2 OH R C O H Cu 3000C + H2
3) Восстановление функциональных производных карбоновых кислот R C O OH LiAlH4 R C O H LiAlH4 R CH2 OH
Для получения альдегида используют пространственно затруднённые, менее активные реагенты: OC(CH3 )3 H Al OC(CH3 )3 OC(CH3 )3 Li LiAlH(O-t-Bu)3 H Al DIBAL-H Литий три-трет- бутоксиалюмогидрид диизобутилалюмогидрид R C O Cl LiAlH(O-t-Bu)
1) , -783C 2) H2O R C O H R C O OR"
1) , -780C 2) H2O R C O H DIBAL-H + R"OH Реакция Розенмунда R C O OH SOCl2 R C O Cl H2 , Pd(S) Pd(BaSO4 ) R C O H
4) Получение из геминальных дигалогенопроизводных CH3 2 Cl2 hν CHCl2 Na2CO3 t 0 C O H
5) Особые методы получения ароматических альдегидов Реакция гаттермана-Коха 2 + CO + HCl AlCl3 C O H Реакция Реймера-Тимана + CHCl3 + 3NaOH C O H ONa ONa + NaCl +2 H2O
6) Гидроборирование алкинов
7) Реакция Кучерова (ацетилен →этаналь)
Методы синтеза кетонов:
Окисление вторичных спиртов R CH OH R" CrO3 C R O R"
2) Дегидрирование вторичных спиртов R CH OH R" C R O R" Cu 3000C + H2
3) Ацилирование по Фриделю-Крафтсу R C O Cl AlCl3 C R O
4) Пиролиз солей карбоновых кислот R C O O Ca C O O R t 0 C R O R + CaCO3
5) Взаимодействие галогеногидринов карбоновых кислот с металлорганическими соединениями (R")2 CuLi + R C O Cl C R O R" + R"Cu +LiCl
6) Взаимодействие металлорганических соединений с нитрилами R R" C NMgX R C N + R"MgX + NH4 + Mg2+ + X
7) Из алкинов с использованием солей ртути (реакция Кучерова).
Список использованной литературы:
1) http://www.e-reading.club/chapter.php/88413/50/Titarenko_-_Shpargalka_po_organicheskoii_himii.html
2) https://sites.google.com/site/himulacom/zvonok-na-urok/10-klass---tretij-god-obucenia/urok-no34-aldegidy-stroenie-molekuly-formaldegida-izomeria-i-nomenklatura
3) https://sites.google.com/site/vikusakoval/home/himiceskie-svojstva-aldegidov
Часть 2. Практическая часть. Лабораторная работа. Методы синтеза, особенности строения и реакционной способности альдегидов и кетонов. Исследование физических и химических свойств ацетона, формальдегида и бензальдегида.
1. Изучение физических свойств.
1.1. Определение плотности ацетона с помощью пикнометра
ρ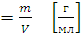
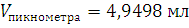
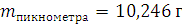
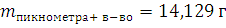
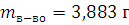
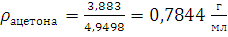
2. Изучение химических свойств альдегидов.
2.1. Окисление альдегидов гидроксидом меди (II)
Реактивы и аппаратура
- Гидроксид натрия, 10% раствор (NaOH)
- Формальдегид, 5% раствор (HCHO)
- Бензальдегид (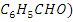
- Сульфат меди, 5% раствор (CuS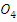 )
)
- Пробирки
- Спиртовка
|
Ход работы: 1) В две пробирки поместить по 0.5 мл раствора гидроксида натрия; 2) Добавить по 0.5 мл воды и 2-3 капли раствора сульфата меди (II); 3) В первую пробирку прилить 2 капли раствора формальдегида, во вторую - 2 капли бензальдегида; 4) Верхнюю часть пробирок прогреть в пламени спиртовки. Вывод: В ходе проделанного опыта, мы можем наблюдать, как в результате реакции на стенках выделяется красный осадок оксида меди.
2.2. Окисление бензальдегида кислородом воздуха. Реактивы и аппаратура
2.3. Окисление бензальдегида.Реактивы и аппаратура - Бензальдегид
- Гидросульфит
натрия (NaHS - Серная
кислота (конц.) - Пробирки - Пипетки
|
Заключение:
АЛЬДЕГИДЫ И КЕТОНЫ – органические соединения, содержащие фрагмент >C=O (углерод, связанный двойной связью с кислородом, его называют карбонильным). У альдегидов карбонильный углерод соединен с атомом Н и органической группой R (общая формула RHC=O), а в кетонах – с двумя органическими группами (общая формула R2С=О).














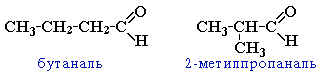
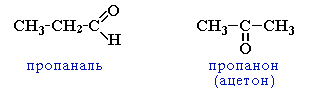
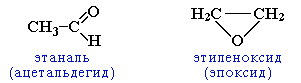
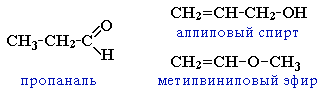
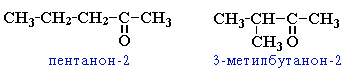
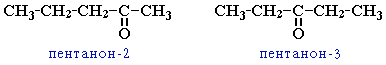
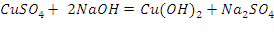
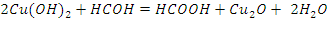
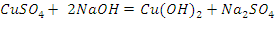
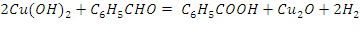
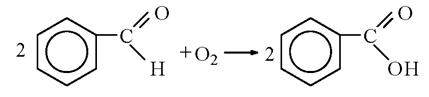
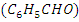
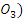
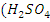 )
)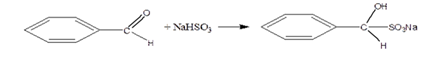
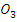
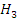 )
) Вывод: В ходе реакции наблюдается улетучивание жидкости, с
характерным неприятным запахом; на дне образуются бесцветные кристаллы
уротропина.
Вывод: В ходе реакции наблюдается улетучивание жидкости, с
характерным неприятным запахом; на дне образуются бесцветные кристаллы
уротропина. (zip - application/zip)
(zip - application/zip)










