Министерство Образования и Науки Российской Федерации
ГБОУ СПО Тверской колледж Сервиса и Туризма
Предмет: Химия
Тема: Диффузия и осмос в растворах
ГБОУ СПО ТКСиТ
Тверь 2015
Содержание:
1.Введение…….3
2.Диффузия……….4-6
3.Осмос…………6-7
4.Диффузия и осмос в растворах……7-10
5.Осмотическое давление………..10-11
6.Явление осмоса в живых клетках………….11-12
7.Литература…………..12
Введение
Важным дополнением к этим теориям являются работы Дерягина и Духина, опубликованные в 1959 г. Эти авторы учли сопутствующий электрокинетическим явлениям эффект диффузии ионов. Он оказался особенно существенным для жидких поверхностей, например - для эффекта Дорна при обратной седиментации (всплывании) пузырьков газа. При движении твердой сферической частицы в растворе электролита также возникают разность концентраций между ее полюсами по направлению движения и соответствующий диффузионный потенциал. Поправка, связанная с этим потенциалом, может оказаться того же порядка, что и сам потенциал перемещения частицы. Формулы, которые получаются при уточнении теории с учетом диффузии, а также закона сохранения анионов и катионов в отдельности, приобретают классическую форму только при равенстве коэффициентов диффузии анионов и катионов. Если учесть диффузию, то, исходя из требования симметрии кинетических коэффициентов в теории Онзагера, можно прийти к выводу, что наличие разности концентраций по обе стороны капилляра или пористой перегородки обязательно должно вызывать течение в растворе (капиллярный осмос), а частицы, находящиеся во взвешенном состоянии в растворе, в котором существует градиент концентрации, должны двигаться (диффузиофорез). Краткость изложения не позволяет нам приводить здесь конкретные выводы и формулы.
Диффузия
Диффузия – это процесс взаимного проникновения молекул или атомов одного вещества между молекулами или атомами другого, приводящий к самопроизвольному выравниванию их концентраций по всему занимаемому объёму. В некоторых ситуациях одно из веществ уже имеет выравненную концентрацию и говорят о диффузии одного вещества в другом. При этом перенос вещества происходит из области с высокой концентрацией в область с низкой концентрацией (вдоль вектора градиента концентрации).
Примером диффузии может служить перемешивание газов (например, распространение запахов) или жидкостей (если в воду капнуть чернил, то жидкость через некоторое время станет равномерно окрашенной). Другой пример связан с твёрдым телом: атомы соприкасающихся металлов перемешиваются на границе соприкосновения. Важную роль диффузия частиц играет в физике плазмы.
Скорость протекания диффузии зависит от многих факторов. Так, в случае металлического стержня тепловая диффузия проходит с огромной скоростью. Если же стержень изготовлен из синтетического материала, тепловая диффузия протекает медленно. Диффузия молекул в общем случае протекает ещё медленнее. Например, если кусочек сахара опустить на дно стакана с водой и воду не перемешивать, то пройдёт несколько недель, прежде чем раствор станет однородным. Ещё медленнее происходит диффузия одного твёрдого вещества в другое. Например, если медь покрыть золотом, то будет происходить диффузия золота в медь, но при нормальных условиях (комнатная температура и атмосферное давление) золотосодержащий слой достигнет толщины в несколько микронов только через несколько тысяч лет. Другой пример: на золотой слиток был положен слиток свинца, и под грузом за пять лет свинцовый слиток проник в золотой слиток на сантиметр.
Уравнения Фика С точки зрения термодинамики движущим потенциалом любого выравнивающего процесса является рост энтропии при постоянных давлениях и температуре в роли такого потенциала выступает химический потенциал, обусловливающий поддержание потоков вещества. Поток частиц вещества пропорционален при этом градиенту потенциала
 ~
~ 
В большинстве практических случаев вместо химического потенциала применяется концентрация C. Прямая замена µ на C становится некорректной в случае больших концентраций, так как химический потенциал перестаёт быть связан с концентрацией по логарифмическому закону. Если не рассматривать такие случаи, то вышеприведённую формулу можно заменить на следующую:

которая показывает, что плотность потока вещества J [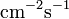 ] пропорциональна коэффициенту диффузии D [(
] пропорциональна коэффициенту диффузии D [( )] и градиенту концентрации. Это уравнение выражает первый закон Фика. Второй закон Фика связывает пространственное и временное изменения концентрации уравнения диффузии.
)] и градиенту концентрации. Это уравнение выражает первый закон Фика. Второй закон Фика связывает пространственное и временное изменения концентрации уравнения диффузии.

Все виды диффузии подчиняются одним законам. Скорость диффузии пропорциональна площади поперечного сечения образца, а также разности концентрации, температур или зарядов (в случае относительно небольших величин этих параметров). Так, тепло будет в четыре раза быстрее распространяться через стержень диаметром в два сантиметра, чем через стержень диаметром в один сантиметр. Это тепло будет распространяться быстрее, если перепад температур на одном сантиметре будет 10 °C вместо 5 °C. Скорость диффузии пропорциональна также параметру, характеризующему конкретный материал. В случае тепловой диффузии этот параметр называется теплопроводность, в случае потока электрических зарядов — электропроводность. Количество вещества, которое диффундирует в течение определённого времени, и расстояние, проходимое диффундирующим веществом, пропорциональны квадратному корню продолжительности диффузии.
Диффузия представляет собой процесс на молекулярном уровне и определяется случайным характером движения отдельных молекул. Скорость диффузии в связи с этим пропорциональна средней скорости молекул. В случае газов средняя скорость малых молекул больше, а именно она обратно пропорциональна квадратному корню из массы молекулы и растёт с повышением температуры. Диффузионные процессы в твёрдых телах при высоких температурах часто находят практическое применение. Например, в определённых типах электронно-лучевых трубок (ЭЛТ) применяется металлический торий, через металлический вольфрам при 2000 °C.
Если в смеси газов масса одной молекулы в четыре раза больше другой, то такая молекула передвигается в два раза медленнее по сравнению с её движением в чистом газе. Соответственно, скорость диффузии её также ниже. Эта разница в скорости диффузии лёгких и тяжёлых молекул применяется, чтобы разделять субстанции с различными молекулярными весами. В качестве примера можно привести разделение изотопов. Если газ, содержащий два изотопа, пропускать через пористую мембрану, более лёгкие изотопы проникают через мембрану быстрее, чем тяжёлые. Для лучшего разделения процесс производится в несколько этапов. Этот процесс широко применялся для разделения изотопов урана (отделение 235U от основной массы 238U). Поскольку такой способ разделения требует больших энергетических затрат, были развиты другие, более экономичные способы разделения. Например, широко развито применение термодиффузии в газовой среде. Газ, содержащий смесь изотопов, помещается в камеру, в которой поддерживается пространственный перепад (градиент) температур. При этом тяжёлые изотопы со временем концентрируются в холодной области.
Осмос
Осмос – процесс односторонней диффузии через полупроницаемую мембрану молекул растворителя в сторону большей концентрации растворённого вещества из объёма с меньшей концентрацией растворенного вещества.
Более широкое толкование явления осмоса основано на применении Принципа Ле Шателье — Брауна: если на систему, находящуюся в устойчивом равновесии, воздействовать извне, изменяя какое-либо из условий равновесия (температура, давление, концентрация, внешнее электромагнитное поле), то в системе усиливаются процессы, направленные на компенсацию внешнего воздействия.
Явление осмоса наблюдается в тех средах, где подвижность растворителя больше подвижности растворённых веществ. Важным частным случаем осмоса является осмос через полупроницаемую мембрану. Полупроницаемыми называют мембраны, которые имеют достаточно высокую проницаемость не для всех, а лишь для некоторых веществ, в частности, для растворителя. (Подвижность растворённых веществ в мембране стремится к нулю). Как правило, это связано с размерами и подвижностью молекул, например, молекула воды меньше большинства молекул растворённых веществ. Если такая мембрана разделяет раствор и чистый растворитель, то концентрация растворителя в растворе оказывается менее высокой, поскольку там часть его молекул замещена на молекулы растворённого вещества. Вследствие этого, переходы частиц растворителя из отдела, содержащего чистый растворитель, в раствор будут происходить чаще, чем в противоположном направлении. Соответственно, объём раствора будет увеличиваться (а концентрация вещества уменьшаться), тогда как объём растворителя будет соответственно уменьшаться.
Например, к яичной скорлупе с внутренней стороны прилегает полупроницаемая мембрана: она пропускает молекулы воды и задерживает молекулы сахара. Если такой мембраной разделить растворы сахара с концентрацией 5 и 10 % соответственно, то через нее в обоих направлениях будут проходить только молекулы воды. В результате в более разбавленном растворе концентрация сахара повысится, а в более концентрированном, наоборот, понизится. Когда концентрация сахара в обоих растворах станет одинаковой, наступит равновесие. Растворы, достигшие равновесия, называются изотоническими. Если принять меры, чтобы концентрации не менялись, осмотическое давление достигнет постоянной величины, когда обратный поток молекул воды сравняется с прямым.
Осмос, направленный внутрь ограниченного объёма жидкости, называется эндосмосом, наружу — экзосмосом. Перенос растворителя через мембрану обусловлен осмотическим давлением. Это осмотическое давление возникает соответственно Принципу Ле Шателье из-за того, что система пытается выровнять концентрацию раствора в обеих средах, разделенных мембраной, и описывается вторым законом термодинамики. Оно равно избыточному внешнему давлению, которое следует приложить со стороны раствора, чтобы прекратить процесс, то есть создать условия осмотического равновесия. Превышение избыточного давления над осмотическим может привести к обращению осмоса — обратной диффузии растворителя.
В случаях, когда мембрана проницаема не только для растворителя, но и для некоторых растворённых веществ, перенос последних из раствора в растворитель позволяет осуществить диализ, применяемый как способ очистки полимеров и коллоидных систем от низкомолекулярных примесей, например - электролитов.
Диффузия и осмос в растворах.
Растворы не электролитов. Диффузия. Осмос. Растворы, в которых нет (или почти нет) ионов, практически не проводят электрического тока, из-за чего их называют не электролитами, в отличие от растворов электролитов, которые содержат ионы и проводят ток. Если представить себе раствор очень малой концентрации, в котором молекулы растворенного вещества практически не взаимодействуют друг с другом (силы притяжения между молекулами в растворе почти отсутствуют из-за того, что среднее расстояние между ними велико по сравнению с их собственными размерами), то поведение этих молекул в растворе будет во многих отношениях аналогично поведению идеального газа. Доказательством правильности такого сравнения является ряд общих свойств, наблюдаемых как у газов, так и у растворов. Аналогия с газами проявляется в способности растворенного вещества к диффузии и в результате этого к возникновению давления, получившего название осмотического.
Изучение свойств растворов высокомолекулярных соединений сыграло огромную роль в развитии коллоидной химии. Первые исследования диффузии, осмоса, оптических свойств коллоидов были проведены с растворами желатины, целлюлозы, т. е. с растворами ВМС. При этом выяснилось, что растворы ВМС более устойчивы по сравнению с золями. В течение длительного времени это объяснялось высоким сродством растворенных веществ к растворителю (дисперсионной среде) и связанной с этим высокой сольватацией. Это нашло отражение в исторически сложившемся названии таких растворов — лиофильные золи или обратимые коллоиды в отличие от лиофобных золей — обычных (необратимых) коллоидных систем. Позднее была найдена истинная причина термодинамической устойчивости лиофильных золей — отсутствие поверхности раздела фаз и поверхностной энергии — их гомогенность. Было показано также, что, хотя свойства растворов высокомолекулярных соединений в значительной степени определяются их сродством к растворителю, доля растворителя, вошедшего в сольватные оболочки, не очень велика. Поэтому правильным следует считать термин растворы ВМС или молекулярные коллоиды, а не лиофильные золи.
Опыты со слабо выраженным внешним эффектом или протекающие в замедленном темпе, а также опыты, демонстрация которых становится опасной при применении больших количеств реагирующих веществ и поэтому обычно демонстрируемых в микро- и микро-количествах. Примерами такого рода могут служить опыты, иллюстрирующие молекулярно-кинетическую теорию, а также многие из свойств веществ, объясняемые на ее основе диффузию, осмос, рост н растворение кристаллов, электролитическую диссоциацию, движение ионов или коллоидных частиц в растворах или газах под действием электрического поля, устойчивость и условия коагуляции дисперсных систем, выделение и растворение газов в жидкостях, кинетические явления в растворах, действие катализаторов, набухание, флотация, демонстрация окраски растворов и ее изменения под действием различных факторов, свойства едких, токсичных и взрывоопасных веществ.
Рассмотрев основные гипотезы о механизме разделения методом обратного осмоса растворов электролитов, а также некоторые вопросы разделения растворов не электролитов, можно перейти к рассмотрению гипотезы, не связывающей проницаемость мембран с отнесением компонентов разделяемой системы к какому-то определенному классу веществ — гипотезе о проникновении через мембрану веществ по механизму активированной диффузии. Этот механизм во многом аналогичен механизму проникновения газов через мембрану.
Молекулы и ионы в растворе могут перемещаться пассивно и спонтанно в определенном направлении в результате диффузии. (Осмос — особый вид диффузии) Для такого перемещения в живых организмах — в отличие от активного транспорта — затраты энергии не требуется. Другой тип движения, а именно объемный поток.
Осмос. В разделе Диффузия в растворе уже говорилось, что в животных и растительных организмах, а также в экспериментальных исследованиях существуют и применяются полупроницаемые перегородки — мембраны, разделяющие растворитель и раствор или растворы различной концентрации. Мембраны различают по составу, структуре, размеру пор, отношению к различным растворителям. Они могут быть животного (например, мочевой пузырь), растительного (оболочка клетки) и искусственного происхождения (пленки из целлофана, коллодия). Некоторые из них проницаемы только для растворенного вещества, другие — только для молекул растворителя. Например, глиняная мембрана, содержащая в порах соль Сиг, проницаема только для молекул воды. Именно мембраны последнего типа будут рассмотрены в этом разделе. Различные биологические мембраны, проницаемые не только для частиц растворителя, но и для ионов и молекул растворенных веществ, будут рассмотрены в разделе Мембранные потенциалы. При наличии мембран в растворах наблюдают явление осмоса.
Хаотическое тепловое движение молекул, являясь причиной диффузионных процессов, вызывает также появление осмотического давления в растворе. Следует отметить, что осмотическое давление проявляется только при наличии полупроницаемой мембраны. Осмосом называется диффузия вещества через полупроницаемую мембрану, разделяющую раствор и чистый растворитель (либо два раствора различной концентрации). Перегородка (мембрана) обладает свойством пропускать только молекулы растворителя. Перенос молекул растворителя через мембрану обусловлен осмотическим давлением. Выравнивание концентрации раствора по обе стороны мембраны, не пропускающей более крупные молекулы растворенного вещества, возможно при односторонней диффузии молекул растворителя. Поэтому осмос всегда идет от чистого растворителя к раствору, или от разбавленного раствора к концентрированному. Этот процесс отражает стремление раствора к уменьшению своей концентрации.
Диффузия может проходить также, если на границе раствора и чистого растворителя (или двух растворов различной концентрации) поместить полупроницаемую перегородку—мембрану. Полупроницаемые перегородки способны пропускать только молекулы растворителя и не пропускают молекулы растворенного вещества. Свойствам полупроницаемости обладают многие природные пленки (стенки клеток живых и растительных организмов, стенки кишечника, протоплазма и др.), а также пленки искусственного происхождения (целлофан, пергамент, пленки из коллодия, желатины). Односторонняя самопроизвольная диффузия молекул растворителя через полупроницаемую мембрану в раствор или из раствора с низкой концентрацией в раствор с высокой концентрацией называется осмосом.
Диффузия и осмос в растворах. Законы осмотического давления и его биологическое значение.
Если в такой цилиндр налить раствор какого-либо вещества, например, сахара, и погрузить цилиндр в воду, то выравнивание концентраций будет происходить только вследствие перемещения молекул воды. Последние в большем числе диффундируют в раствор, чем обратно, поэтому объем раствора будет постепенно увеличиваться, а концентрация сахара в нем уменьшаться. Такая односторонняя диффузия через полупроницаемую перегородку называется осмосом.
ОСМОС — диффузия веществ (проникновение) через пористую перегородку, разделяющую раствор и чистый растворитель или два раствора различной концентрации. О. приближает систему к равновесию, выравнивая концентрации, по обе стороны перегородки
Осмотическое давление.
ОСМОТИЧЕСКОЕ ДАВЛЕНИЕ (диффузионное давление) — сила, с которой молекулы одного вещества стараются проникнуть через перегородку в результате диффузии. О. д. является кинетическим и создается ударами молекул в результате хаотического теплового движения тех веществ, для которых перегородка становится непроницаемой. Характерным случаем для измерения О. д. является осмос через полупроницаемую перегородку, т. е. перегородку, через которую проникают молекулы только одного из веществ (обычно молекулы растворителя). Явление осмоса и О. д. имеют важное значение в жизнедеятельности животных и растительных организмов. Давление, создающееся растворенным веществом в растворе, является одним из важных факторов, влияющих на распределение в тканях воды и растворенных веществ. Этому способствует наличие в организмах многочисленных полупроницаемых перегородок (оболочек клеток, клеток кровеносных сосудов, желудка и др.).
Явление осмоса в живых клетках.
Явление осмоса в живых клетках. Диффузия, осмос и осмотическое давление играют важную роль в животных и растительных организмах. Протоплазма клеток представляет собой идеальную полупроницаемую перегородку, через которую в клетку могут проникать или удаляются из нее только определенные вещества, но она непроницаема для других веществ. Так, стенки эритроцитов (красных кровяных телец) непроницаемы для хлорида натрия, но проницаемы для воды. Если эритроциты ввести в раствор хлорида натрия, осмотическое давление которого больше, чем осмотическое давление внутри клеток гипертонический раствор), то вода диффундирует из клеток наружу, и клетки сжимаются. В растворе, осмотическое давление которого меньше внутреннего давления гипотонический раствор), осмос происходит в противоположном направлении. Вода извне проникает в клетки, при этом они набухают. Объем клеток увеличивается до тех пор, пока их стенки не лопаются и содержимое не вытекает в окружающую жидкость. Два раствора, которые имеют одинаковое осмотическое давление независимо от состава растворенных веществ, обусловливающих это давление, называются изотоническими или изоосмотическими растворами. Жидкость крови, в которой взвешены красные кровяные тельца, плазма крови — является изотонической с жидкостью, находящейся в красных кровяных тельцах и других клетках организма.
Скорость диффузии растворенного вещества с большой молекулярной массой (>500) в раствор низка и значительно меньше скорости диффузии электролита. Поэтому влияние концентрационной поляризации на процесс ультрафильтрации намного сильнее, чем на процесс обратного осмоса. Концентрация у поверхности мембраны при ультрафильтрации может достигнуть такого значения, что на мембране может образоваться слой геля, который резко снижает скорость процесса. Для того чтобы повысить скорость ультрафильтрации, приходится интенсивно перемешивать раствор или прокачивать его с большой скоростью (до 3—5 м/с) над мембраной. Однако в ряде случаев такой путь оказывается непригодным, так как приводит к резкому повышению расхода энергии на циркуляцию раствора, недопустимому повышению температуры раствора, разрушению структуры некоторых биополимеров и т. п. В этих случаях более рациональным может оказаться применение турбо вставок.
Литература - http://chem21.info/info/1500710/














 (zip - application/zip)
(zip - application/zip)










