Федеральное агентство по образованию
Государственное образовательное учреждение профессионального
высшего образования
Петрозаводский государственный университет
Медицинский институт
Кафедра педиатрии
Северо-Запад
Реферат по химии
Никель
Петрозаводск
2015
Оглавление
Оглавление……………………………………………………………………….2
Введение…………………………………………………………………………3 Цель…………………………………………………………………………...4 Задачи…………………………………………………………………………4
Нахождение никеля в природе…………………………………………………5
Общая характеристика элемента никель……………………………5
Нахождение в природе…………………………………………………..10
Химические свойства……………………………………………………………14
Взаимодействие никеля с галогенами…………………………………..19
Взаимодействие никеля с неметаллами…………………………………20
Взаимодействие никеля с кислородом…………………………………20
Взаимодействие никеля с водой…………………………………………22
Взаимодействие никеля с щелочами…………………………………...22
Взаимодействие никеля с кислотами……………………………………22
Взаимодействие никеля с солями……………………………………….23
Соединения никеля и их химические свойства……………………………….25
Соединения одновалентного никеля…………………………………….25
Соединения двухвалентного никеля…………………………………….26
Соединение трехвалентного никеля…………………………………….38
Возможное применение соединений никеля в медицине……………………40
Содержание элемента в организме человека и депонирование в органах и тканях…………………………………………………………………………..40
Взаимодействие никеля с другими элементами………………………41
Способы применения никеля и его соединений………………………41
Применение никеля в медицине……………………………………….43
Хирургические инструменты…………………………………….43
Медицинские имплантаты………………………………………..44
Стенты для сосудов………………………………………………45
Стоматология и ортодонтия…………………………………….46
Имуннология. Дерматология (лечение псориаза)………………47
Защита от электромагнитного излучения………………………..48
Об ограничении применения никелевых покрытий в Европе………49
Заключение……………………………………………………………………..51
Приложение…………………………………………………………………….52
Библиографический список……………………………………………………..55
Введение
Никель был открыт химиком из Швеции Акселем Фредриком .Кронстедтом (1722-1765) в 1751 г. и стал семнадцатым известным элементом. Уже были известны 12 металлов и 4 неметалла (сера, углерод, фосфор, мышьяк). Изучение свойств никеля происходило очень медленно. В 1775 г. Французская энциклопедия сообщала следующее «еще должны быть проведены дальнейшие опыты, чтобы убедить нас, если этот королек «никеля», о котором говорит Кронстедт, особый полуметалл или скорее его следует считать соединением железа, мышьяка, висмута, кобальта и даже меди с серой». Окончательно никель Крондстедта был признан самостоятельным металлом благодаря работам Т. Бергмана (1735-1784), Ж.Л. Пруста (1754-1826), Л.Ж. Тенора (1777-1857), И. Рихтера (1762-1807).
Никель имеет широкое применение, как основа для создания никелевых сплавов и легирующий элемент в других сплавах – на основе железа, меди и т.д. На сегодняшний день никель и его сплавы используют для деталей специального назначения, приборы строения, машиностроения, в ракетной технике, атомных реакторов, для производства щелочных аккумуляторов, пористых фильтров, катализаторов для антикоррозионного электролитического покрытия деталей и полуфабрикатов. Никель используют для различных деталей электронной аппаратуры, а также для изготовления химической аппаратуры, медицинской техники и магнитострикторов.
Цель: изучение химических и биологических особенностей никеля, распространения в природе и возможных применений соединений элемента.
Задачи:
1. Узнать о распространении элемента в природе
2. Описать все возможные соединения никеля
3. Изучить химические свойства элемента и его соединений
4. Указать биологическую роль никеля в организме человека
5. Исследовать токсичность элемента
6. Рассмотреть возможное применение никеля в медицине
Нахождение никеля в природе
(Карцева Алина и Русскова Софья)
1. Общая характеристика элемента никель
Никель — элемент десятой группы, четвертого периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 28. Обозначается символом Ni. Простое вещество никель — это пластичный, ковкий, переходный металл серебристо-белого цвета, при обычных температурах на воздухе покрывается тонкой пленкой оксида. Химически малоактивен.
Вместе с железом и кобальтом никель образует в четвертом периоде в этой группе триаду близких по свойствам переходных металлов. Вследствие схожести этих элементов и резкого отличия их от элементов двух других триад данной группы их обычно выделяют в семейство железа.
Металлический никель — это пластичный ковкий переходный металл серебристо-белого цвета с желтоватым оттенком, отличается высокой твердостью, способностью к полировке, кроме того, никель притягивается магнитом. При обычных температурах на воздухе металл покрывается тонкой защитной пленкой оксида NiO. Характеризуется высокой коррозионной стойкостью вследствие своей малой химической активности.
В природе никель представлен пятью стабильными изотопами: 58Ni (67,88 % по массе), 60Ni (26,23 %), 61Ni (1,19 %), 62Ni (3,66 %) и 64Ni (1,04 %)[1]. Еще восемь изотопов никеля с массовыми числами 54, 55, 56, 57, 59, 63, 65 и 66 получены в разные годы искусственным путем. Самый стабильный из них 59Ni имеет период полураспада 75 тыс. лет, а самые короткоживущие изотопы этого элемента — 54Ni и 55Ni — меньше пяти минут.
В настоящее время основная часть выплавляемого никеля идет на производство различных сплавов с железом, медью, цинком и другими металлами. Легирование сталей никелем повышает их вязкость и стойкость против коррозии. Сплавы на базе никеля подразделяются на жаропрочные, магнитные и сплавы с особыми свойствами. Жаропрочные сплавы используются в современных турбинах и реактивных двигателях. Магнитные сплавы обладают очень высокой начальной магнитной проницаемостью, что обуславливает их интенсивную намагничиваемость даже в слабых полях. Сплавы с особыми свойствами обладают рядом незаменимых качеств, которыми обладает сам никель и металл «спутник»: высокая коррозионная стойкость, малое тепловое расширение и другие.
В сравнительно небольших количествах никель расходуется для покрытия им других металлов (никелирование). Мелко дробленый никель используют в качестве катализатора при многих химических процессах. Чистый металлический никель используют при изготовлении лабораторной посуды.
Из соединений никеля важнейшее практическое значение имеет оксид никеля (III), который применяют при изготовлении щелочных кадмиево-никелевых и железо-никелевых аккумуляторов.
· Физические свойства.
Никель — серебристо-белый металл с бежевым отливом, твердый (твердость по Бринеллю 600—800 Мн/м2), но в тоже время пластичный и ковкий (модуль нормальной упругости 205 Гн/м2). Однако долгое время металлурги не могли получить никель, обладающий свойствами, которые описал Рихтер. Металл, получаемый при выплавке, был хрупким и совершенно непригодным для обработки. Как оказалось, примеси серы лишь в 0,03 % — достаточно, чтобы вконец испортить механические свойства никеля. Дело в том, что тончайшая пленка хрупкого сернистого никеля разъединяет зерна металла, нарушает его структуру[2]. Примерно так же действует на свойства этого металла и кислород. Первые металлурги не знали, каким образом добиться необходимой чистоты никеля, но вскоре одно открытие решило проблему чистоты металла. Оказалось, что присадка магния в расплавленный никель перед разливкой освобождает элемент от примесей: магний активно связывает, «принимает на себя» серу и кислород. В очищенном от примесей состоянии никель весьма ковкий и вязкий материал, из которого возможно изготовление очень тонких листов и трубок малого диаметра (относительное удлинение 40 %). Предел упругости чистого металлического никеля 80 Мн/м2, предел текучести 120 Мн/м2. Предел прочности при растяжении 400—500 Мн/м2 или 40—50 кгс/мм2.
В обычных условиях никель имеет гранецентрированную кубическую решетку — а = 3,5236, атомный радиус 1,24A, ионные радиусы: Ni2+ 0,79A, Ni3+ 0,72A — β-модификации, однако, подвергнутый катодному распылению в атмосфере водорода, образует α-модификацию с гексагональной решеткой очень плотной упаковки (а = 2,65 A, с = 4,32 A), которая при нагревании выше 200 °C переходит в кубическую. В обычном (β-модификация) состоянии плотность никеля составляет 8,9 г/см3 (при температуре 20 C). Температура плавления никеля (tпл) составляет порядка полутора тысяч градусов Цельсия (1453° C), температура кипения (tкип) около 3000° C.
По этой причине никель употребляется, как легирующий элемент для жаропрочных сталей. Ведь показатели плавления и кипения у никеля немногим ниже тех же показателей у титана (tпл = 1668° C; tкип = 3227° C) и хрома (tпл = 1890° C; tкип = 2500° C) — металлов, активно используемых в легировании сталей, работающих в условиях повышенных температур.
Другие температурные показатели никеля — удельная теплоемкость (при 20 °C) 0,440 кдж/(кг∙К) или 0,105 кал/(г∙°C); температурный коэффициент линейного расширения 13,3∙10-6 (в пределах 0—100 °C). Теплопроводность этого металла варьируется в зависимости от температуры, так при 25 °C она составляет 90,1 вт/(м∙К) или 0,215 кал/(см∙сек∙°С), а уже при 500° C — 60,01 вт/(м∙К) или 0,148 кал/(см∙сек∙C°)[3].
Удельное электросопротивление никеля (при 20 C) 68,4 ном∙м или 6,84 мком∙см; температурный коэффициент электросопротивления 6,8∙10-3 (в пределах 0—100 °C).
Интересны и магнитные свойства двадцать восьмого элемента. Никель — ферромагнетик, это следствие особенностей строения внешних электронных оболочек его атомов. В конце девятнадцатого века было открыто интересное свойство никеля, названное магнитострикцией. Оно заключается в том, что под действием магнитного поля стержень из никеля укорачивался в отличие от стержней близких данному металлу железа и кобальта. Механизм данного явления заключается в следующем — при возникновении внешнего магнитного поля хаотично расположенные микромагнитики металла (домены) выстраиваются в одном направлении, деформируя этим кристаллическую решетку. Эффект обратим: приложение механического напряжения к металлу меняет его магнитные характеристики.
· Химические свойства.
Для никеля характерны соединения со степенью окисления +2 и +3. В химическом отношении данный элемент можно охарактеризовать, как малоактивный — он устойчив к воздействию воздуха и воды, не растворяется в щелочах и ряде кислот.
Столь высокая стойкость по отношению к агрессивным средам объясняется склонностью никеля к пассивированию, то есть образованию на его поверхности плотной оксидной пленки NiO, которая прочно предохраняет металл от дальнейшего окисления.
Как уже говорилось, компактный никель стабилен на воздухе, однако высокодисперсный (в виде порошка) металл пирофорен (самовоспламеняется на воздухе). Лишь при нагревании до температуры выше 800 °C металлический никель начинает активно реагировать с кислородом воздуха с образованием оксида NiO (зеленоватые кристаллы, практически нерастворимые в воде — минерал бунзенит), обладающего основными свойствами[4].
Оксид (закись) никеля существует в двух полиморфных модификациях: низкотемпературной с гексагональной решеткой и высокотемпературной с кубической решеткой, устойчивой при температуре выше 252 °C. Второй оксид никеля Ni2O3 является сильным окислителем. Этим оксидам соответствуют два гидроксида никеля: Ni(OH)2 и Ni(OH)3. Гидроксид никеля (II) выпадает в виде светло-зеленого осадка при действии щелочей на растворы солей этого металла. При нагревании гидроксид утрачивает воду и переходит в серо-зеленый оксид никеля (II) NiO. В отличие от гидроксидов железа (II) и кобальта (II), гидроксид никеля (II) кислородом воздуха не окисляется. В этом заключается более высокая устойчивость к окислению соединений никеля (II) по сравнению с аналогичными соединениями железа и кобальта. Гидроксид никеля (III) имеет черно-бурый цвет и образуется при действии щелочей на соли никеля в присутствии сильных окислителей.
Никель практически не взаимодействует с фосфорной, плавиковой и некоторыми другими кислотами, хотя серная и соляная кислоты медленно растворяют никель. Лишь в азотной кислоте происходит активное растворение этого элемента, причем в результате образуется нитрат никеля (II) Ni(NO3)2 и выделяется соответствующий оксид азота:
3Ni + 8HNO3 → 3Ni(NO3)2 + 2NO + 4H2O
Сильные щелочи на никель не действуют, но он растворяется в аммиачных растворах в присутствии (NH4)2CO3 с образованием растворимых аммиакатов, окрашенных в интенсивно-синий цвет[5].
С графитом никель образует карбид Ni3C при медленном (сотни часов) науглероживании (цементации) порошка никеля в атмосфере СО при 300 °C, c фосфором — фосфиды составов Ni5P2, Ni2P, Ni3P. С азотом никель не реагирует даже при высоких температурах (до 1 400 °C). Нитрид Ni3N может быть получен пропусканием NH3 над NiF2, NiBr2 или порошком металла при температуре 445 °C. Нагревание порошков никеля и серы приводит к образованию сульфида никеля NiS. Кроме того, никель реагирует и с другими неметаллами.
При нагревании никель реагирует со всеми галогенами с образованием дигалогенидов NiHal2.
Соли никеля большей частью имеют зеленый цвет. Почти все соли Ni (II) и сильных кислот хорошо растворимы в воде. Труднорастворимы соли таких сравнительно слабых кислот, как угольная и фосфорная. Большинство солей никеля разлагается при прокаливании (600—800 °C). Наиболее известны такие растворимые в воде соли никеля, как сульфат NiSO4, нитрат Ni(NO3)2, ацетат, хлорид и многие другие. Растворы окрашены обычно в зеленый цвет, а безводные соли — желтые или коричнево-желтые. К числу нерастворимых соединений никеля относятся оксалат и фосфат Ni3(PO4)2 (зеленого цвета), силикат Ni2SiO4, три сульфида NiS (черный), Ni2S3 (желтовато-бронзовый) и Ni3S4 (черный).
При повышенных температурах никель взаимодействует с оксидами азота, SO2 и NH3. С оксидом углерода CO никель легко образует летучий и весьма ядовитый карбонил Ni(CO)4.
2. Нахождение в природе
Самая распространенная в научных кругах и наиболее достоверная гипотеза строения Земли утверждает, что структура ядра нашей планеты подобна составу железных метеоритов, то есть — это железоникелевый сплав — более 90 % железа, 8,5 % никеля и всего 0,6 % кобальта. Таким образом, земное ядро заключает в себе практически весь двадцать восьмой элемент на планете — около 17∙1019 тонн (общее количество Ni оценивается в 17,4∙1019 тонн)[6]. Исходя из этой гипотезы, можно утверждать, что Земля примерно на 3 % состоит из никеля, а среди составляющих планету элементов никель занимает пятое место — после железа, кислорода, кремния и магния. Однако в тонкую поверхностную кору Земли проникли лишь немногие из его атомов — в среднем один из ста тысяч (содержание никеля в земной коре по сведениям разных источников составляет от 1∙10–3 до 8∙10–3 % по массе). Часть «прорвавшихся» атомов образовала вместе с медью и серой скопления сернистых минералов — сульфидные медно-никелевые руды. Другие атомы никеля до самой поверхности Земли двигались в окружении железа, магния и хрома, что объясняется сходством их валентности (II) и ионных радиусов; в минералы двухвалентных железа и магния никель входит в виде изоморфной примеси. При дальнейшем движении спутники никеля окислились, и часть их ушла прочь в виде гидроокисей. Обогащенные никелем невзрачные землистые остатки ныне называются окисленными никелевыми рудами.
Содержание никеля в ультраосновных породах примерно в сотни раз выше, чем в кислых (1,2 кг/т и 8 г/т соответственно). В ультраосновных породах преобладающее количество никеля связано с оливинами, содержащими 0,13 — 0,41 % Ni. Он изоморфно замещает железо и магний[7].
Небольшая часть никеля присутствует в виде сульфидов — при повышенном содержании в магме серы возникают сульфиды никеля вместе с железом, медью, кобальтом и платиноидами. В гидротермальном процессе совместно с кобальтом, мышьяком и серой и иногда с висмутом, ураном и серебром, никель образует повышенные концентрации в виде арсенидов и сульфидов никеля.
В биосфере и поверхностных водах никель слабый мигрант. Так его среднее содержание в растениях 5,0∙10-5 % на сырое вещество, в организме наземных животных 1,0∙10-6 %, в морских организмах — 1,6∙10-4 %, что обусловлено большим содержанием никеля в морской воде. В районах, где преобладают ультраосновные породы, почва и растения обогащены никелем.
Никелевые руды — вид полезных ископаемых, природные минеральные образования, содержание никеля в которых достаточно для экономически выгодного извлечения этого металла или его соединений[8]. Обычно разрабатываются месторождения сульфидных руд, содержащие 1—2 % Ni, и силикатные руды, содержащие 1—1,5 % Ni.
К наиболее важным минералам никеля относят наиболее часто встречающиеся и промышленные минералы: сульфиды (пентландит (Fe, Ni)S (или (Ni, Fe)9S8; содержит 22–42% Ni), миллерит NiS (64,5% Ni), никелин (купферникель, красный никелевый колчедан) NiAs (до 44% Ni), никелистый пирротин, полидимит, кобальт-никелевый пирит, виоларит, бравоит, ваэсит NiS2, хлоантит, раммельс-бергит NiAs2, герсдорфит (герсфордит, никелевый блеск NiAsS), ульманит), водные силикаты (гарниерит, аннабергит, ховахсит, ревдинскит, шухардит, никелевые нонтрониты) и никелевые хлориты.
Основной источник никеля — промышленные никелевые руды, которые подразделяются на сульфидные медно-никелевые и силикатные.
В-первых главными минералами являются магнетит, кубанит, пентландит, миллерит, халькоперит, пирротин, нередко сперрилит. Месторождения этих руд принадлежат к магматическим образованиям. Содержание никеля в сульфидных рудах колеблется в пределах от 0,3 до 4 % и более. Кроме никеля и меди, из руд извлекается значительное количество кобальта, а также золота, платины, палладия и другие ценные металлы.
Силикатные никелевые руды представляют собой рыхлые и глиноподобные породы коры выветривания ультрабазитов, содержащие никель (обычно не менее 1%)[9]. С корами выветривания серпентинитов площадного типа связаны руды, в которых никельсодержащими минералами являются: керолит, гетит, нотронит, серпентин, асболаны. С корами выветривания трещинного, контактово-карстового и линейно-площадного типов связаны руды главными минералами в которых являются гарниерит, никелевый керолит, непуит, ферригаллуазит. Среди силикатных руд выделяются желези стые, магнезиальные, кремнистые, глиноземистые. В ряде месторождений совместно с силикатными никелевыми рудами залегают железо-никелевые руды с высоким содержанием железа (более 50 %).
Химические свойства никеля
(Пахомова Анна и Гусейнов Эльмин)
Никель (Ni) является элемент восьмой группы, четвёртого периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 28, относится к семейству железа. Простое вещество - это металл серебристо-белого цвета, пластичный, ковкий, при обычных температурах на воздухе образует тонкую оксидную пленку на поверхности. Ему присущи характерные свойства металлов. Химически малоактивен.
· Свойства атома:
1)Атомная масса (молярная масса): 58,6934 г/моль;
2)Строение внешнего электронного слоя: 3d84s2;
3)Радиус атома: 124пм.
· Электронная конфигурация:
1s22s22p63s23p64s23d8
На первом энергетическом уровне 2 электрона на s-орбитали, на втором-2 электрона на s-орбитали и 6 на p-орбитали, на третьем- 2 на s-орбитали, 6 на p-орбитали и 8 электронов на d-орбитали, на четвертом- 2 электрона на s-орбитали.[10]
· Химические свойства:
1)Ковалентный радиус: 115 пм;
2)Радиус иона: (+2е) 69пм;
3)Электроотрицательность: 1,91 (шкала Полинга);
4)Электродный потенциал: -0,25 В;
5)Степени окисления: 0; +1; +2; +3; +4(редкие и неустойчивые соединения);
6)Энергия ионизации: 736,2 кДж/моль.
В ряду активности металлов он находится между кобальтом и оловом:
Li, Rb, K, Ba, Sr, Ca, Na, Mg, Al, Mn, Zn, Cr, Fe, Cd, Co, Ni, Sn, Pb, H, Sb, Bi, Cu, Hg, Ag, Pd, Pt, Au
· Термодинамические свойства простого вещества:
1)Плотность (при н.у.): 8,902 г/см3;
2)Температура плавления: 1453 °С (1726 К, 2647 °F);
3)Температура кипения: 2732 °С (3005 К, 4949 °F);
4)Удельная теплота плавления: 17, 61 кДж/моль;
5)Удельная теплота испарения: 378,6 кДж/моль;
6)Молярная теплоёмкость: 26,1 Дж/моль;[11]
7)Молярный объём: 6,6 см3/моль.[12]
· Изотопы никеля:
Природный никель состоит из смеси пяти стабильных изотопов: 58Ni (67,76%), 60Ni (26,26% ), 61Ni (1,25%), 63Ni (3,66%), 63Ni (1,16%).
“Изотопным составом объясняется меньший атомный вес природного никеля, по сравнению с кобальтом, имеющим порядковый номер 27.”[13] (Пешкова В. М. Аналитическая химия никеля / В. М. Пешкова, В. М. Савостина. - Москва: Издательство наука, 1966.- C.5-7.)
· Природные и искусственные полученные изотопы никеля:
1) 56Ni: тип излучения γ период полураспада 6, 4 дня происхождение изотопа искусственное содержание в природном никеле 0%;
2) 57Ni: тип излучения β+ период полураспада 36 часов происхождение изотопа искусственное содержание в природном никеле 0%;
3) 58Ni: - стабилен происхождение изотопа естественное содержание в природном никеле 67,76%;
4) 59Ni: тип излучения К, нет β+ 5∙104 искусственное содержание в природном никеле 0%;
5) 60Ni: - стабилен происхождение изотопа естественное содержание в природном никеле 26,16%;
6) 61Ni: - стабилен происхождение изотопа естественное содержание в природном никеле 1,25%;
7) 62Ni: - стабилен происхождение изотопа естественное содержание в природном никеле 3,66%;
8) 63Ni: тип излучения β- период полураспада 125 лет происхождение изотопа искусственное содержание в природном никеле 0%;
9) 64Ni: тип излучения β- больше 3∙1015 происхождение изотопа естественное содержание в природном никеле 1,16%;
10) 65N: тип излучения β-, γ период полураспада 2,6 часа происхождение изотопа искусственное содержание в природном никеле 0%;
11) 66Ni: тип излучения β- период полураспада 54,8 часа происхождение изотопа искусственное содержание в природном никеле 0%.
В большинстве соединений никель положительно двухвалентен, но известны комплексные соединения, где никель имеет валентность +2 и +3. По химическим свойствам никель близок к железу и кобальту, отчасти, меди. Трудность окисления ионов Cu (2+) и Ni (2+) объясняется высокими значениями третьего потенциала ионизации (Энергии ионизации , т. е, энергии, необходимой для отрыва одного электрона от нейтрального атома. Отношение этой величины к заряду электрона есть ионизационный потенциал, т. е. напряжение электрического поля, достаточное для отрыва электрона.)
Как отмечалось ранее, никель нельзя отнести к активным металлам, он[14] обладает средней химической активностью, но тонкодисперсный порошок, полученный восстановлением соединений никеля водородом при низких температурах, пирофорен.[15]
“Никель является металлом сравнительно низкой химической активности. При обычных температурах, он покрывается тонкой защитной окисной пленкой и не взаимодействует с влагой воздуха, водой и рядом растворителей. Вода, насыщенная углекислотой, в присутствии ионов хлора может вызвать точечную коррозию никеля. Никель превосходно сопротивляется коррозии в щелочных растворах. Сильные щелочи — едкий натрий и едкий калий — на никель не действуют, так же как и безводный аммиак. Однако он растворяется в аммиачных растворах в присутствии (NH4)2CO3 с образованием растворимых аммиакатов, окрашенных в зеленый цвет ”. [16](Дриц М. Е. Свойства элементов / М. Е. Дриц [и др.].- Москва: Издательство: Металлургия, 1985.-C.490.)
При обычных условиях никель устойчив к реакциям с кислородом, галoгенами, серой, щелочами. Сухие газы(окислы азота, сернистый газ и аммиак) при комнатной температуре с никелем не реагируют.
· Взаимодействие никеля с галогенами.
Металлический никель в отсутствии повышенной температуры и влаги устойчив к действию не только кислорода, но галогенов: фтор (F2), хлор (Cl2), бром (Br2), йод (I2), астат (At2). При обычных условиях никель с галогенами не реагирует.
 Ni + Hal →[17]
Ni + Hal →[17]
При нагревании никель реагирует со всеми галогенами с образованием дигалогенидов никеля.[18]
Ni + Hal2 →t NiHal2
1) Ni + F2 →t NiF2
2) Ni + Cl 2→t NiCl2
3) Ni + Br2 →t NiBr2
4) Ni + I2 →t NiI2
· Взаимодействие никеля с неметаллами.
Никель реагирует не со всеми неметаллами, так к действию фтора никель устойчив и не реагирует даже при температуре красного каления.
 Ni + F →
Ni + F →
С некоторыми неметаллами при создании специальных условий никель взаимодействует.
При обычных условиях никель устойчив.
 Ni + S →
Ni + S →
Однако, нагревание порошков никеля и серы приводит к образованию сульфида никеля (NiS).
Ni + S →NiS
Сульфиды никеля практически не растворимы в воде и органических растворителях. Разлагаются лишь азотной кислотой и царской водкой. При нагревании в вакууме выше 500°Сдиссоциируют с образованием паров серы и фаз, обогащенных никелем. При нагревании на воздухе окисляются.
· Взаимодействие никеля с кислородом.
При обычных условиях никель с кислородом не реагирует, и на воздухе он почти не изменяется.
 Ni + O2 →
Ni + O2 →
Но при высокой температуре (500 °C) реакция с кислородом протекает с образованием монооксида никеля (NiO), представляющий собой зеленовато-желтый светлый порошок. Происходит окислительно-восстановительная реакция, и никель переходит из Ni 0 в Ni +4.
2Ni + O2 →t 2NiO
Однако, в мелкодисперсном состоянии (в виде мелкораздробленного порошка) никель обладает пирофорностью, т. е. самовоспламеняется на воздухе даже при обычной температуре.
Как отмечалось ранее, в мелкодисперсном состоянии никель пирофорен, и способен поглощать большое количество газов (Н2, СО и др.), что, кстати,[19] ухудшает его свойства. Так при реакции с монооксидо углерода (II) образуется карбид никеля, представляющий собой серые кристаллы.
3Ni+ 2CO →t Ni3C + CO2
При неизмельченном состоянии металла возможно образование тетракарбонила никеля, представляющего собой бесцветную жидкость.
Ni +4 CO→tNi(CO)4[20]
При реакции с водородом образуется гидрид никеля, представляющий собой черные кристаллы.
Ni + H2 →t NiH2
“В тонко раздробленном состоянии никель адсорбирует водород, на этом свойстве никеля основано применение никеля и его соединений в качестве катализатора, ускоряющего присоединение или отщепление водорода.” (Никель//Большая советская энциклопедия/.-1939.-Т42.-С.111.)
· Взаимодействие никеля с водой.
По отношению к воде никель устойчив. Его гидроксо-соединения, такие как гидроксид никеля (II) Ni(OH)2 и гидроксид никеля (III) Ni(OH)3 получают косвенным путем.
· Взаимодействие никеля с щелочами.
Щелечи как в водных растворах так и расплавах не действуют на никель.
 Ni + NaOH →
Ni + NaOH →
· Взаимодействие никеля с кислотами.
При реакции с кислотами такими как азотная, серная, соляная, образует соответствующие двухвалентные соли.[21]
Никель легко растворяется в разбавленных кислотах, при этом он образует аквакатиона [Ni(H2O)6] с зарядом 2+. Стоит заметить, что с соляной, серной, фосфорной, фтористоводородной кислотами никель реагирует медленно.
Ni +2HCl (разб.) →tNiCl2 + H2↑[22]
Ni +H2SO4 (разб.)→ Н2↑+ NiSO4
Легче и быстрее всего никель реагирует с разбавленной азотной кислотой.
Ni + 8HNO3 (разб.)→ Ni(NO3)2 + 2NO↑ +4H2O
При действии на никель концентрированных серной и азотной кислот, они лишь пассивируют металл, т е приводят к образованию на поверхности оксидных пленок, как и в случае c железом.
“Органические кислоты действуют на Никель, лишь после длительного соприкосновения с ними”. (Грибовская И. Ф. Никель/И. Ф. Грибовская//Большая советская энциклопедия/.-1974.-Т17.-С.611.)
· Взаимодействие никеля с солями.
В силу малой химической активности никеля такие соединения как сода (Na2CO3), поташ (K2CO3) не взаимодействуют с металлом.
 Ni + Na2CO3→
Ni + Na2CO3→
 Ni + K2CO3→
Ni + K2CO3→
Однако, такие малоактивные металлы как медь (Cu) никель вытесняет из солей
Ni + CuSO4 → NiSO4 + Cu
“Никель один из самых активных металлов — катализаторов. Ката-
литическая активность никеля зависит от степени дисперсности порошка,
его чистоты и методики его получения. Каталитическими свойствами об-
ладают многие сплавы никеля с алюминием, молибденом и с другими
элементами, а также и некоторые соединения: оксид, сульфид, бориды
никеля и другие.”[23]
Соединения никеля и их химические свойства
(Стрекачева Наталья и Кузьмич Алена)
Известно ограниченное число соединений одно-, трех- и четырехвалентного никеля и очень много соединений двухвалентного никеля. Большинство соединений никеля являются координационными, за исключением окислов, сульфидов, никелатов. Соединения никеля (I) неустойчивы и обладают восстановительными свойствами, в то время как соединения никеля (III) и (IV) проявляют окислительный характер.
I. Соединения одновалентного никеля
Соединения одновалентного никеля, являются неустойчивыми, легко выветриваются на воздухе, они окрашены в желтый, красный, зеленый и синий цвета, получаются восстановлением никеля (II).«Примеры соединений никеля (I): окись Ni2O – оранжево-желтая, гидроокись NiOH - синия, цианид NiCN - оранжевый, сульфидNi2S – желтый и т.д.»[24]
Гидроокись никеля, NiOH, получают разложением водными растворами щелочей кристаллического фиолетового соединения HN(SO3H)(SO3)Ni•nH2O. Гидроокись никеля образуется в виде темно-синего осадка, который:
· Реагирует с сульфидами и цианидами щелочных металлов:


II. Соединения двухвалентного никеля
Также, известно очень много соединений, в которых электроположительный двухвалентный никель находится в виде катиона Ni2+.
1. Оксид никеля (II) NiO - неорганическое бинарное соединение двухвалентного никеля с кислородом. Образуется в результате реакции никеля с кислородом при нагревании выше 500°C.

Оксид представляет собой кристаллическое соединение зеленого цвета, нерастворимое в воде. Встречается в природе в виде редкого минерала бунзенита. Получают путем термического разложения гидроксида никеля(II) или некоторых солей (нитрата, карбоната) или оксидов Ni2О3, Ni3О4, NiО2.


Химические свойства:
· Оксид никеля термически очень устойчив. Только при температурах выше 1230 °C становится заметна его обратимая диссоциация:

· Также он проявляет амфотерные свойства (основные преобладают), в воде практически не растворим:

· Реагирует с кислотами:

· При спекании взаимодействует с щелочами и оксидами типичных металлов:


· С концентрированным раствором аммиака образует амминокомплексы:

· При сплавлении с кислотными оксидами образует соли:

· Восстанавливается водородом или другими восстановителями (С, Mg, Al) до металла:

Его применяют в керамическом производстве при изготовлении эмалей и красок и в стекольном производстве для окрашивания стекла в серый цвет.
2. Гидроксид никеля(II) Ni(OH)2 - неорганическое соединение, светло-зелёные кристаллы, не растворяется в воде, образует гидраты. Получают действием щелочей на водные растворы солей никеля. Он имеет вид светло-зеленого рыхлогоосадка.


Химические свойства:
· Реагирует с кислотами:

· При нагревании разлагается:
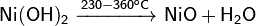
· Реагирует с щелочами с образованием тетрагидроксоникелатов:

· С растворами аммиака образует комплексныеаммины:


· Является слабым восстановителем:

При нагревании металлический никель взаимодействует с галогенами, серой, селоном, теллуром, фосфором, мышьяком, сурьмой, углеродом, кремнием и бором, образуя различные соединения: NiF2, NiCl, NiBr2, NiI2, NiS, Ni3S2 и др.[25]
«Безводные соли никеля окрашены в желтый [NiCl2, NiSO4, Ni(CN)2], коричневый (NiBr2), серый (NiI2) или зеленый (NiF2) цвет.» [26]
1. Дифторид никеля — неорганическое соединение, соль металла никеля и плавиковой кислоты с формулой NiF2, образует длинные призматические кристаллы, в сухом состоянии имеющие окраску от светло-коричневой до зеленой. Он плохо растворим в воде, спирте, эфире. Безводную соль легче всего получать термическим разложением двойного фторида никеля и аммония. Например, это реакции никеля и фтора:

Или реакция хлорида никеля(II) и фтора:

Химические свойства:
· Кристаллогидрат при нагревании теряет воду:

· Реагирует с щелочами:

· Реагирует с растворами аммиака:

· Восстанавливается водородом:

· С фторидами щелочных металлов образует комплексные соли:

· С фторидами щелочных металлов и фтором образует соли гексафтороникеляты:

2. «Дихлорид никеля, NiCl2, получают действием сухого хлора на нагретый до 600-800° порошкообразный металлический никель, длительным действием хлора на металлический никель в атмосфере влажного воздуха при обычной температуре, нагреванием соединения [Ni(NH3)6]Cl2до 450°, нагреванием кристаллогидратов NiCl2•nH2O (где n = 7, 6, 4, 2, 1) при 500-600° в токе газообразного HCl»[27]

Это соединение представляет собой блестящие золотисто-желтые ромбоэдрические кристаллы.
Химические свойства:
· Превращается в NiO при прокаливании на воздухе или в кислороде.
· Восстанавливается водородом при нагревании.
3. Фосфат никеля (II) — неорганическое соединение, соль металла никеля и ортофосфорной кислоты с формулой Ni3(PO4)2, жёлтые кристаллы, не растворяется в воде, образует кристаллогидраты — зелёные кристаллы. Получают путем действия гидрофосфата натрия на растворимую соль никеля (II):

Химические свойства:
· Кристаллогидрат ступенчато разлагается при нагревании:

4. Цианид никеля (II) — неорганическое соединение, соль металла никеля и синильной кислоты с формулой Ni(CN)2, коричнево-жёлтый порошок, не растворяется в воде, образует кристаллогидраты. Получают нагреванием гидратов Ni(CN)2 • nH2O (n = 7, 4, 3, 2) или аммиакатов [Ni(NH3)4] • 2H2Oпри 180-200° в атмосфере азота:

Химические свойства:
· Кристаллогидрат разлагается при нагревании:

· Растворяется в избытке цианидов:

5. Хлорид гексаамминникеля (II) — неорганическое соединение, комплексный аминн соли металла никеля и соляной кислоты с формулой [Ni(NH3)6]Cl2, сине-фиолетовые кристаллы, растворимые в холодной воде. Получение происходит путем:
Действия газообразного аммиака на хлорид никеля (II):

Действия избытка аммиака на концентрированный раствор хлорида никеля (II):

Действия хлорида аммония на концентрированный раствор сульфата никеля (II)-аммония:

Химические свойства:
· Разлагается при нагревании:

· Разлагается при кипячении водных растворов:

· Реагирует с кислотами:

· Реагирует с щелочами:[28]

6. Сульфид никеля (II) — бинарное неорганическое соединение, соль металла никеля и сероводородной кислоты с формулой NiS, представляет собой блестящие бронзово-желтые кристаллы, не растворяется в воде, встречается в природе в виде минерала миллерита. «Сульфид никеля имеет важное значение как катализатор. Известны основной сульфид 2NiS • NiO, кислый сульфид Ni(HS)2и двойные сульфиды, например 3NiS•K2S–серые кристалы, 4NiS•BaS–красные кристаллы.»[29]
Получают данное соединение пропусканием сероводорода через раствор соли двухвалентного никеля:

Сплавлением никеля и серы:

Действием растворимых сульфидов на раствор соли двухвалентного никеля:

Химические свойства:
· Растворяется в горячей концентрированной соляной кислоте:

· Реагирует с окисляющими кислотами:

· Медленно реагирует с влагой воздуха:

· При нагревании окисляется кислородом воздуха:

· Реагирует в серой при сплавлении:

· Восстанавливается монооксидом углерода:

7. Нитрат никеля (II) — неорганическое соединение, соль металла никеля и азотной кислоты с формулой Ni(NO3)2, светло-зелёный порошок, «хорошо растворимый в жидком аммиаке с образованием фиолетово-розового раствора и превращающийся при прокаливании до 550° в кислороде в остаток, состав которого варьируется между NiOи NiO2. Получают нагреванием до плавления кристаллогидрата Ni(NO3)2 • 6H2Oили обработкойдымящей HNO3водного раствора нитрата никеля (II), сконцентрированного до сиропообразной консистенции.»[30]
Химические свойства:
· Безводная соль при нагревании разлагается:

· Реагирует с щелочами:

· Является слабым восстановителем:

8. Дииодид никеля — неорганическое соединение, соль металла никеля и иодистоводородной кислоты с формулой NiI2, серые ромбоэдрическиекристаллы, хорошо растворяется в воде и спиртах. Получают нагреванием тонкодисперсного порошкообразного металлического никеля в парах иода:

Химические свойства:
· Восстанавливается водородом:

9. Бромид никеля (II) — неорганическое соединение, соль металла никеля и бромистоводородной кислоты с формулой NiBr2, жёлто-коричневые кристаллы, хорошо растворяется в воде, образует кристаллогидраты.
Получают нагревание тонкодисперсного порошка металлического никеля в парах брома:

Пропусканием бромистого водорода с раскалённым оксидом никеля(II):

Химические свойства:
· Кристаллогидрат при нагревании теряет воду:

· Разлагается при сильном нагревании на воздухе:
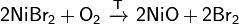
· Восстанавливается водородом:

10. Ацетат никеля (II) — неорганическое соединение, соль металла никеля и уксусной кислоты с формулой Ni(СН3СОО)2, зелёные кристаллы, растворяется в воде, образует кристаллогидраты. Получение осуществляется действием уксусной кислоты на гидроксид никеля:

Действием уксусной кислоты на карбонат никеля:

Химические свойства:
· Водные растворы при нагревании гидролизуются:

III. Соединения трехвалентного никеля
1. Оксид никеля (III) Ni2О3 - бинарное неорганическое соединение металла никеля и кислорода, тёмно-серый порошок, образует гидраты, не растворяется в воде. Применяют для изготовления анодов щелочных аккумуляторов. Получают медленным нагреванием нитрата никеля (II) или хлората никеля (II).
Химические свойства:
· Разлагается при нагревании до оксида никеля(II,III):

2. Гидроксооксид никеля (III) — неорганическое соединение, гидроксооксид металла никеля с формулой NiO(OH) (иногда записывают как Ni2O3•H2O), серо-чёрный аморфный осадок или чёрные кристаллы, нерастворимые в воде. Получают путем:
Окисления гидроксида никеля(II) хлором в щелочной среде:

Электролиза гидроксида никеля(II):

Разложения при нагревании кристаллогидрата нитрата никеля(II):

Химические свойства:
· Разлагается при нагревании:

· Является сильным окислителем:


 [31]
[31]
Возможное применение соединений никеля в медицине
(Прохоренок Наталья и Исакова Валентина)
В связи с прогрессирующим развитием значительного числа технических отраслей появилась значительная потребность в сталях и сплавах, содержащих в большом количестве легирующие элементы, а также имеющих особые физические, химические и механические свойства. В этом отношении приоритетная роль принадлежала и принадлежит никелю, никелевым сталям и никелевым сплавам. В настоящее время известно более 3000 составов различных сталей и сплавов, где никель является основой или присутствует как легирующий элемент.
Применение никеля в современной технике весьма разнообразно и имеет большое распространение. Он применяется в чистом виде как химически стойкий, ферромагнитный материал в аппаратостроении, как катализатор и как материал для аккумуляторов. Чистый никель применяется в значительных масштабах для защитных поверхностных покрытий: так называемое никелирование имеет большое значение для придания поверхности металлических материалов высокой химической стойкости.[32]
1. Содержание элемента в организме человека и депонирование в органах и тканях
«Жизненая необходимость никеля была продемонстрирована Nielsen (1970), Anke (1973) и Kirchgessner (1975). Неоценимость никеля для человека проявляется в его прямом участии в метаболизме и опосредованном воздействии на организм человека через симбиотическую флору кишечника и экзогенные никельсодержащие ферменты.
Всасывание никеля происходит путем активного транспорта и облегченной диффузии, при этом избыточное поступление никеля в полость кишечника сопровождается перенасыщением переносчиков и предотвращает усвоение металла. В целом, происходит всасывание менее 1 % от поступающего в избыточном количестве никеля».
Концентрация никеля в органах и тканях животных невысока. Наибольшее содержание этого элемента было найдено в кости, легких, причем в последних с возрастом его содержание возрастает. [33]
2. Взаимодействие никеля с другими элементами
Никель является своеобразным катализатором для усиления всасывания железа в желудочно-кишечном тракте. При нехватке никеля повышается выведение организмом кальция и железа, что приводит к развитию ряда патологических состояний.
Чрезмерное накопление никеля приводит к дефициту селена, цинка и хрома. При совершении никелем иммунотоксичного, генотоксичного и канцерогенного эффектов главными антагонистами его являются медь и магний.
Медицинские препараты, содержащие никель, представлены в таблице № 1.
3. Способы применения никеля и его соединений
В значительном количестве никель применяется в металлургии, в частности в производстве различных сплавов. На сегодня эта область является приоритетной для применения никеля.
В сплавах никель участвует главным образом в сочетании с железом и кобальтом. Он является легирующим элементом в различных конструкционных сталях, а также в магнитных и немагнитных сплавах, сплавах с особыми физическими свойствами, нержавеющих и жаропрочных сталях. Также распространены сплавы на никелевой основе в сочетании с хромом, молибденом, алюминием, титаном, бериллием.
Небольшое количество никеля расходуется для предохранения изделий из коррозионно-нестойких материалов, такие материалы никелируют.
Для химической промышленности никель важен как один из самых активных катализаторов, широко применяемый при многих химических процессах.
Из чистого никеля изготовляют химическую посуду, различные аппараты, приборы, котлы с высокой коррозионной стойкостью и постоянством физических свойств, а из никелевых материалов — резервуары и цистерны для хранения в них пищевых продуктов, химических реагентов, эфирных масел, для транспортирования щелочей, для плавления едких щелочей.
Никелевые трубы применяют для изготовления конденсаторов в производстве водорода, для перекачки щелочей в химическом производстве. Никелевые химически стойкие инструменты широко используют в медицине и научно-исследовательской работе. Никель применяется для приборов радиолокации, телевидения, дистанционного управления процессами в атомной технике.
В областях машино- и приборостроения используются, как правило, никелевые аноды и катоды (анод — положительный электрод источника электрического тока, катод — отрицательный электрод источника тока. Никелевые аноды и катоды представляют из себя листы, производящиеся по утвержденным стандартам и технологическим условиям. Вышеперечисленные способы применения никеля и его соединений имеют отношение к различным сферам медицины (обслуживания, диагностики и лечения).[34]
4. Применение никеля в медицине
Продолжительность жизни человека определяется многими факторами, к концу ХХ века средняя продолжительность жизни людей увеличилась на 30 лет по сравнению с IХХ веком. Данные показывают, что на данный момент люди живут дольше, чем их предки, по разным причинам, но, в основном, благодаря бурному развитию технологий, которые позволяют нам сохранить здоровье − более эффективной и качественной медицине, чистой воде, новым методикам, хорошему оборудованию и более совершенным хирургическим инструментам. Самое важное − это использование качественных и чистых хирургических инструментов, многие из которых сделаны из никеля. Хирургическая нержавеющая сталь имеет в своем составе никель. [35]
· Хирургические инструменты
Хирургическое оборудование должно быть устойчиво к воздействию агрессивных сред (кровь, экссудат) в отношении коррозии. Оксидный слой нержавеющий стали обеспечивает минимальную абсорбцию воды, сохраняет чистоту поверхности и обладает высокой коррозионной стойкостью, благодаря чему нержавеющая сталь является идеальным материалом для производства медицинского оборудования.
Хирургическое вмешательство редко бывает желанным или приятным, но, когда операция неизбежна, нужно полагаться не только на опыт хирургов, но и на качество инструментов, которые они используют.
С начала 20-го века хирургические инструменты стали производиться из никельсодержащей нержавеющей стали. Эти сложные инструменты постоянно подвергаются обязательной стерилизации и очистке. Никельсодержащая нержавеющая сталь выдерживает бесконечное количество процессов стерилизации, сохраняя при этом свои антикоррозионные свойства. Поэтому содержащие никель инструменты имеют более длительный срок службы, чем те, которые сделаны из других видов стали.
Хирургические инструменты бывают различных форм и видов − от простых игл для наложения швов до более сложных инструментов для аспирации. Являясь очень пластичным материалом, никельсодержащая нержавеющая сталь легко поддается сварке. Вид отделки поверхности инструментов, например, блестящая или матовая, также играет важную роль в медицине, поскольку она оказывает влияние на такое важное свойство, как биосовместимость материала, или на то, может ли вообще данный материал соприкасаться с тканями организма. Гладкая и в связи с этим обладающая большей биосовместимостью поверхность получается в результате электролитического полирования. Данный метод, используемый наряду с методом нанесения гальванического покрытия, делает поверхность металла гладкой, блестящей, устраняет заусенцы и очищает металл, избирательно удаляя микровыступы на его поверхности.
При электролитическом полировании на поверхности нержавеющей стали образуется защитный оксидный слой, содержащий большое количество хрома. Этот оксидный слой имеет большую толщину во впадинах и меньшую на микровыступах поверхности металла. Нержавеющая сталь − единственный материал, на поверхности которого образуется такой защитный слой.
Все медицинские изделия, при изготовлении которых используется нержавеющая сталь, отличается высокой прочностью.[36]
· Медицинские имплантаты
Развитие медицины неразрывно связано с развитием культуры человечества. В прошлом существовало множество попыток внедрить чужеродные материалы в организм человека, но, к сожалению, это приводило к плачевным результатам.
Изобретение имплантатов − изделий, заменяющих или действующих вместо отсутствующих биологических структур, стало настоящим прорывом для множества достижений в современной медицине. В зависимости от свойств, которыми должен обладать тот или иной имплантат, для их изготовления используются разные виды никелевых сплавов.
При этом имплантаты и приспособления, которые испытывают на себе дополнительную нагрузку, например, винты для фиксации костей и протезы, часто изготавливают из никельсодержащей нержавеющей стали из-за ее высокого предела прочности на разрыв. Например, при эндопротезировании тазобедренного сустава осуществляется замена как головки бедренной кости, так и суставной впадины тазобедренного сустава, на протез из нержавеющей стали с 10% содержанием никеля.
Имплантация широко применяется в стоматологической практике.
Увеличение продолжительности жизни влечет за собой необходимость осуществления таких медицинских процедур, как эндопротезирование всех суставов, дальнейшее развитие челюстно-лицевой хирургии и хирургии коронарных сосудов. Нет сомнения в том, что никелевые сплавы в медицинских имплантатах помогли повысить качество жизни миллионов людей во всем мире.[37]
· Стенты для сосудов
Еще одним распространенным видом имплантатов являются стенты. Операция стентирования относится к щадящим операциям, показанным при сужении сосудов. Данная операция выполняется при ишемической болезни сердца, после инфарктов миокарда, аритмиях.
Стент представляет собой полую трубку, которая обеспечивает расширение суженных артерий и часто используется при лечении закупорки и сужения коронарных сосудов.
Эти стенты изготавливают из сплава никеля и титана Nitinol, поскольку такой сплав обладает свойством памяти формы и отличается высокой эластичностью.
Каждый год более миллиона людей в мире в процессе лечения коронарных заболеваний сердца переносят операцию, именуемую ангиопластика. В 90% случаев долговременный успешный результат лечения достигается благодаря использованию стента, изготовленного из сплава Nitinol с антибактериальным покрытием. До изобретения данной методики специалисты по ангиопластическим операциям могли рассчитывать лишь на 60% успешных результатов.
«При металлической артропластике отмечается наибольшее повышение в сыворотке крови уровней кобальта и хрома. Величины марганца, молибдена, никеля остаются нормальными. При обследовании и лечении больных с окклюзией (сужением) бедренной артерии было установлено, что постановка никелевого стента дает существенно меньше рестенозов (повторных сужений), чем балонная ангиопластика».[38]
· Стоматология и ортодонтия
Известно, что в стоматологии используется огромное количество различных металлов. Стоматологи используют металлы и прочие материалы для восстановления зубов − пломбирования, установки коронок и мостов. Врачи-ортодонты также используют металлические приспособления − проволоки, бюгели и брекет-системы. С 20-х годов ХХ века никель стал активно применяться в данных областях.
В стоматологии никель используется из-за своей прочности и коррозионной стойкости, а также благодаря способности этого металла легко образовывать сплавы с другими металлами. Можно заметно повысить прочность любого мягкого металла, например, золота, если добавить к нему никель в качестве присадки.
Аналогично использованию с целью изготовления стентов, никелиды титана особенно часто используются в ортодонтии для выпрямления зубов. Ортодонт берет прямую проволоку и изгибает ее по форме неровных зубов. Благодаря свойству памяти формы эта проволока стремится восстановить свою первоначальную форму и медленно распрямляется, двигая за собой и зубы. В результате постоянного давления зубы со временем выравниваются. Существует также такой вид сплава, как Nitinol, который при низкой температуре обретает мягкость. При охлаждении проволока из этого сплава становится мягкой как вареные спагетти, что позволяет придать ей нужную форму. Нагреваясь в полости рта материал постепенно возвращается в исходное положение.[39]
· Имуннология. Дерматология ( лечение псориаза)
Псориаз – это заболевание кожи, при котором появляются красные шелушащиеся пятна, покрытые серебристыми чешуйками, вызывающие зуд. Существует много теорий по этиологии данной патологии, но в настоящее время ни одна из них не является доказательной.
«При лечении псориаза интересен один из опытов применения никеля. Вводимый никель играет роль каталитического блокатора воспалительного процесса. Для проверки этой гипотезы было проведено изучение безопасности приема бромида никеля здоровыми добровольцами и больными псориазом. С помощью спектрофотометрического анализа и специальной техники забора крови (с использованием тефлонового внутривенного катетера, исключающего попадание никеля в пробы извне), выявили повышение содержания никеля в крови больных псориазом, что могло быть следствием его дефицита в тканях. Предполагалось, что пероральный (через рот) прием никеля может форсировать пенетрацию (внедрение) никеля в ткани и устранить поражение кожи. При пероральном приеме никеля бромида в дозе 56 мкг/кг/день, что соответствует дозе никеля 15 мкг/кг/день, удалось достигнуть равновесие уровня никеля в крови через 2 недели от начала приема. Прием никеля в течение 10 недель не вызывал никаких побочных эффектов в здоровых; у больных псориазом в первые недели приема исчезал зуд и жжение в очагах; в последующие 10 недель отмечался регресс 95% очагов. Эффективность никеля бромида у больных псориазом доказана методом двойного слепого исследования с использованием плацебо и чередованием в процессе клинического испытания препарата и плацебо. На основании этих исследований был разработан лекарственный препарат «Ломо-псориаз» - раствор для приема внутрь. Основные активные компоненты – никель и бромиды. Никель способствует восстановительным процессам, активируя обмен веществ, а бромиды обладают седативным действием.
Лучшие результаты лечения никелем в составе «Ломо-псориаза»отмечались у пациентов молодого возраста (до 40 лет) с длительностью заболевания до 10 лет. Сроки наступления ремиссии составляли от 3 до 9 недель. В период с 1-ой по 4-ю недели лечения отмечались признаки регрессозаболевания – прекращение зуда, уменьшение шелушения, гиперемии и инфильтрации в очагах поражения». [40]
· Защита от электромагнитного излучения
Никель является наиболее часто используемым металлом для создания покрытия в системах защиты от электромагнитных помех, поскольку он обладает магнитными свойствами и поглощает электромагнитные помехи лучше других материалов. В медицинских учреждениях часто запрещают пользоваться мобильным телефоном, потому что электромагнитные помехи (ЭМП), создаваемые работой мобильных телефонов, а также других источников ЭМП, таких как телевизионные передатчики, полицейские рации и т.д., могут вызывать сбои в работе электронного оборудования.
Чтобы защитить электронную аппаратуру от помех такого рода, используется особый вид жидкости с содержанием металлического порошка. Эту жидкость разбрызгивают на внутреннюю поверхность пластмассового корпуса электронного прибора, тем самым создавая равномерный слой металла, который может быть электрическим способом подсоединен к вспомогательным устройствам. Именно никель является часто используемым металлом для создания покрытия в системах защиты от электромагнитных помех.[41]
5. Об ограничении применения никелевых покрытий в Европе
Достоверно известно, что никель и его соединения могут вызывать у людей сильную аллергическую реакцию. Так, по мнению европейских специалистов 15% женщин и 5% мужчин подвержены «никелевой» аллергии. В связи с этим с января 2000 года в Европе запрещено продавать ювелирные изделия и бижутерию, содержащие более 0,05% никеля, или изделия, контакт с которыми приведет к тому, что 1 см2 кожи человека будет соприкасаться с 0,05 мг никеля в течение недели. Это правило распространяется на все страны, входящие в Европейское Сообщество (ЕС) и на новых членов ЕС. Данное требование касается не только бижутерии и ювелирных изделий, но и любых других вещей и изделий, содержащих вышеуказанное количество никеля.
Соответствующий закон как Директива Европейского Сообщества 76/769/ЕЕС, был подготовлен еще в 80-е годы прошлого века, но его применение задерживалось в течение многих лет из-за отсутствия соответствующих методов контроля таких малых количеств никеля.
В 1999 году были окончательно приняты три Постановления. Первое - EN 810 касалось запрета на использование никеля в изделиях «пирсинга», особенно популярного у молодежи. Второе – EN 1811 предназначено для ограничения применения изделий с вышеуказанным содержанием никеля, находящихся в «прямом и длительном контакте». Постановление EN 12472 относилось к изделиям, предназначенным к использованию в течение более двух лет. Был также разработан и утвержден метод анализа, который должен использоваться для определения содержания никеля.
В России никаких запретов на применение никелевых покрытий не существует. Мало того, никелевые покрытия используются даже для медицинских инструментов. Вместе с тем, российским предприятиям, которые производят продукцию на экспорт, следует знать эти европейские требования, чтобы вовремя суметь перестроиться и адаптироваться к европейским стандартам.[42]
Заключение
Подводя итог, можно сказать, что никель является очень важным металлом. Этот элемент распространен на нашей планете: он входит в состав различных руд и минералов. Никель принимает участие во многих процессах в организме человека: может активировать или же угнетать ряд ферментов, влиять на РНК и ДНК, его соединения играют ведущую роль в кроветворных и других процессах. Также, его применение в современной технике довольно разнообразно. Он является главным материалом для защитных поверхностных покрытий, так как обладает высокой химической стойкостью, служит составляющим аккумуляторов и различных аппаратов.
Никель - исключительно перспективный металл, поэтому нет никакого сомнения в том, что его добыча будет непрерывно увеличиваться.
Приложение
Таблица №1
| Препарат, фирма (страна) | Форма выпуска | Химическая композиция | Основные показания к применению |
| 1 | 2 | 3 | 4 |
| Больше, чем поливитамины. Кид’с формула. БАД (PharmaMed Natural’s, Канада) | Таблетка жевательная | 1 мкг Ni+ в виде сульфата никеля | Полигиповитаминоз, микроэлементоз; период интенсивного роста, подготовки к оперативным вмешательствам и в послеоперационный период |
| Витамаунт комплит (Apic USA Inc, США) | Капсула | 4 мкг Ni+ в виде сульфата никеля | Поливитаминно-минеральный комплекс. Дефицит витаминов и минералов в организме |
| Витрум (Unipharm Inc, США) | Таблетка, покрытая оболочкой | 5 мкг Ni+ | Те же |
| Витрум Перфоменс (США) | Таблетка, покрытая оболочкой | 5 мкг Ni+ | Те же |
| Витрум Центури (Unipharm Inc, США) | Таблетка, покрытая оболочкой | 5 мкг Ni+ в виде сульфата никеля | Те же |
| Капли Береш-плюс (Венгрия) | Капли | 11 мкг Ni+ | Те же |
| Лома- Псориаз (Loma Lux/Plymouth) | Раствор для приема внутрь | Псориаз | |
| Спектрум 50+ Лайф формула. БАД(Pharma Med Naturalis, Канада) | Таблетка | 5 мкг Ni+ | Дефицит витаминов и макро-,микроэлементов в организме у людей зрелого возраста. |
| Спектрум с Лютеином для глаз Лайф. БАД (Pharma Med Naturalis, Канада) | Таблетка | 5 мкг Ni+ | Миопия различной степени тяжести, возрастном ухудшении зрения, начальной возрастной катаракте, после операций на глазах |
| 1 | 2 | 3 | 4 |
| Супер Мульти-Витамины. БАД (Кобра Интерфарм, Россия) | Таблетка | 1,25 мкг Ni+ | Те же |
| Центрум (WHITEHALL, США) | Таблетка, покрытая оболочкой | 5 мкг Ni+ | Поливитаминно-минеральный комплекс. Дефицит витаминов и макро-,микроэлементов в организме |
| Центрум Сильвер (Wyeth Lederle, США) | Таблетка, покрытая оболочкой | 15 мкг Ni+ в виде сульфата никеля | Те же |
| Центрум Сильвер с Лютеином (Wyeth Lederle, США) | Таблетка, покрытая оболочкой | 5 мкг Ni+ | Те же |
| Цыгапан (Планета Здоровья-2000, Россия) | Капсула Таблетка Порошок | Н.д. | Те же |
Библиографический список
1. Авцин А.П и др. Микроэлементозы человека: этиология, классификация, органопатология/А.П Авцин, А.А. Риш, Л.С. Строчкова; АМН СССР.- М.: Медицина, 1991.-496 с.
2. Грибовская И. Ф. Никель/ И. Ф. Грибовская//Большая советская энциклопедия/.-1974.-Т17.-С.610-613.
3. Глинка Н. Л. Общая химия/ Н. Л. Глинка.-Москва: Издательство Интегралл-Пресс, 2002.-С.529.
4. Глинка Н.Л. Общая химия: учебное пособие / Н.Л. Глинка. – Изд.стер. – М.: КНОРУС,2014. – С. 673-675.
5. Глинка Н. Л. Общая химия/ Н. Л. Глинка. - Москва: Издательство Химия, 1985.-С.673-675.
6. Гюнтер В. Э., Дамбаев Г. Ц., Сысолетин П. Т. и др. Медицинские материалы и имплантаты с памятью формы. — Томский ГУ, Томск, 2008. С. 488.
7. Диогенов Г. Г. Никель: прошлое, настоящее, будущее/ Г. Г. Диогенов// Химия в школе.-2001.-№8.-С.90-92.
8. Дриц М. Е. Свойства элементов / М. Е. Дриц [и др.].- Москва: Издательство Металлургия, 1985.-С.481-492.
9. Ершов Ю.А., Кононов А.М., Пузаков С.А., Попков В.А., Бабков А.В., Трофимов Л.И. Практикум по общей химии (учебное пособие для студентов медицинских спец. вузов). М.: Высшая школа, 2008.-С. 230.
10. Ершов Ю.А., Попков В.А., Берлянд А.С., Книжник А.3. Общая химия (учебник для студентов медицинских специальностей высших учебных заведении). М.: Высшая школа, 2010.-С. 250.
11. Кудрин А.В. Микроэлементы в иммунологии и онкологии / А.В Кудрин, О.А. Громова.-М.; ГЭОТАР-Медина,2007.-59с.
12. Кудрин А.В. Микроэлементы в неврологии/А.В Кудрин, О.А Громова. – М.; ГЭОТАР-Медина,2006.-304с.
13. Никель //Большая советская энциклопедия/.-1939.-Т42.-С.110-111.
14. Оганесян Э.Т. Неорганическая химия / Э.Т. Оганесян. – М.: Высшая школа, 1984. – с. 358-362.
15. Пешкова В. М. Аналитическая химия никеля / В. М. Пешкова, В. М. Савостина/.-Москва: Издательство наука, 1966.-C.5-7.
16. Ребров В.Г. Витамины макро- и микроэлементы / В.Г. Ребров, О.А. Громова.-М.; ГЭОТАР-Медина,2000.-102с.
17. Редкол.:Кнунянц И. Л. (гл. ред.). Химическая энциклопедия: в 5 т. — Москва: Большая Российская энциклопедия, 2009. — Т. 3. — С. 240.
18. Рипан Р., Четяну И. Неорганическая химия. Химия металлов. – М.: Мир, 1972. – Т. 2. – с. 593-614.
19. Справочник химика / Редкол.: Никольский Б.П. [и др.]. — 2-е изд., М.-Л.: Химия, 1966. — Т. 1. — 1072 с.
20. Справочник химика / Редкол.: Никольский Б.П. [и др.]. — 3-е изд., испр. Л.: Химия, 1971. — Т. 2. — 1164-1168 с.
21. Федоров П. И. Никель/ П. И. Федоров// Химическая энциклопедия.-1992.-Т.3.-С.240-242.
[1] Третьяков Ю. Д. (ред.) «Неорганическая химия» в 2 т. — т. 1, стр. 391 — М.: «Химия», 2005.
[2] Третьяков Ю. Д. (ред.) «Неорганическая химия» в 3 т. — том 3, книга 2, стр. 40 — М.:"Академия", 2007.
[3] Третьяков Ю. Д. (ред.) «Неорганическая химия» в 3 т. — том 3, книга 2, стр. 40 — М.:"Академия", 2007.
[4] Третьяков Ю. Д. (ред.) «Неорганическая химия» в 2 т. — т. 1, стр. 391 — М.: «Химия», 2005.
[5] Третьяков Ю. Д. (ред.) «Неорганическая химия» в 2 т. — т. 1, стр. 391 — М.: «Химия», 2005.
[6] Горная энциклопедия // Миллерит / Под редакцией Е. А. Козловского. — М.: Советская энциклопедия, 2009.
[7] Горная энциклопедия // Миллерит / Под редакцией Е. А. Козловского. — М.: Советская энциклопедия, 2009.
[8] Рудные месторождения СССР / Под ред. А. Б. Васильева. — М.: Недра, 2008.
[9] Рудные месторождения СССР / Под ред. А. Б. Васильева. — М.: Недра, 2008.
10. Никель //Большая советская энциклопедия/.-1939.-Т42.-С.110-111.
Грибовская И. Ф. Никель/ И. Ф. Грибовская//Большая советская энциклопедия/.-1974.-Т17.-С.610-613.
Федоров П. И. Никель/ П. И. Федоров// Химическая энциклопедия.-1992.-Т.3.-С.240-242.
Дриц М. Е. Свойства элементов / М. Е. Дриц [и др.].- Москва: Издательство Металлургия, 1985.-С.481-492.
[11] Никель //Большая советская энциклопедия/.-1939.-Т42.-С.110-111.
[12] Дриц М. Е. Свойства элементов / М. Е. Дриц [и др.].- Москва: Издательство Металлургия, 1985.-С.481-492.
[13] Пешкова В. М. Аналитическая химия никеля / В. М. Пешкова, В. М. Савостина.-Москва: Издательство наука, 1966.-C.5-7.
[14] Пешкова В. М. Аналитическая химия никеля / В. М. Пешкова, В. М. Савостина/.-Москва: Издательство наука, 1966.-C.5-7.
[15] Никель //Большая советская энциклопедия/.-1939.-Т42.-С.110-111.
Грибовская И. Ф. Никель/ И. Ф. Грибовская//Большая советская энциклопедия/.-1974.-Т17.-С.610-613.
[16] Дриц М. Е. Свойства элементов / М. Е. Дриц [и др.].- Москва: Издательство: Металлургия, 1985.-C.490.
[17] Глинка Н. Л. Общая химия/ Н. Л. Глинка.-Москва: Издательство Интегралл-Пресс, 2002.-С.529.
[18] Глинка Н. Л. Общая химия/ Н. Л. Глинка.-Москва: Издательство Химия, 1985.-С.673-675.
[19] Грибовская И. Ф. Никель/ И. Ф. Грибовская//Большая советская энциклопедия/.-1974.-Т17.-С.610-613.
[20] Никель //Большая советская энциклопедия/.-1939.-Т42.-С.111.
[21] Грибовская И. Ф. Никель/ И. Ф. Грибовская//Большая советская энциклопедия/.-1974.-Т17.-С.611.
Глинка Н. Л. Общая химия/ Н. Л. Глинка.-Москва: Издательство Интегралл-Пресс, 2002.-С.529.
[22] Глинка Н. Л. Общая химия/ Н. Л. Глинка.-Москва: Издательство Химия, 1985.-С.673-675.
Диогенов Г. Г. Никель: прошлое, настоящее, будущее/ Г. Г. Диогенов// Химия в школе.-2001.-№8.-С.90-92
[23] Грибовская И. Ф. Никель/ И. Ф. Грибовская//Большая советская энциклопедия/.-1974.-Т17.-С.610-613.
Дриц М. Е. Свойства элементов / М. Е. Дриц [и др.].- Москва: Издательство Металлургия, 1985.-С.490.
[24] Рипан Р.,Четяну И. Неорганическая химия. Химия металлов.- М.:Мир, 1972.- Т.2.- с.593.
[25] Оганесян Э.Т. Неорганическая химия / Э.Т. Оганесян. – М.: Высшая школа, 1984. – с. 361-362.
[26] Рипан Р.,Четяну И. Неорганическая химия. Химия металлов.- М.:Мир, 1972.- Т.2.- с.594.
[27] Рипан Р.,Четяну И. Неорганическая химия. Химия металлов.- М.:Мир, 1972.- Т.2.- с.597.
[28] Справочник химика / Редкол.: Никольский Б.П. и др.. — 3-е изд., испр. Л.: Химия, 1971. — Т. 2. — 1164-1168
Рипан Р., Четяну И. Неорганическая химия. Химия металлов. – М.: Мир, 1972. – Т. 2. – с. 593-614.
[29]Рипан Р., Четяну И. Неорганическая химия. Химия металлов. - М.:Мир, 1972. – Т. 2. – с. 601
[30] Рипан Р., Четяну И. Неорганическая химия. Химия металлов. - М.:Мир, 1972. – Т. 2. – с. 603.
[31]Рипан Р., Четяну И. Неорганическая химия. Химия металлов. – М.: Мир, 1972. – Т. 2. – с. 593-614.
Глинка Н.Л. Общая химия: учебное пособие / Н.Л. Глинка. – Изд.стер. – М.: КНОРУС,2014. – С. 673-675.
[32] Электронная библиотека студента [Электронный ресурс] / Кафедра цветной металлургии; ред. Власенко Т. В. ; Web-мастер Козлова Н. В. — Электрон. дан. — М. : Рос. гос. б-ка, 1997 — Режим доступа: http//www.chemistrystudy.ru, свободный.
[33] Кудрин А.В . Микроэлементы в неврологии/А.В Кудрин, О.А Громова. – М.,-2006.-304с.
[34] Авцин А.П и др. Микроэлементозы человека: этиология, классификация, органопатология/А.П Авцин, А.А. Риш, Л.С. Строчкова; АМН СССР.- М.: Медицина, 1991.-496 с.
[35] Кудрин А.В . Микроэлементы в неврологии/А.В Кудрин, О.А Громова. – М.,-2006.-321с.
[36] Ребров В.Г. Витамины макро- и микроэлементы / В.Г. Ребров, О.А. Громова.-М.; ГЭОТАР-Медина,2008.-742с.
[37] Ребров В.Г. Витамины макро- и микроэлементы / В.Г. Ребров, О.А. Громова.-М.; ГЭОТАР-Медина,2008.-744с.
[38] Витамины, макро- и микроэлементы. Ребров В.Г., Громова О.А. - М., 2008. – С. 746
[39] Витамины, макро- и микроэлементы. Ребров В.Г., Громова О.А. - М., 2008. – С. 746
[40] Кудрин А.В. Микроэлементы в иммунологии и онкологии / А.В Кудрин, О.А. Громова.-М.,-2007.-59с.
[41] Кудрин А.В. Микроэлементы в иммунологии и онкологии / А.В Кудрин, О.А. Громова.-М.,-2007.-59с.
[42] [Электронный ресурс] /Российское общество гальванотехников
и специалистов в области обработки поверхности; ред. Кудрявцев В.Н.— Электрон. дан. — М. : Рос. гос. б-ка, 1992 — Режим доступа: www.galvanicrus.ru, свободный.














 (zip - application/zip)
(zip - application/zip)










